相关试卷
-
1、化学变化的本质特征是A、有颜色变化 B、有气体放出 C、发光、发热 D、有新物质生成
-
2、科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON)。请你根据丙烯酰胺(C3H5ON)的化学式计算后填写:
(1)丙烯酰胺(C3H5ON)的相对分子质量为_________________;
(2)碳元素和氧元素的质量比是____________________;
(3)氧元素的质量分数为_________________。
(4)142克丙烯酰胺(C3H5ON)中碳元素的质量为__________克。
-
3、根据下列实验装置图,回答问题。
 (1)、图中仪器a的名称是。(2)、用高锰酸钾制取氧气的文字表达式为 , 应用的发生装置为(填字母序号,下同)。(3)、用二氧化锰和过氧化氢溶液制取氧气,应选择的发生装置为。(4)、为了获得较为干燥的氧气,应选用的收集装置为。(5)、铁丝在氧气中燃烧实验中,集气瓶中要预留一些水,原因是 , 该实验的现象是。
(1)、图中仪器a的名称是。(2)、用高锰酸钾制取氧气的文字表达式为 , 应用的发生装置为(填字母序号,下同)。(3)、用二氧化锰和过氧化氢溶液制取氧气,应选择的发生装置为。(4)、为了获得较为干燥的氧气,应选用的收集装置为。(5)、铁丝在氧气中燃烧实验中,集气瓶中要预留一些水,原因是 , 该实验的现象是。 -
4、水是生命之源,也是人类最宝贵的资源。用你学过的化学知识回答下列问题:(1)、从物质的分类角度分析,水不属于(填字母)。
a.单质 b.氧化物 c.化合物 d.纯净物
(2)、欲除去水中不溶性杂质,需进行的操作是。(3)、硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。生活中可用方法来降低水的硬度。(4)、根据如下图回答下列问题:
试管A中的气体的名称是 , 写出电解水反应的文字表达式 , 该实验证明水是由组成的。
(5)、通常向自然界中的水投放高铁酸钠(化学式为 Na2FeO4)杀菌消毒,高铁酸钠中铁元素的化合价为 。(6)、我国有关部门规定,净化后进入用户的饮用水含铁<0.3mg·L-1 , 含铜<1.0mg·L-1。其中的“铁、铜”指的是___________(填正确选项前的字母)。A、原子 B、分子 C、元素 -
5、根据下列粒子的结构示意图,回答问题。

(1)达到稳定结构的粒子是(填序号,下同);
(2)表示同一种元素的粒子是;
(3)在化学反应中容易失去电子的粒子是;
(4)表示阴离子的是;
(5)B微粒变为稳定结构后,质子数为 , 核外有个电子层;
(6)C、E形成的化合物的化学式为。
-
6、用化学用语填空:(1)、4个硝酸根离子;(2)、5个水分子;(3)、3个亚铁离子;(4)、标出氧化钙中钙元素的化合价;(5)、保持二氧化碳化学性质最小的粒子是。
-
7、下图是表示某气体分子的示意图,图中“
 ”和“
”和“ ”分别表示两种不同质子数的原子,其中可以表示单质的是 A、
”分别表示两种不同质子数的原子,其中可以表示单质的是 A、 B、
B、 C、
C、 D、
D、
-
8、学习化学需要进行化学实验。下列实验操作错误的是A、
 滴加液体
B、
滴加液体
B、 添加酒精
C、
添加酒精
C、 加热液体
D、
加热液体
D、 放置试管
放置试管
-
9、下列变化与其他变化有本质区别的是( )A、酒精燃烧 B、粉笔折断 C、灯泡发光 D、玻璃破碎
-
10、规范的实验操作是实验成功的保证,请回答下列问题。(1)、胶头滴管用过后应 , 再去吸取其他试剂。(2)、倾倒细口瓶里的液体后,标签被腐蚀、字迹模糊,原因可能是。(3)、取用7.2mL蔗糖水需要用到的仪器有(填序号)。
①5mL量筒②10mL量筒③20mL量筒④胶头滴管⑤玻璃棒
-
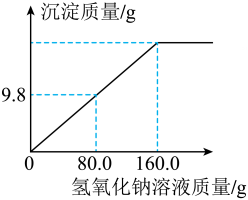
11、在化学校本实验活动中,小明同学取100.0g硫酸铜溶液置于烧杯中,再向烧杯中逐滴加入质量分数为10.0%的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。回答下列问题:
 (1)、用已知浓度和质量分数的溶液配制一定质量和质量分数的稀溶液,实验步骤:
(1)、用已知浓度和质量分数的溶液配制一定质量和质量分数的稀溶液,实验步骤:
Ⅰ.计算;Ⅱ.量取;Ⅲ.混匀;Ⅳ.装瓶。该取液体的体积时,视线应与量筒内液体保持水平;(2)、恰好完全反应时,生成沉淀的质量为g;(3)、恰好完全反应时,计算所得溶液中溶质质量分数。(写出计算过程,结果精确到0.1%) -
12、草木灰中含有碳酸钾,还可能含有硫酸钾、硫酸钾中的一种或两种。某化学兴趣小组对草木灰的成分进行了探究。
【作出猜想】草木灰中可能含有碳酸钾、硫酸钾中的一种或两种。
(1)、【设计实验】小组同学取适量草木灰于烧杯中,加入足量蒸馏水浸泡、搅拌、过滤,得到澄清草木灰水,备用。
甲同学:取少量草木灰水置于试管中,滴加足量稀硫酸,有大量气泡产生。由此得出草木灰中含有碳酸钾,发生反应的化学方程式为。
乙同学:取少量草木灰水于试管中,滴加足量氯化钡溶液,产生白色沉淀,结合甲同学的实验,得出草木灰中含有硫酸钾和碳酸钾的结论。
(2)、【提出质疑】丙同学认为乙同学结论不正确,理由是(用化学方程式表示)。(3)、【探究实验】请你和同组同学一起设计实验方案,帮助乙同学得到实验结论(将实验操作及实验现象填入相应的空格中):
实验操作
实验现象
实验结论
草木灰中含有硫酸钾和硫酸钾
(4)、【拓展应用】活动二:草木灰中碳酸钾含量的测定(假设草木灰中其他成分遇稀硫酸不产生气体)
丁同学称取一定质量活动一剩余的草木灰,利用已检查好气密性的图1装置进行定量实验,测得草木灰中碳酸钾的质量分数为10.0%,查阅资料后,发现测得的数值偏小,可能的原因是。
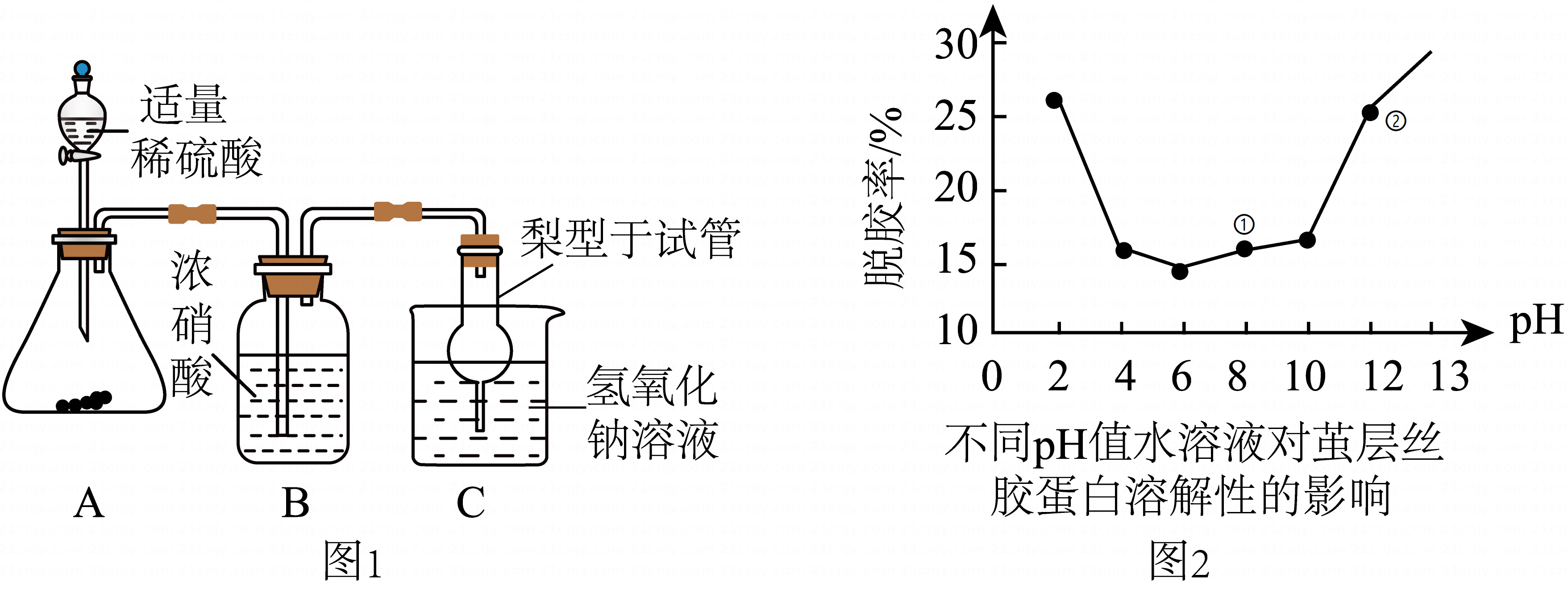 (5)、【拓展应用】
(5)、【拓展应用】脱胶率越高,所得的丝帛越顺滑亮丽,根据图2分析,清洗油烟机坠油时,选用(填序号)洗涤剂效果更好。
-
13、化学是一门以实验为基础的科学。结合所学知识回答下列问题:
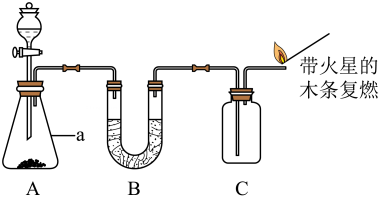 (1)、仪器a的名称。(2)、由图判断,装置A中反应的化学方程式为;下列与实验有关的图标,在该实验中无需标注的是(填序号)。
(1)、仪器a的名称。(2)、由图判断,装置A中反应的化学方程式为;下列与实验有关的图标,在该实验中无需标注的是(填序号)。 (3)、可用装置C收集气体,说明该气体可能具有的物理性质是。
(3)、可用装置C收集气体,说明该气体可能具有的物理性质是。 -
14、锌是维持生命活动的重要元素之一,目前工业上主要采用“酸法”冶炼锌,一兴趣小组以菱锌矿(主要成分是ZnCO3 , 还含有少量的SiO2和为原料制备锌,其工艺流程图如下。回答下列问题:
 (1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、由此流程可推知SiO2的性质有( )(填字母序号)。A、难溶于水 B、化学性质很活泼 C、不能与稀硫酸反应(3)、“酸浸”时,金属氧化物发生反应的化学方程式为。(4)、操作1、操作Ⅱ为过滤,滤后果汁滤纸(灰色部分代表滤纸),滤液分布的情况最接近图中的( )。A、
(1)、菱锌矿属于(填“纯净物”或“混合物”)。(2)、由此流程可推知SiO2的性质有( )(填字母序号)。A、难溶于水 B、化学性质很活泼 C、不能与稀硫酸反应(3)、“酸浸”时,金属氧化物发生反应的化学方程式为。(4)、操作1、操作Ⅱ为过滤,滤后果汁滤纸(灰色部分代表滤纸),滤液分布的情况最接近图中的( )。A、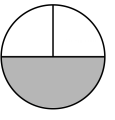 B、
B、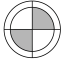 C、
C、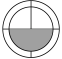 (5)、已知Fe2+和Zn2+开始沉淀和沉淀完全时的pH如下列表格所示,“除杂”过程中加入ZnO的目的是 , 通过调节溶液的pH使Fe+沉淀完全而Zn2+不沉淀,则pH的范围是。
(5)、已知Fe2+和Zn2+开始沉淀和沉淀完全时的pH如下列表格所示,“除杂”过程中加入ZnO的目的是 , 通过调节溶液的pH使Fe+沉淀完全而Zn2+不沉淀,则pH的范围是。
-
15、氯化钠和硝酸钾在不同温度时的溶解度如表,回答下列问题:
温度/℃
10
20
30
40
50
溶解度/g
氧化钠
35.8
36.0
36.3
36.6
37.0
硝酸钾
20.9
31.6
45.8
63.9
85.5
(1)、30℃时,氯化钠的溶解度为g。(2)、由表中数据分析,二者具有相同溶解度的温度范围是20℃<t<℃。(3)、40℃时,将20.0g氯化钠固体加入50.0g水中,充分溶解后所得溶液为溶液(填“饱和”或“不饱和”)。(4)、20℃时,向100.0g质量分数为12.0%的硝酸钾溶液中加入100g硝酸钾固体,充分溶解后,所得溶液中溶质的质量分数为。 -
16、“科学技术是第一生产力”,在材料制造领域,我国自主研发,持续创新。(1)、芯片是人工智能的核心,硅和氮化镓(GaN)都是制造芯片的重要材料。工业制硅过程中涉及反应: , X的水溶液可溶解蓝色的氢氧化铜固体,则盐酸溶解氢氧化铜的化学方程式为 , 镓(Ga)属于元素(填“金属”或“非金属”)。(2)、镁铝合金是目前最轻的合金,可将镁粉和铝粉的混合物粉末加入一定量的硫酸铜溶液中,充分反应后过滤,得到6.0g滤渣A,再向滤液A中滴加稀硫酸至不再有气体产生,收集到mg气体,过滤后得到2.4g滤渣B,则m的取值范围是。
-
17、中国传统文化对人类文明贡献巨大,许多诗句和典籍中都蕴含化学知识。(1)、西晋《蜀都赋》中有“火井沈荧于幽谷,高焰飞煽于天倪。”该句描写了天然气的燃烧,天然气的主要成分完全燃烧的化学方程式为。(2)、《三国志·关羽传》中记载,赤壁之战中,黄盖以“蒙冲斗舰数十艘,实以薪草,……时风盛猛,悉延烧岸上营落”。从燃烧条件分析,“时风盛猛”使火势更旺的原因是。(3)、《梦溪笔谈》中描述了一种液体化石燃料:“颇似淳漆,燃之如麻,但烟甚浓,所沾幄幕皆黑”。该化石燃料是石油,下列说法错误的是( )。A、石油是不可再生能源 B、石油炼制可得到汽油、煤油和柴油 C、化石燃料包括煤、石油、天然气、氢气等 D、化石燃料只能通过燃烧加以利用
-
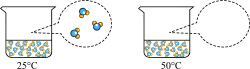
18、水是生命之源,是“永远值得探究的物质”。(1)、认识水的蒸发:下图是烧杯内的水在不同温度下蒸发时发生变化的微观示意图。请将50℃时相同空间内对应的微观示意图补充完整(图中“○”表示氢原子,“●”表示氧原子)。
 (2)、初探水的组成:电解水装置中,同电源负极相连的电极上产生的气体是H2 , 由此得出关于水的组成的结论是。(3)、了解水的净化:小明同学观察到学校、车站等公共场所安装有直饮式水机,他了解到直饮水机是将自来水净化为可直接饮用的水,其净水原理如图所示,图中步骤①的目的是。
(2)、初探水的组成:电解水装置中,同电源负极相连的电极上产生的气体是H2 , 由此得出关于水的组成的结论是。(3)、了解水的净化:小明同学观察到学校、车站等公共场所安装有直饮式水机,他了解到直饮水机是将自来水净化为可直接饮用的水,其净水原理如图所示,图中步骤①的目的是。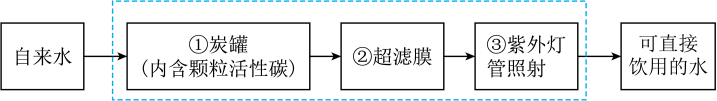 (4)、爱护水资源:保护水资源是全社会的共同责任,下列做法错误的是( )。A、为减少水体污染,要合理使用农药、化肥 B、厨房废水经必要处理后可直接排入九曲河 C、开展生产工作,提高用水效率 D、在河流、湖泊中建设植草滤沟有助于净化水质
(4)、爱护水资源:保护水资源是全社会的共同责任,下列做法错误的是( )。A、为减少水体污染,要合理使用农药、化肥 B、厨房废水经必要处理后可直接排入九曲河 C、开展生产工作,提高用水效率 D、在河流、湖泊中建设植草滤沟有助于净化水质 -
19、草树知春不久归,百般红紫斗芳菲。资阳市市花三角梅备受市民喜爱。(1)、飘落的花瓣、花粉属于哪一类污染物。(2)、嫩叶中富含铁、锌和膳食纤维,锌是人体所需的(选填“微量”或“常量”)元素。(3)、花瓣中含有单宁酸其燃烧时最多可以生成种氧化物。(4)、种植盆栽时,在展叶期为促进其叶片生长茂盛、叶色浓绿,应施加肥(填“钾”或“氮”或“磷”)。
-
20、向碳酸钙与盐酸反应后的废液中逐滴加入碳酸钠溶液,利用pH传感器记录实验数据,所得曲线如图所示,已知氯化钙溶液呈中性,下列说法错误的是( )
 A、废液中含有和HCl B、a→b→c的过程中,先有气泡产生,后有沉淀生成 C、c点对应的溶液中所含溶质种类最少 D、b→c→d的过程中,随着溶液的加入,溶液中氯化钠的质量不断增加
A、废液中含有和HCl B、a→b→c的过程中,先有气泡产生,后有沉淀生成 C、c点对应的溶液中所含溶质种类最少 D、b→c→d的过程中,随着溶液的加入,溶液中氯化钠的质量不断增加