-
1、正确的实验操作是实验成功和人身安全的重要保证。下列实验操作正确的是A、称量氢氧化钠
 B、读取液体体积
B、读取液体体积 C、过滤
C、过滤 D、配制溶液
D、配制溶液
-
2、被誉为“中国天眼”的500米口径球面射电望远镜工程圆满收官,这意味着人类探索宇宙有了更加深邃的视角。某同学认为制造“天眼”的球面射电板可能是铝合金板制的,就该同学的“认为”而言,属于科学探究中的A、提出问题 B、猜想与假设 C、进行实验 D、获得结论
-
3、少年强则国强!为了祖国的发展和复兴,青少年不仅要努力学习,还要强壮身体。青少年在生长发育期对钙的需求量相对较多,如果从食物中摄取不足,需要从药物或保健品中摄取,如图为某制药厂生产的高钙片标签上的部分文字,请仔细阅读后回答下列问题。
[主要原料]碳酸钙(CaCO3)、维生素D
[功效成分]补钙
每片中含:钙(以Ca计)500mg 维生素D100IU
[食用方法]每日1次;每次1片
[规格]2.5g/片
(1)、CaCO3的相对分子质量为。(2)、按照标签内容服用,每日摄取碳酸钙的质量是多少g(写出计算过程)。 -
4、
中国空间站技术新突破!中国空间站水资源闭合度超95%,氧气资源100%再生,实现了由“补给式”向“再生式”的根本转换。化学小组的同学们对空间站水净化和氧气的再生产生了兴趣,并开启了项目化学习之旅。
任务一:了解空间站水资源净化的方法
【咨询专家】同学们通过数字化平台,向航天专家进行了咨询。
将尿液净化为饮用水的原理如图所示。
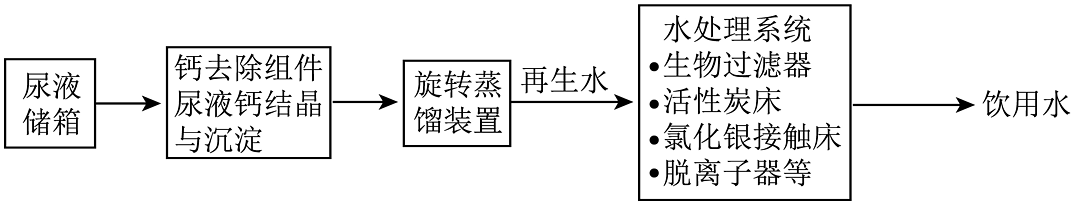
【小组交流】
(1)从微观角度分析,液态水与水蒸气的区别是________;
(2)“蒸馏”是利用了混合物中各组分的________不同将物质分离。
任务二:模拟空间站制取氧气
【咨询专家】空间站的氧气主要来自再生水电解制氧气系统。
【进行实验】设计实验方案,模拟空间站电解水制氧。
【交流讨论】
(3)空间站是一个相对封闭的场所,解决“气体从哪里来”的问题必然伴生着“气体往哪里去”的问题。为此,科学家设计了生物再生生命保障系统,实现了“水—氧—碳”的循环转化。下列叙述正确的是______。(填序号)。
A. “水—氧—碳”的循环转化,减少了氧气的携带量,减轻了火箭和飞船的载重 B. 富含二氧化碳空气经过净化后送达植物舱,供植物光合作用;植物舱产生的富氧空气经空气净化后送到综合舱供人和动物呼吸,形成碳氧循环 C. 人体代谢产物中的水既有气态又有液态,设计系统时应考虑水的冷凝与净化 任务三:探究空间站内空气成分
【设计方案】
(4)同学们根据所学知识认为:空间站内的空气与地球上的空气成分应大致相同,但也有所区别,空间站内的空气成分只需保留氮气和氧气即可。请你设计实验方案来测定空间站内空气中氧气的含量________。
【小组交流】
(5)同学们在航天专家的介绍中得知,3名航天员在空间站密封舱内驻留24小时,舱内氧气分压随时间的变化如图所示。航天员中度活动时氧气分压迅速下降的原因是________。
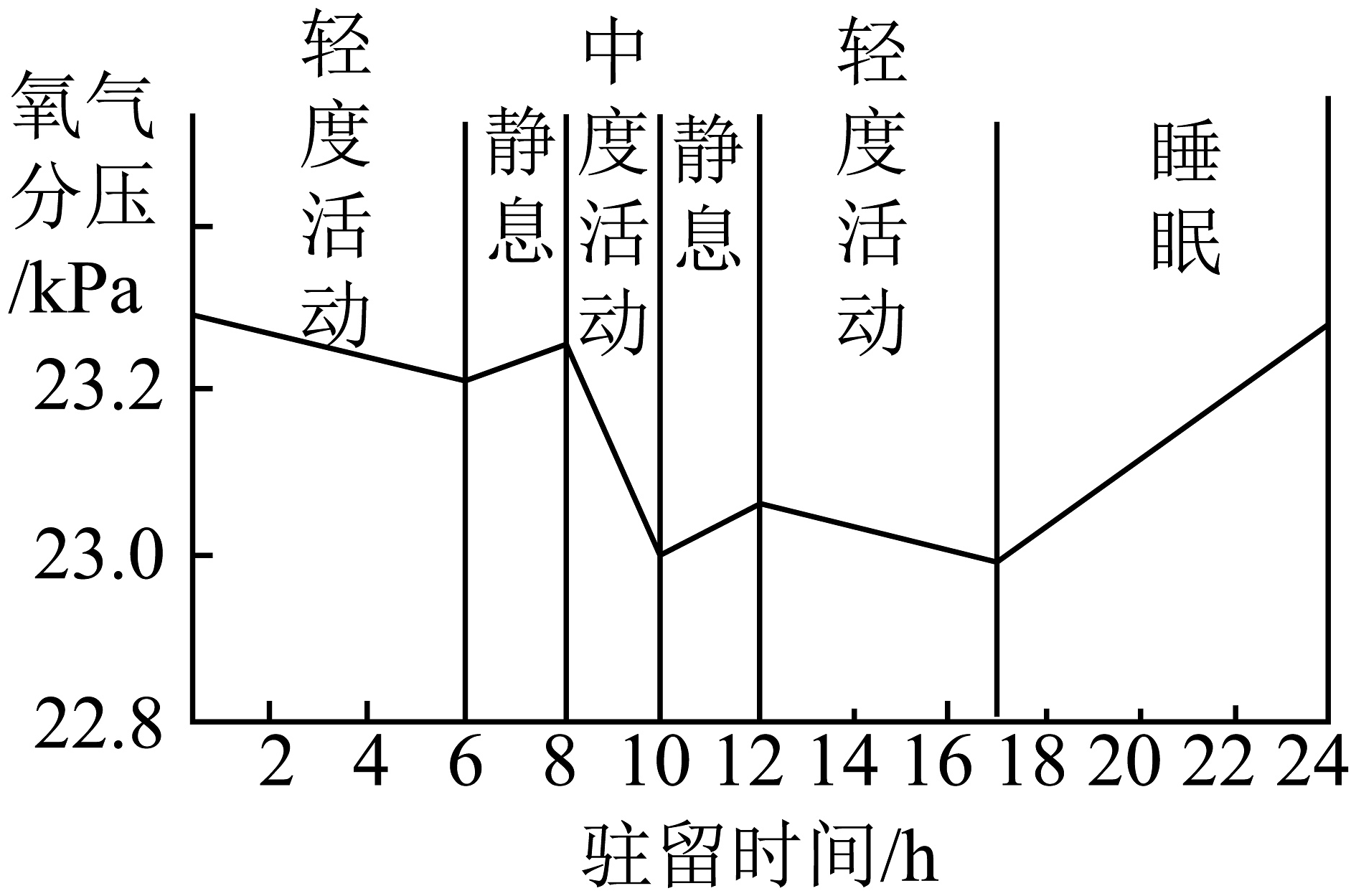
【成果分享】
(6)同学们通过各种方式,学到了空间站净化水和氧气再生知识。在项目化学习的成果报告中,同学们提出了空间站的水和氧气由“补给式”向“再生式”的根本转换的许多价值,请你也写出一条该转换方式的价值: ________(写一条)。
-
5、
某小组以“基础实验”为主题展开学习,回答下列问题:
【气体制取】实验室中现有高锰酸钾、过氧化氢溶液、二氧化锰,以及下列仪器装置,完成下列各题。在实验室中制取气体是初中重要的化学知识。

(1)实验仪器a的名称是;
(2)用过氧化氢溶液制取氧气选用的发生装置是;(填A~E字母序号)
(3)实验室用高锰酸钾制取氧气,发生反应的文字表达式是;
【学科实践】
资料:目前工业上制取氧气也可以利用分子筛技术,分子筛技术的核心是只允许分子直径较小的氧气通过,从而获得较高浓度的氧气,其原理示意图如图戊所示。根据资料推测:
(4)两种气体分子体积的大小:N2O2(填“>”或“<”)。
-
6、公园、车站等公共场所内设有许多直饮水机,其中水处理的过程如下图所示。请回答下列问题:
 (1)、步骤①中装置内放有活性炭,它能除去自来水中异味,体现了它的作用。(2)、步骤②中超滤膜相当于过滤操作。实验室中过滤用到的玻璃仪器有漏斗、烧杯、。(3)、自来水经处理后得到的直接饮用水属于(填“纯净物”或“混合物”)。
(1)、步骤①中装置内放有活性炭,它能除去自来水中异味,体现了它的作用。(2)、步骤②中超滤膜相当于过滤操作。实验室中过滤用到的玻璃仪器有漏斗、烧杯、。(3)、自来水经处理后得到的直接饮用水属于(填“纯净物”或“混合物”)。 -
7、学校阳光体育节比赛场上,校医向运动员的受伤部位喷射氯乙烷(C2H5Cl),下列有关氯乙烷的说法正确的是A、氯乙烷由碳元素、氢元素和氯元素组成 B、氯乙烷由2个碳原子、5个氢原子、一个氯原子构成 C、氯乙烷中碳、氢元素的质量比为2:5 D、氯乙烷中氯元素的质量分数最小
-
8、化学用语是学习化学的工具。下列表示2个氯原子的是A、2Cl B、Cl2 C、ZnCl2 D、2HCl
-
9、三星堆四号坑出土的文物“黄金面具”的含金量约为85%,如图为金原子在元素周期表中的信息。下列说法正确的是
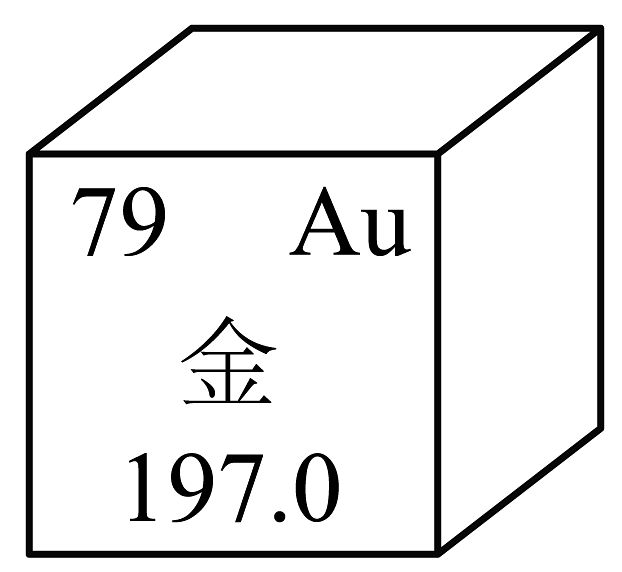 A、金的原子序数为79 B、金属于非金属元素 C、金原子的核外电子数为118 D、金的相对原子质量为197g
A、金的原子序数为79 B、金属于非金属元素 C、金原子的核外电子数为118 D、金的相对原子质量为197g -
10、我国近代化学先驱徐寿创造了部分元素的汉语名称。下列元素名称与符号一致的是A、钠(na) B、钙(CA) C、镁(Mg) D、硅(gui)
-
11、物质的性质决定其用途。下列有关物质的性质与用途对应关系错误的是A、氧气支持燃烧——作燃料 B、氦气密度小——用于充氦气球 C、氮气常温下化学性质不活泼——作保护气 D、稀有气体在通电时能发出不同颜色的光——作霓虹灯
-
12、乙烯C2H4是重要的化工原料。我国科学家根据植物光合作用原理,研制出类叶绿素结构的“串联催化体系”,可以在太阳光和催化剂作用下分解水,再联合CO2制C2H4如图所示。
 (1)、反应1化学方程式为 , 与电解水制氢相比,该方法的优点是。(2)、乙烯中碳元素和氢元素的质量比为。(3)、若反应1中生成的36gH2参与到反应2:2CO2+6H2=C2H4+4H2O,则生成C2H4的质量为多少?(写出计算过程)(4)、科学家们在设计反应器时,将反应器也做成像树叶一般的扁平式结构,请结合图,分析这种设计的目的是。(5)、反应2生成的水全部循环利用,为使该过程持续发生,反应1还需要不断补充水,其原因是。
(1)、反应1化学方程式为 , 与电解水制氢相比,该方法的优点是。(2)、乙烯中碳元素和氢元素的质量比为。(3)、若反应1中生成的36gH2参与到反应2:2CO2+6H2=C2H4+4H2O,则生成C2H4的质量为多少?(写出计算过程)(4)、科学家们在设计反应器时,将反应器也做成像树叶一般的扁平式结构,请结合图,分析这种设计的目的是。(5)、反应2生成的水全部循环利用,为使该过程持续发生,反应1还需要不断补充水,其原因是。 -
13、芯片的基材主要是高纯硅,如图是利用石英砂(主要成分是SiO2制备高纯硅的工艺流程:
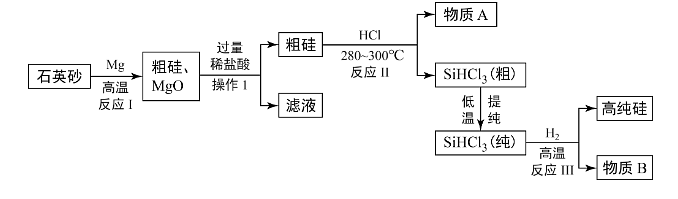 (1)、工业上常将石灰砂粉碎,其目的是。反应I的化学方程式为。(2)、操作1的名称是 , 该操作中需要用到的玻璃仪器有:玻璃棒、;(3)、反应Ⅲ要在无氧环境中进行,原因是(写一条)。(4)、提纯SiHCl3时的原理与蒸馏相似是利用不同物质的不同,这种提纯方法中的变化属于(填“物理”或“化学”)变化。(5)、上述已知生产流程中,可以循环利用的物质有(填化学式)。
(1)、工业上常将石灰砂粉碎,其目的是。反应I的化学方程式为。(2)、操作1的名称是 , 该操作中需要用到的玻璃仪器有:玻璃棒、;(3)、反应Ⅲ要在无氧环境中进行,原因是(写一条)。(4)、提纯SiHCl3时的原理与蒸馏相似是利用不同物质的不同,这种提纯方法中的变化属于(填“物理”或“化学”)变化。(5)、上述已知生产流程中,可以循环利用的物质有(填化学式)。 -
14、
小雨同学在实验室用木炭和氧化铜两种黑色粉末在高温下反应制取单质铜,并猜测可能会产生有毒的一氧化碳,于是设计实验装置如图1进行探究。

【查阅资料】CO气体能使湿润的黄色氯化钯试纸变蓝色。CO不与澄清石灰水反应。
【实验验证】
(1)点燃A处酒精灯,一段时间后发现A中 , B中澄清石灰水变浑浊。A中发生的化学反应的化学方程式为。
(2)C装置中出现的现象,说明有CO气体生成,证明小雨猜测是正确的。
【实验反思】该实验确实产生了CO,CO有毒且易发生爆炸,实验结束后若未及时撤出导管,澄清石灰水会倒吸,于是小雨同学改进实验装置如图2。
(3)判断木炭粉与氧化铜是否恰好完全反应,最简单的方法是。
(4)实验前,用氮气对装置进行排空气处理,以避免装置内空气中的气体与碳反应,对本实验气体的含量测定造成影响。
【实验二】小雨同学借助数字化传感器定量探究了该实验产生的CO,在图1的基础上改进设计了如图3的实验装置,用无线CO、CO2传感器,分别采集不同质量比反应物反应生成的CO和CO2的含量变化数据(如图4)。

(5)对变化曲线进行数据分析,得出结论:
C和CuO反应的主要气体产物是 , 随着反应物中CuO质量比的逐渐增多,另一种气体产物的含量逐渐(填“增多”或“减少”),结合提供的资料和图4数据的变化情况,解释产生CO的可能原因。
【反思与评价】
(6)对比图3,请从环保的角度分析图1装置的不足之处。
-
15、
绿水青山就是金山银山,空气和水都是重要的环境资源。

【绿水青山之空气】
(1)实验室制取O2的一般思路:
【制取原理】实验室分解过氧化氢制取氧气的化学方程式为
【仪器选择】若要获得平稳的氧气流,应从图1中选择的发生装置为(填“A”或“B”)。
【实验操作】实验开始前,先 , 再装药品进行实验。
测定空气中氧气含量:
图1中C为红磷燃烧测定空气中氧气含量实验前部分气体微粒存在情况的示意图
(2)保护空气的措施有(写1条)。
【绿水青山之水】
(3)某同学取某地水样检测水质情况,在图2装置中模拟了自来水厂的净水流程(净水过程依标号顺序进行)。
Ⅰ、过滤:观察到图2中左侧针孔有清澈液体滴出时,(填具体操作),可加速过滤。
Ⅱ、吸附:起吸附作用的黑色物质是。
Ⅲ、消毒:将Cl2通入NaClO2溶液中可制得消毒剂ClO2和氯化钠,反应的化学方程式为Cl2+2NaClO2=2ClO2+2
IV、出水:TDS代表水中可溶性固体总含量,如下表TDS值是水质指标中的一项。净水前测得的TDS值为420,净水后为159,净水后的水质概况为。
水质概况
TDS值
水质概况
TDS值
纯度高
0-50
纯度一般
100-300
纯度较高
50-100
会结水垢
300-600
-
16、甲醇是化学工业中的关键平台分子,对于制造多种化学品至关重要。我国科研团队开发了一种创新的“分子围栏”催化剂,这种催化剂能够在低温条件下高效地将甲烷(CH4) 转化为甲醇。
这一突破性实验设计巧妙地限制了原位生成的双氧水的扩散,同时允许氢气、氧气和甲烷到达催化剂,通过这种方式,双氧水被“锁”在反应器中,与甲烷充分接触,从而持续产生甲醇。该原理示意图如下图所示。
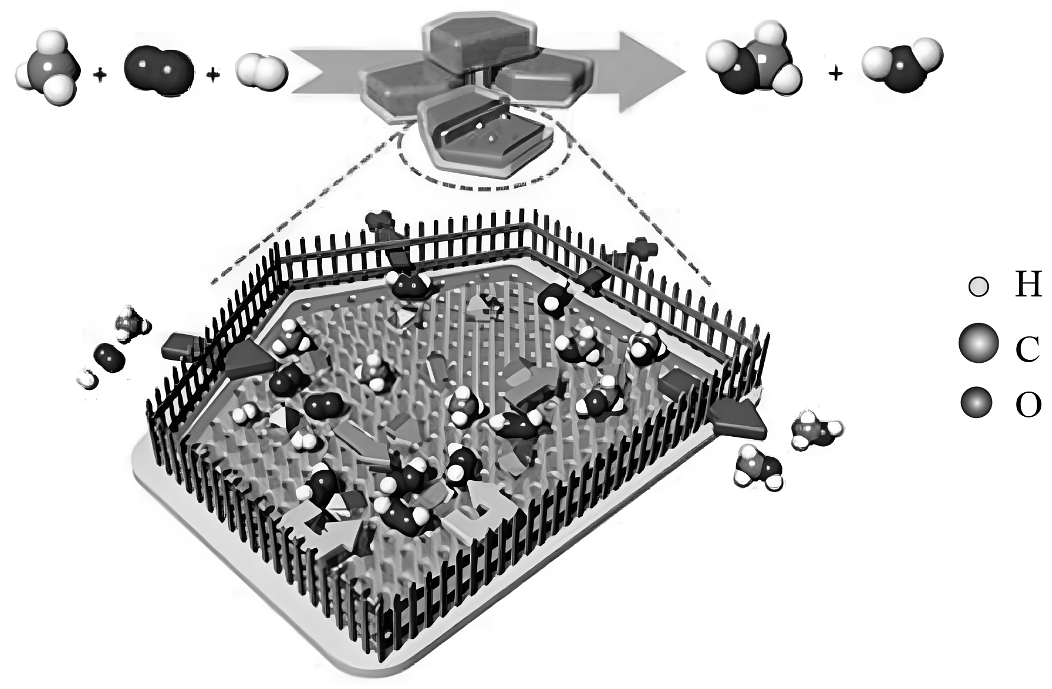 (1)、该反应的化学方程式为 , 反应前后保持不变的有
(1)、该反应的化学方程式为 , 反应前后保持不变的有a.原子个数 b.分子个数 c.元素种类 d.催化剂的性质
(2)、“分子围栏”内的反应实际上分2步进行。第1步:进入“围栏”内的H2和O2原位转化为H2O2:
第2步:“围栏”内高浓度的H2O2将CH4氧化为CH3OH
其中,属于化合反应的是第步反应,氧元素的化合价降低的是第步反应。
(3)、“分子围栏”催化剂主要成分为“分子筛”,限制了H2O和向外扩散。(4)、甲醇和甲烷完全燃烧的产物均为CO2和H2O,相同质量时完全燃烧耗氧较少的是(填化学式)。 -
17、中华文明源远流长,蕴含着深邃的化学智慧和丰富的实践经验。(1)、姜夔“高花未吐,暗香已远”蕴含科学道理,从分子的角度分析“暗香已远”的原因是。(2)、唐代刘禹锡的《传信方》中有这样一段描述“治气痢巴石丸……”,巴石主要化学成分为……写出其中的铝离子符号。(3)、《天工开物》有关墨的制作提到:凡墨,烧烟凝质而为之、用墨书写或绘制的字画能够长时间保存而不变色,这是因为常温下碳的。(4)、“漉海盐千斛,栽冈枣万株”,出自清代顾炎武的《莱州》。这里的“盐”主要指氯化钠,氯化钠是由构成的。(5)、《梦溪笔谈》中记载了用“苦泉水”制取铜的方法:“熬胆矾 (化学式为CuSO4) 铁釜,久之亦化为铜”,涉及反应的化学方程式是。(6)、《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂(发现了化学反应的可逆性),在生活中水银体温计打破后可以用覆盖水银。防止中毒。
-
18、如图是关于氮元素的价类图,下列说法错误的是:
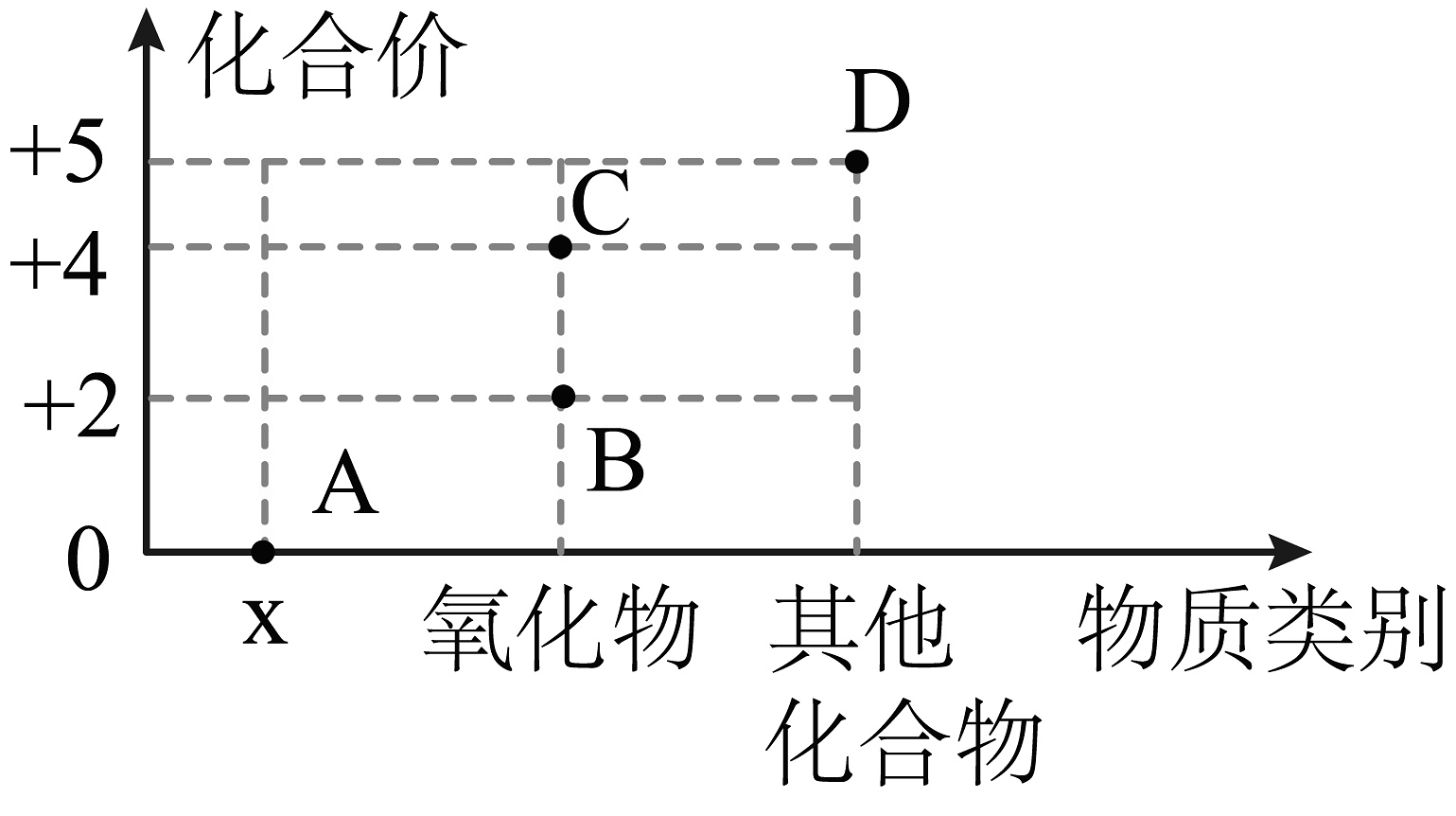 A、x表示的物质类别是单质 B、物质B由分子构成 C、物质C属于空气污染物 D、物质D只能是HNO3
A、x表示的物质类别是单质 B、物质B由分子构成 C、物质C属于空气污染物 D、物质D只能是HNO3 -
19、对化学知识的归纳错误的是:
A
化学之最
B
物质的鉴别和检验
①地壳中含量最多的金属元素:Al
②空气中含量最多的气体:N2
③相对分子质量最小的氧化物:H2O
①区别氧气、氮气、空气:可用带火星的木条
②水和双氧水:加入二氧化锰
③氧化铜和四氧化三铁:观察颜色
C
化学贡献
D
误差分析
①发现元素周期表:门捷列夫
②空气成分的测定:拉瓦锡
③测定铟、铱的相对原子质量:张青莲
①用红磷测定空气中氧气的含量
燃烧匙伸入集气瓶内过慢导致测定结果偏大
②用量筒量取10mL水:仰视读数,所得水的实际体积偏大
A、A B、B C、C D、D -
20、实验能达到目的的是A、该实验中水可以换成细沙
 B、探究温度对分子运动速率的影响
B、探究温度对分子运动速率的影响 C、验证质量守恒定律
C、验证质量守恒定律 D、验证蜡烛中含碳元素
D、验证蜡烛中含碳元素