-
1、请用数字和化学符号填空:
(1)保持氮气化学性质的微粒;
(2)3个金原子;
(3)海水中含量最多的阳离子;
(4)酒精。
-
2、如图是某化学反应的微观示意图,其中“
 ”和“
”和“ ”表示不同元素的原子,下列说法正确的是
”表示不同元素的原子,下列说法正确的是 A、上图中共有4种分子 B、反应前后,原子的种类和数量发生了变化 C、反应物和生成物中均有单质 D、该化学反应属于化合反应
A、上图中共有4种分子 B、反应前后,原子的种类和数量发生了变化 C、反应物和生成物中均有单质 D、该化学反应属于化合反应 -
3、甲醇(CH3OH)制氢具有工艺简单、节能环保等优点。其中一种转化反应的微观示意图如下。下列有关该反应的说法正确的是( )
 A、生成3种分子 B、属于复分解反应 C、丙为CO D、催化剂不断减少
A、生成3种分子 B、属于复分解反应 C、丙为CO D、催化剂不断减少 -
4、如图中
 和
和 分别表示不同元素的原子,根据图示推断,该反应属于
分别表示不同元素的原子,根据图示推断,该反应属于 A、化合反应 B、分解反应 C、置换反应 D、复分解反应
A、化合反应 B、分解反应 C、置换反应 D、复分解反应 -
5、工厂锅炉采用富氧燃烧技术能起到节能减排的作用,该技术的主要流程如图所示:
 (1)、膜分离器是在一定压力下让空气通过一种致密的透氧膜,在膜的另一侧得到较纯的氧气将空气分离,其他气体的主要成分是(填化学式)。(2)、用如图所示装置测定富氧空气中氧气的含量(集气瓶中“富氧空气”体积为100mL,底部残留少量水,燃烧匙内有足量红磷),操作如图:
(1)、膜分离器是在一定压力下让空气通过一种致密的透氧膜,在膜的另一侧得到较纯的氧气将空气分离,其他气体的主要成分是(填化学式)。(2)、用如图所示装置测定富氧空气中氧气的含量(集气瓶中“富氧空气”体积为100mL,底部残留少量水,燃烧匙内有足量红磷),操作如图:
a.往量筒内加入适量水,读出量筒内水的体积为100mL
b.点燃红磷,充分反应并冷却至室温
c.打开止水夹,待右侧量筒内液面不再变化时,调节两边液面同一高度,读出量筒内水的体积为14mL
①请描述集气瓶中红磷燃烧的现象:。
②本次实验测得“富氧空气”中氧气的体积分数为。若读取量筒中剩余水量时俯视,则实验测得的氧气的含量(填“偏大”或“偏小”)。
(3)、煤的主要成分是碳,工厂锅炉中发生的主要反应的化学方程式为 , 加入的煤要先进行粉碎的目的是。(4)、关于富氧燃烧技术,下列说法合理的是_______(填序号)。A、膜分离空气制富氧属于化学变化 B、煤粉燃烧过程中可能会产生有害气体 C、煤粉富氧燃烧时比普通燃烧更剧烈 D、通过回收再利用CO2改善环境问题 -
6、实验室制取气体的部分装置如图所示,请回答下列问题:
 (1)、装置B中仪器a的名称是。实验室使用装置A或B制取氧气前应先。(2)、实验室使用装置A来制取氧气,写出相应的化学方程式:。若用装置F收集氧气,检验瓶中氧气已收集满的方法是将带火星的木条放在导管(选填“b”或“c”)口处,观察木条是否复燃;需要瓶中氧气时,可用水将装置中的氧气排出,水应从导管(选填“b”或“c”)口通入。(3)、实验室使用装置B制取氧气时应注意什么。(4)、小明同学利用收集好的一瓶氧气进行铁丝燃烧的实验,可观察到的现象是;实验时需要再瓶底放少量的水,原因是 , 反应的化学方程式是。(5)、通常状况下,硫化氢(H2S)是一种密度比空气大且能溶于水的气体,实验室常用块状硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢气体,则制取硫化氢气体可选用的装置组合是(填字母)。
(1)、装置B中仪器a的名称是。实验室使用装置A或B制取氧气前应先。(2)、实验室使用装置A来制取氧气,写出相应的化学方程式:。若用装置F收集氧气,检验瓶中氧气已收集满的方法是将带火星的木条放在导管(选填“b”或“c”)口处,观察木条是否复燃;需要瓶中氧气时,可用水将装置中的氧气排出,水应从导管(选填“b”或“c”)口通入。(3)、实验室使用装置B制取氧气时应注意什么。(4)、小明同学利用收集好的一瓶氧气进行铁丝燃烧的实验,可观察到的现象是;实验时需要再瓶底放少量的水,原因是 , 反应的化学方程式是。(5)、通常状况下,硫化氢(H2S)是一种密度比空气大且能溶于水的气体,实验室常用块状硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢气体,则制取硫化氢气体可选用的装置组合是(填字母)。 -
7、水是生命之源,虽普通但宝贵。根据图示,回答下列问题。
 (1)、海水蒸发过程中,发生变化的是______(填序号)。A、分子质量 B、分子种类 C、分子间隔(2)、如图2所示,是水在通电的条件下生成氢气和氧气的微观示意图。在这个变化过程中,发生了改变的是(填微观粒子),该变化过程中的最小粒子是(填微观粒子)。(3)、如图3所示电解水实验时,a试管中产生的气体是 , 当连接电源正极的试管中产生8mL气体时,负极试管中产生的气体体积约为mL;写出该反应的化学方程式。(4)、通过本实验可以证明水是由组成。(5)、如图4所示,是简易净水器对水样进行初步净化。
(1)、海水蒸发过程中,发生变化的是______(填序号)。A、分子质量 B、分子种类 C、分子间隔(2)、如图2所示,是水在通电的条件下生成氢气和氧气的微观示意图。在这个变化过程中,发生了改变的是(填微观粒子),该变化过程中的最小粒子是(填微观粒子)。(3)、如图3所示电解水实验时,a试管中产生的气体是 , 当连接电源正极的试管中产生8mL气体时,负极试管中产生的气体体积约为mL;写出该反应的化学方程式。(4)、通过本实验可以证明水是由组成。(5)、如图4所示,是简易净水器对水样进行初步净化。①其中使水样通过小卵石和石英砂层主要除去杂质,通过层以除去色素及臭味,利用了其性。
②检验净化后的水是软水或硬水的物质是。
-
8、按下列题意要求填空。(1)、工业上制备硅的反应,其化学方程式为:SiO2+2CSi+2R↑,则R的化学式为。(2)、科学研究发现,植物的光合作用是叶绿素在日光的作用下,将二氧化碳与水转化为葡萄糖和氧气,由此可以推断,葡萄糖中一定含有元素。(3)、如图为某化学反应的微观示意图。

根据图示写出该反应的化学方程式 , 该反应的基本反应类型是。
-
9、根据下列粒子结构示意图,回答问题。
 (1)、A、B、C、E所示粒子中属于阳离子的是(填序号),若D为离子,其化学符号为。(2)、C所示粒子在化学反应中容易(填“得到”或“失去”)电子形成离子。(3)、A、B、C、E中具有相对稳定结构的粒子是(填序号)。(4)、由图可知,C、E元素位于同一周期的原因是。
(1)、A、B、C、E所示粒子中属于阳离子的是(填序号),若D为离子,其化学符号为。(2)、C所示粒子在化学反应中容易(填“得到”或“失去”)电子形成离子。(3)、A、B、C、E中具有相对稳定结构的粒子是(填序号)。(4)、由图可知,C、E元素位于同一周期的原因是。 -
10、化学用语是国际通用的化学语言,是学习化学的重要工具。请用化学用语回答下列问题:(1)、人体中最多的金属元素。(2)、2个硫酸根离子。(3)、地壳中含量最多的金属元素和人体中含量最多的元素形成的化合物。(4)、标出Fe2O3中铁元素的化合价。
-
11、对比实验是实验探究的重要方法。下列对比实验能达到相应实验目的的是




①探究MnO2是过氧化氢分解产生氧气的催化剂
②探究氧气浓度对反应剧烈程度的影响
③探究温度对分子运动速率的影响
④探究不同分子的运动速率大小
A、①③ B、②④ C、②③ D、③④ -
12、建立模型是学习化学的重要方法,下列化学模型中表示正确的是A、
 物质分类模型
B、
物质分类模型
B、 原子的构成
C、
原子的构成
C、 地壳中元素的含量(质量分数)
D、
地壳中元素的含量(质量分数)
D、 自来水净化模型
自来水净化模型
-
13、甲、乙、丙、丁四种物质在密闭容器内反应前后的质量关系如图所示,下列说法错误的是
 A、X=19 B、该反应为分解反应 C、丙可能是该反应的催化剂 D、甲、乙的相对分子质量之比可能为1∶16
A、X=19 B、该反应为分解反应 C、丙可能是该反应的催化剂 D、甲、乙的相对分子质量之比可能为1∶16 -
14、化学观念和科学思维是化学学科核心素养的重要内容。下列有关认识正确的是A、分类观念:澄清石灰水、冰水混合物、酒精都属于混合物 B、宏微结合:氯化钠是由离子构成的,铁是原子构成的,氢气是分子构成的 C、守恒思想:某物质在氧气中燃烧有水生成,证明该物质中含有氢、氧两种元素 D、证据推理:质子数决定元素的种类,则质子数相同的粒子一定属于同种元素
-
15、研究辣椒获得重大成果的美国科学家戴维·朱利叶斯和阿登·帕塔普蒂安获得了2021年诺贝尔生理学或医学奖。辣椒是美食中不可缺少的调料,其中含有的辣椒素是一种天然植物碱,化学式为C18H27NO3。下列关于辣椒素的说法正确的是A、辣椒素由49个原子构成 B、辣椒素分子是由碳、氢、氮、氧元素组成 C、辣椒素中含有四种非金属 D、辣椒素分子中碳、氢元素的质量比为8:1
-
16、稀土是国家战略资源。我国化学家徐光宪在稀土分离技术上做出了杰出贡献,稀土中钬元素在元素周期表中的信息如图,下列说法正确的是
 A、钬原子中的质子数为67 B、钬的元素符号为ho C、钬的相对原子质量为164.9g D、钬元素是非金属元素
A、钬原子中的质子数为67 B、钬的元素符号为ho C、钬的相对原子质量为164.9g D、钬元素是非金属元素 -
17、
某同学发现化肥袋上有一标签,如图所示:

根据图示回答下列问题:
(1)碳酸氢铵的一点物理性质________;
(2)碳酸氢铵的一点化学性质________。
【提出问题】
A.为什么要避免高温天气使用?
B.这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?
带着这些问题,她取了一些化肥样品,进入实验室。
【查找资料】
A.碱石灰能够吸收水和二氧化碳,但是不吸收氨气。
B.浓硫酸能吸收氨气。
【性质实验探究】
她设计了如下的实验装置:
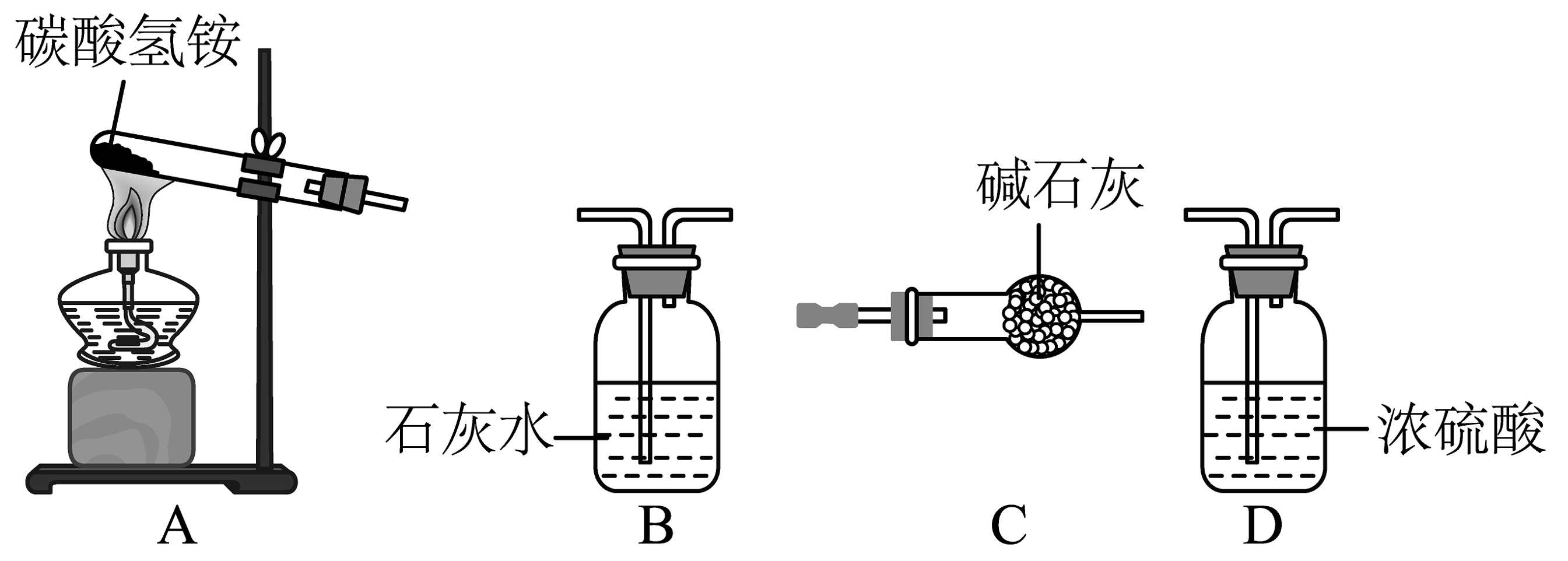
(3)用A装置给碳酸氢铵加热,装药品前,她必须进行的一步操作是________。
(4)取少量碳酸氢铵加入试管,加热,闻到刺激性气味,此气体化学式为________。
(5)连接AB装置,继续加热,观察到试管口的现象是________,B中的现象是________。
(6)碳酸氢铵在受热时发生反应的文字表达式是________。
【含量分析】
将装置A、C、D依次连接,加入10g化肥样品,加热至A中固体质量不再改变。
她称量装置D的质量如表:
实验前D装置的质量
150g
实验后D装置的质量
151.7g
(7)由此分析得知:反应中产生氨气的质量为________。
(8)通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮量为________。
(9)请计算此化肥中碳酸氢铵的含量(写出计算过程)。
-
18、A、B…H八种物质,有如图所示关系:其中D能使带火星的木条复燃,H是一种能使澄清石灰水变浑浊的气体,在②的反应前后B的质量和化学性质都不改变。试回答下列问题:
 (1)、写出物质的名称:C、E、F。(2)、B在②中的作用是。(3)、写出反应②的化学反应文字表达式:。
(1)、写出物质的名称:C、E、F。(2)、B在②中的作用是。(3)、写出反应②的化学反应文字表达式:。 -
19、某校化学兴趣小组就空气中氧气的含量进行实验探究:
【收集资料】硫是一种淡黄色固体,在空气中点燃时能与氧气发生反应生成二氧化硫(表达式:S + O2=SO2)。SO2是一种有刺激性气味的气体,易溶于水。
【设计实验】第一小组同学选择的药品是足量的红磷,设计了如下图装置。
(1)红磷在燃烧时的主要现象是。
(2)燃烧完毕,冷却至室温后打开止水夹,看到的现象是。
(3)一般不用木炭的原因是
(4)集气瓶中红磷燃烧的文字表达式是 。
【改进实验】第二小组同学选择的药品是硫 ,步骤和现象是:
步骤现象
用燃烧匙将硫点燃后伸入到大试管中,立即密封,硫燃烧,待硫熄灭后,将试管倒立于盛有冷水的水槽中,并在水中将橡皮塞取下。如图一段时间后,试管中上升了一段稳定的水柱,水约占试管容积的1/5

(5)你认为水上升的原因是。
(6)最终水约占试管容积的1/5,该实验的结论是:
(7)如果不足1/5,可能是下列原因中的(填字母)。
A.硫用量不足 B.未冷却至室温 C.气密性不好
(8)取试管中液体放入另一支试管中,在空气中放置一段时间,然后加入紫色石蕊试液,紫色石蕊试液变为红色,说明其中生成了酸性物质——硫酸。请写出硫酸的化学式给它加热,发现它不变为紫色,请你推测硫酸的一个化学性质
-
20、结合图示实验装置,回答下列问题。
 (1)、写出标号①②的仪器名称:① , ②。(2)、实验室制取CO2 , 选用收集装置(填写装置序号)。发生的化学反应文字表达式是。(3)、实验室常用固体锌和稀硫酸溶液反应制氢气,选用的发生装置是(填“A”或“B”)。该装置气密性的检查方法是。(4)、用高锰酸钾制取O2 , 如用D装置收集O2 , 收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”)。反应后的固体残渣,通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是(填写选项字母)。
(1)、写出标号①②的仪器名称:① , ②。(2)、实验室制取CO2 , 选用收集装置(填写装置序号)。发生的化学反应文字表达式是。(3)、实验室常用固体锌和稀硫酸溶液反应制氢气,选用的发生装置是(填“A”或“B”)。该装置气密性的检查方法是。(4)、用高锰酸钾制取O2 , 如用D装置收集O2 , 收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”)。反应后的固体残渣,通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是(填写选项字母)。a.烘干 b.溶解 c.过滤 d.洗涤