-
1、空气是一种宝贵的资源,其中占空气体积分数最多的气体是A、氮气 B、氧气 C、稀有气体 D、二氧化碳
-
2、6月5日是世界环境日,下列行为或做法不符合这一主题的是A、垃圾分类回收,减少资源浪费 B、绿色出行,践行“低碳生活”理念 C、大量砍伐树木,增加经济收入 D、合理使用农药,减少对环境污染
-
3、
某兴趣小组设计如下图实验装置探究“分子的运动”。

资料信息:酚酞溶液遇碱性物质变红,遇酸性物质不变色;氨水呈碱性。
【实验过程】
(1)图Ⅰ所示实验的现象是________,此实验说明分子________。
但是在实验时同学们闻到了一股难闻的刺激性气味,于是小明对原实验装置进行了改进,装置如图Ⅱ所示,并进行如下操作:
a.向B、C、E三支试管中分别加入5mL的蒸馏水,各滴入2滴无色酚酞溶液,振荡,观察溶液颜色。
b.在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】
(2)E试管放有酚酞溶液的目的是________。
(3)图Ⅱ所示实验的现象是________。
(4)对比改进前的实验,改进后实验的优点是________。
(5)氨气由分子构成,其化学符号为NH3 , 下列表示氨分子的模型是___________。(填序号)

-
4、如图所示为实验室中常见的气体制备和收集装置。
 (1)、实验室用高锰酸钾制取氧气,应选用发生装置(填字母序号),该反应的符号表达式为。但需在管口放棉花,其作用是 , 若用装置D收集氧气,验满的方法是。(2)、实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C比B的优点是。(3)、欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从(填“a”或“b”)端通入。(4)、已知一氧化氮气体难溶于水,且在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置(填字母序号)。
(1)、实验室用高锰酸钾制取氧气,应选用发生装置(填字母序号),该反应的符号表达式为。但需在管口放棉花,其作用是 , 若用装置D收集氧气,验满的方法是。(2)、实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,你认为选用C比B的优点是。(3)、欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从(填“a”或“b”)端通入。(4)、已知一氧化氮气体难溶于水,且在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置(填字母序号)。 -
5、阅读下列科普短文,然后回答问题。
臭氧(O3)在地面附近的大气层中含量极少,在离地面25km处有一个厚度极薄的臭氧层;臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害,它是一切生命的保护层。臭氧在通常状况下是淡蓝色、有鱼腥臭味的气体。它不稳定,一旦受热极易转化成氧气,并放出大量的热,臭氧的氧化能力比氧气强得多。若将氧气通过臭氧发生器,在无声放电条件下,从臭氧发生器出来的氧气中含有3%的臭氧。超音速飞机排出的一氧化碳、二氧化碳、一氧化氮等气体,部分家用电冰箱中使用的制冷剂“氟里昂”等都对臭氧层有很大的破坏作用,会使臭氧层形成空洞,从而使更多的紫外线照射到地球表面,导致皮肤癌的发病率大大增加,如不采取措施,后果不堪设想。
(1)、臭氧的物理性质是;(2)、将带火星的木条伸入到盛有臭氧的集气瓶中,可以看到的现象;(3)、在臭氧发生器中,氧气转变为臭氧的的过程属于变化(填“物理”或“化学”);(4)、应采取的方法保护臭氧层;(写一种)(5)、二氧化硫遇到臭氧微热,即被迅速氧化成三氧化硫,三氧化硫跟水反应能生成硫酸,这是除去废气中二氧化硫的理想方法。写出二氧化硫与臭氧反应的文字表达式:。 -
6、为了探究水的组成,实验室进行了电解水的实验。依据图中的实验现象回答问题:
 (1)、通直流电源后,B管产生的气体是 , 检验的方法是。(2)、实验时往水中加入少量硫酸钠溶液的目的是。(3)、如果B管内产生的气体体积是5mL,那么A管内产生的气体体积约为mL。(4)、该反应的符号表达式为。属于四大基本反应类型中的。(5)、电解水说明了:宏观上,水是由组成。
(1)、通直流电源后,B管产生的气体是 , 检验的方法是。(2)、实验时往水中加入少量硫酸钠溶液的目的是。(3)、如果B管内产生的气体体积是5mL,那么A管内产生的气体体积约为mL。(4)、该反应的符号表达式为。属于四大基本反应类型中的。(5)、电解水说明了:宏观上,水是由组成。 -
7、“化学家的主要工作是耕耘元素周期表”,下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题:
 (1)、硅原子的核外电子数为。(2)、12号元素的原子在化学变化中比较容易(选填“得”或“失”)电子,该元素属于(选填“金属”或“非金属”)元素。(3)、由第11号元素与第17号元素组成的化合物由构成。(选填“分子”、“原子”或“离子”)。(4)、在元素周期表中,同一族(纵行)的元素具有相似的化学性质。下列各组元素具有相似化学性质的是___________。A、Be和He B、B和C C、C和Si D、F和N(5)、钠离子核外电子排布与(填元素符号)原子核外电子排布相同。
(1)、硅原子的核外电子数为。(2)、12号元素的原子在化学变化中比较容易(选填“得”或“失”)电子,该元素属于(选填“金属”或“非金属”)元素。(3)、由第11号元素与第17号元素组成的化合物由构成。(选填“分子”、“原子”或“离子”)。(4)、在元素周期表中,同一族(纵行)的元素具有相似的化学性质。下列各组元素具有相似化学性质的是___________。A、Be和He B、B和C C、C和Si D、F和N(5)、钠离子核外电子排布与(填元素符号)原子核外电子排布相同。 -
8、按要求完成下列问题:(1)、甲同学从某受污染河段取来河水样品,发现河水浑浊,水质变黑发臭,请分析导致水质恶化的原因:。(答一点即可)(2)、甲同学向其中加入明矾粉末,搅拌溶解,静置一会儿,用如图所示的装置进行过滤,乙同学发现他存在操作错误,有:、。
 (3)、在乙同学的提醒下更正错误后过滤,甲同学发现滤液依然浑浊,可能的原因是。(答一点即可)(4)、过滤后甲同学想除去水中的臭味,应该用吸附。
(3)、在乙同学的提醒下更正错误后过滤,甲同学发现滤液依然浑浊,可能的原因是。(答一点即可)(4)、过滤后甲同学想除去水中的臭味,应该用吸附。 -
9、从分子、原子的角度认识化学反应是化学研究的基本方法。如图是某密闭容器中氢气燃烧并降至室温的微观示意图。
 (1)、从微观过程可分析出,变化Ⅰ的变化过程属于(填“物理/化学”)变化。(2)、变化Ⅰ的过程中,没有发生变化的最小微粒的名称是。从微观的角度看,变化Ⅰ和变化Ⅱ的本质区别是。(3)、下列关于变化Ⅱ的说法中,正确的是___________(填写序号);A、分子的种类不变 B、分子大小不变 C、分子的数目改变 D、分子的化学性质不变(4)、根据上图能获得很多信息,写出一条与化学反应有关的信息。
(1)、从微观过程可分析出,变化Ⅰ的变化过程属于(填“物理/化学”)变化。(2)、变化Ⅰ的过程中,没有发生变化的最小微粒的名称是。从微观的角度看,变化Ⅰ和变化Ⅱ的本质区别是。(3)、下列关于变化Ⅱ的说法中,正确的是___________(填写序号);A、分子的种类不变 B、分子大小不变 C、分子的数目改变 D、分子的化学性质不变(4)、根据上图能获得很多信息,写出一条与化学反应有关的信息。 -
10、将一种白色晶体A和一种黑色固体B按一定比例混合加热,产生无色无味气体C,取淡黄色粉末D点燃放入气体C中,产生蓝紫色火焰,生成有刺激性气味的气体E。
(1)写出相应物质的名称:
A
C
E(2)粉末B在反应中起作用。
(3)写出有关化学反应符号表达式;
-
11、用化学用语填空。(1)、2个氧离子;(2)、3个镁离子;(3)、5个二氧化碳分子。
-
12、下列图像能正确反映其对应变化关系的是A、
 用等质量、等浓度的过氧化氢溶液分别在有、无催化剂的条件下制氧气
B、
用等质量、等浓度的过氧化氢溶液分别在有、无催化剂的条件下制氧气
B、 红磷在盛有空气的密闭容器中燃烧
C、
红磷在盛有空气的密闭容器中燃烧
C、 通电电解水
D、
通电电解水
D、 加热一定质量的高锰酸钾
加热一定质量的高锰酸钾
-
13、水是生命之源,我们应了解并爱护水资源。下列说法不正确的是A、农药、化肥不合理使用,会造成水体污染 B、电解水实验说明水是由氢元素和氧元素组成的 C、河水经过沉淀、过滤、吸附后即可得到纯水 D、为使水中的悬浮杂质沉降,可在水中加入适量的明矾
-
14、元素符号和化学式是国际通用的化学符号,下列叙述正确的是A、一氧化碳中含有C元素 B、双氧水(H2O2)、水中都含有1个氢分子 C、地壳中含量最高的元素是Al D、铁丝在氧气中燃烧产物的化学式是O4Fe3
-
15、下列各组物质中,前者属于混合物,后者属于纯净物的是A、食盐 澄清石灰水溶液 B、冰水共存物 氧气 C、明矾 糖水 D、清洁、干净的空气 氧化镁
-
16、下列实验操作正确的是A、
 加热液体
B、
加热液体
B、 检查气密性
C、
检查气密性
C、 点燃酒精灯
D、
点燃酒精灯
D、 氧气验满
氧气验满
-
17、下列仪器中,能用酒精灯火焰直接加热的有
①试管 ②集气瓶 ③瓷质蒸发皿 ④量筒 ⑤烧杯 ⑥燃烧匙
A、①③⑥ B、①②⑤ C、①⑤⑥ D、③⑤⑥ -
18、Mg2Ni合金被认为是最具应用前景的储氢合金。一种Mg2Ni储氢材料的制备与应用的过程如图所示。
 (1)、氢气作为能源的优点是。(写一点)(2)、Mg2Ni中镁、镍(Ni)元素的质量比为;(3)、氢气储存过程发生的反应为Mg2Ni+2H2 = Mg2NiH4.该反应中,若有107gMg2Ni可以储存H2的质量是多少?(写出计算过程)(4)、Mg2Ni储氢材料在使用过程中Mg表面容易被氧化形成氧化层(MgO)。Mg2Ni合金中氧元素的含量与储氢能力的关系如图,Mg氧化程度越高,储氢能力(填“越高”或“越低”)。当储氢材料中氧元素的含量为a%时,MgO在储氢材料中的质量分数为(用a的代数式表示)。
(1)、氢气作为能源的优点是。(写一点)(2)、Mg2Ni中镁、镍(Ni)元素的质量比为;(3)、氢气储存过程发生的反应为Mg2Ni+2H2 = Mg2NiH4.该反应中,若有107gMg2Ni可以储存H2的质量是多少?(写出计算过程)(4)、Mg2Ni储氢材料在使用过程中Mg表面容易被氧化形成氧化层(MgO)。Mg2Ni合金中氧元素的含量与储氢能力的关系如图,Mg氧化程度越高,储氢能力(填“越高”或“越低”)。当储氢材料中氧元素的含量为a%时,MgO在储氢材料中的质量分数为(用a的代数式表示)。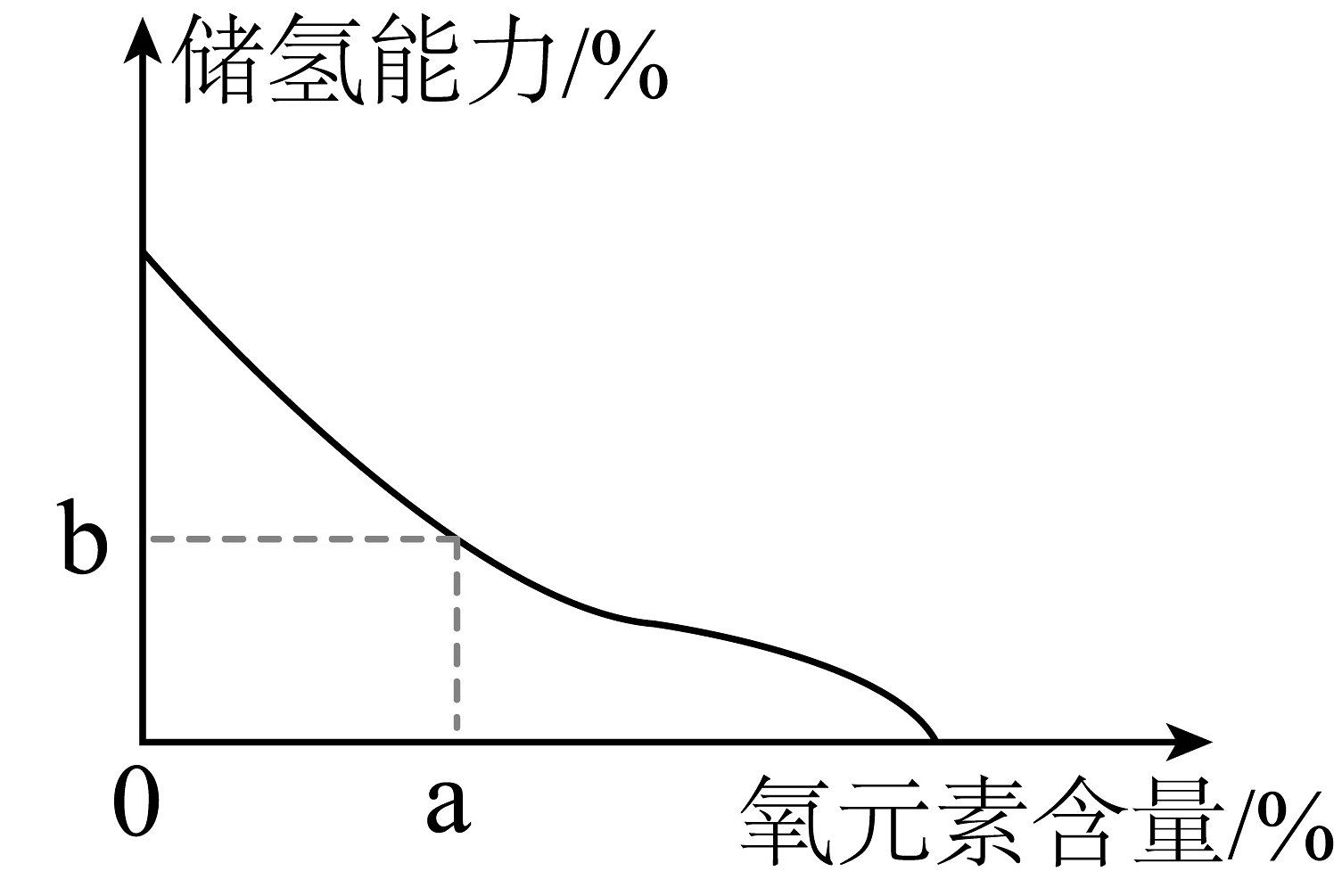
-
19、
实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
实验一:制备K2SO4 , 实验流程如图:

(1)加入过量CaCO3的目的是。
(2)上述流程中可循环使用的物质有CO2和。
(3)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是。
(4)反应Ⅲ属于复分解反应,则可推出M的化学式为。
实验二:研究CaSO4•2H2O加热分解的产物
【查阅资料】Ⅰ.CaSO4•2H2O受热会逐步失去结晶水。CaSO4•2H2O在160℃时完全生成CaSO4 , 1350℃时CaSO4开始分解。
Ⅱ.SO2能使酸性KMnO4溶液褪色。
取纯净CaSO4•2H2O固体3.44g,用控温电热丝进行加热,测定固体质量随温度的变化情况如图所示。

(5)从曲线中可知产生水的质量为g。
(6)用数据x可计算出H点固体是氧化钙,则x为。
(7)将160~1400℃温度段加热固体所产生的(写化学式,下同)气体,通入酸性KMnO4溶液中,溶液褪色,则G~H还产生了氧气,该反应化学方程式为。
-
20、
蚊虫叮咬时,会分泌蚁酸。化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】I.蚁酸的化学名称叫甲酸,化学式为HCOOH
II.蚁酸隔绝空气并加热时会分解生成两种氧化物
【实验探究】
(1)下列物质能被蚁酸腐蚀的是___________。
A. 铜栏杆 B. 大理石 C. 铁制品 D. 食盐 (2)小芳同学根据蚁酸中含有________元素,推测出蚁酸在隔绝空气并加热分解时生成水。
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:猜想Ⅰ是CO2;猜想Ⅱ是________;
(4)他们按如图所示进行实验:先向装置中通入一会N2 , 再将蚁酸分解产生的气体通入其中。

实验证明猜想Ⅱ成立,则对应的实验现象是________。
【讨论交流】
(5)从环保角度看,该装置存在的明显缺陷是________。
【拓展延伸】装置C中盛有10g氧化铜样品(杂质不参与反应),在不同时刻测定C中固体的质量(如表):
反应时间/min
2
4
6
8
10
固体质量/g
9.3
8.8
8.5
8.4
8.4
(6)在称量质量过程中,必须把玻璃管两端封住,目的是________;
(7)样品中氧化铜的质量分数为________。