-
1、水是生命之源。下列有关水的说法中,不正确的是A、水的天然循环是自然界中水分子运动的结果 B、水在天然循环过程中,发生的是物理变化 C、用滤纸过滤不能除去天然水中溶解的矿物质 D、经过沉降、过滤、灭菌后的水是纯净物
-
2、喜欢辛辣食物的同学有可能会胃酸过多,以下食物能缓解该症状的是A、苹果 B、萝卜 C、土豆 D、板栗
-
3、下列实验设计、现象或评价均正确且能达到实验目的的是
实验目的
A.测定空气中氧气含量
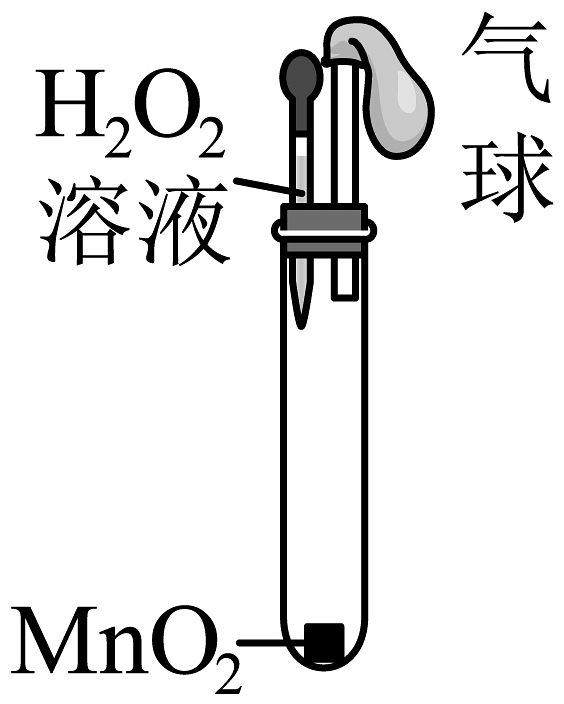
B.证明MnO2是H2O2分解的催化剂
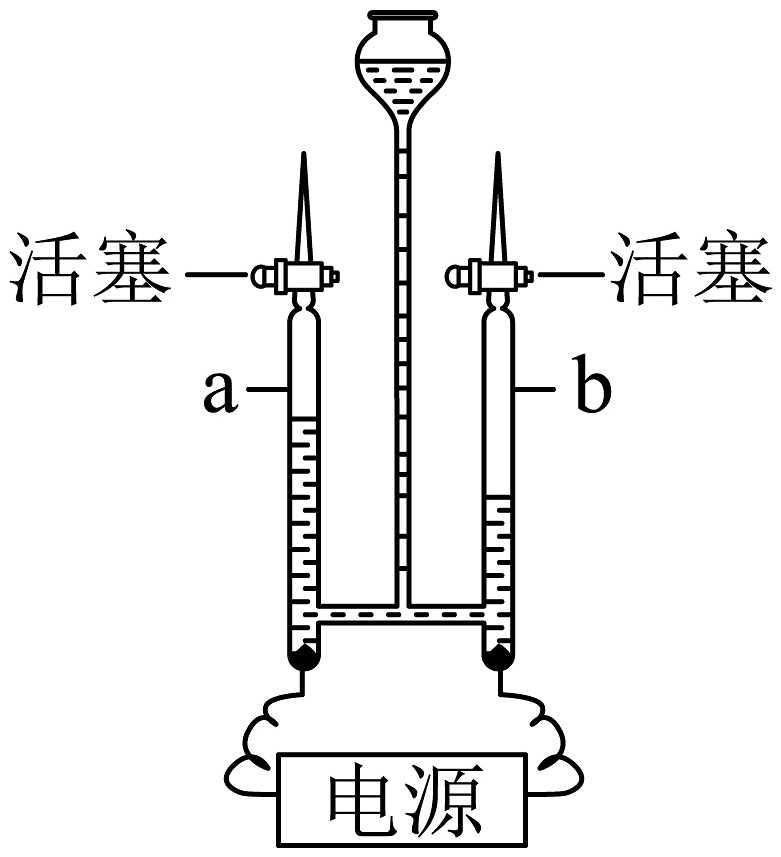
C.验证水不是由一种元素组成
D.探究温度对分子运动快慢的影响
实验装置


现象或评价
红磷换为蜡烛也可以达到实验目的
气球变大,说明MnO2的催化作用
a管气体能使带火星木条复燃,b管气体能燃烧
40℃的烧杯中品红扩散更快
A、A B、B C、C D、D -
4、
某兴趣小组同学用红磷测定空气中氧气的含量(已知红磷在氧气中燃烧生成五氧化二磷固体)。请回答下列问题。
(一)探究实验
小组同学利用图1所示装置进行实验。实验前,用排水法测得集气瓶的容积为V1并检查装置气密性良好。点燃红磷,迅速插入另一同等规格的干燥的集气瓶中,用橡胶塞密封。红磷燃烧,直至熄灭。冷却一段时间后,打开弹簧夹,进入集气瓶内水的体积为V2。
(1)实验中,红磷燃烧的现象为。
(2)由此可计算得出,该空气样本中氧气的含量为(用含有V1、V2的式子表示)。
(3)实验中,若红磷量不足,会导致测量数据(填“偏大”、“偏小”或“不变”);红磷燃烧停止后立即打开弹簧夹,会导致进入集气瓶内水的量(填“偏大”、“偏小”或“不变”)。
(二)拓展实验
实验结束后,小组同学对集气瓶中是否还含有氧气产生质疑,设计如图2所示装置探究燃烧后氧气浓度的变化情况。
【提出问题】足量红磷在密闭的容器内燃烧熄灭后,容器中是否有氧气剩余?
【作出猜想】猜想一:有氧气剩余;猜想二:无氧气剩余。
【实验验证】该小组同学按图2组装好实验装置,利用高能激光笔照射燃烧匙上的红磷和水中的白磷,红磷燃烧直至熄灭,白磷不燃烧;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷点燃。

(4)激光笔的作用是。
(5)白磷在水中时用高能激光笔照射,未燃烧;被提出水面后用高能激光笔照射,被点燃,分析推测:白磷燃烧需要满足的条件之一是。
【实验结论】
(6)根据上述实验现象,得出的结论是:猜想正确。
(7)燃烧法“测定空气中氧气含量”时,选择(填“红磷”或“白磷”)更合适。
【拓展延伸】
(8)图3是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。在图3中(填A、B、C、D、E)点时红磷燃烧熄灭;白磷开始燃烧至燃烧结束对应的曲线为段(用图2中字母表示)。
-
5、
掌握实验室制取气体的一般思路和方法是必备的化学素养。“筑梦”学习小组走进实验室制取气体并探究其性质和用途。请回答有关问题。
(一)氧气的制取探究
Ⅰ.实验室制取氧气。实验室现有过氧化氢溶液、高锰酸钾、二氧化锰以及下列装置。
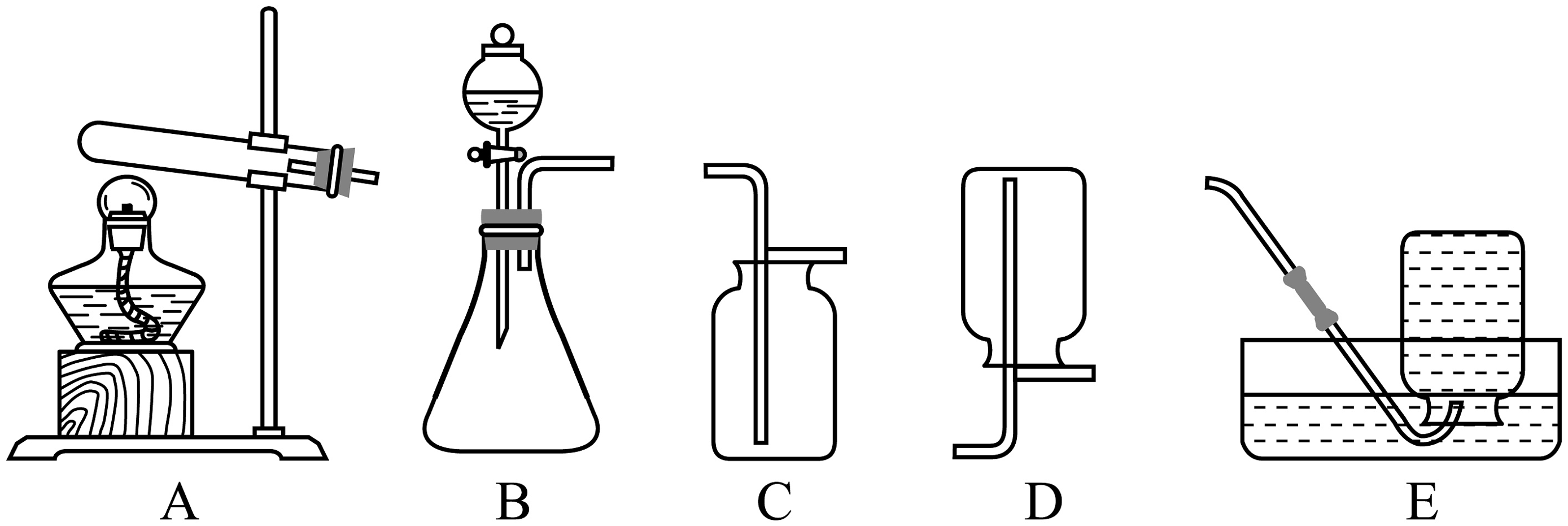
(1)实验室选择气体发生装置需考虑的因素是。若用现有药品和装置B制取氧气,反应的符号表达式为;若选用加热高锰酸钾的方法制取氧气,应选择的发生装置为(填装置序号)。
(2)实验室制取氧气可选用的收集装置为(填装置序号)。实验室制取气体选择收集方法时,下列气体性质必须考虑的是(填序号)。
①颜色 ②密度 ③在水中的溶解情况 ④可燃性 ⑤能否与水反应
Ⅱ.兴趣小组用图甲所示装置探究不同催化剂对过氧化氢分解的催化效果。取大小相同的新鲜土豆块和新鲜猪肝块作催化剂,分别加入相同浓度的过氧化氢溶液后,用传感器测量装置中气压的变化如图乙中曲线a、b所示。

(3)两种催化剂中催化效率更高的是 , 从曲线a、b的变化可以看出,过氧化氢分解的反应是(填“放热”或“吸热”)反应。曲线a、b最终达到相同的压强,说明。
(二)氧气的性质探究
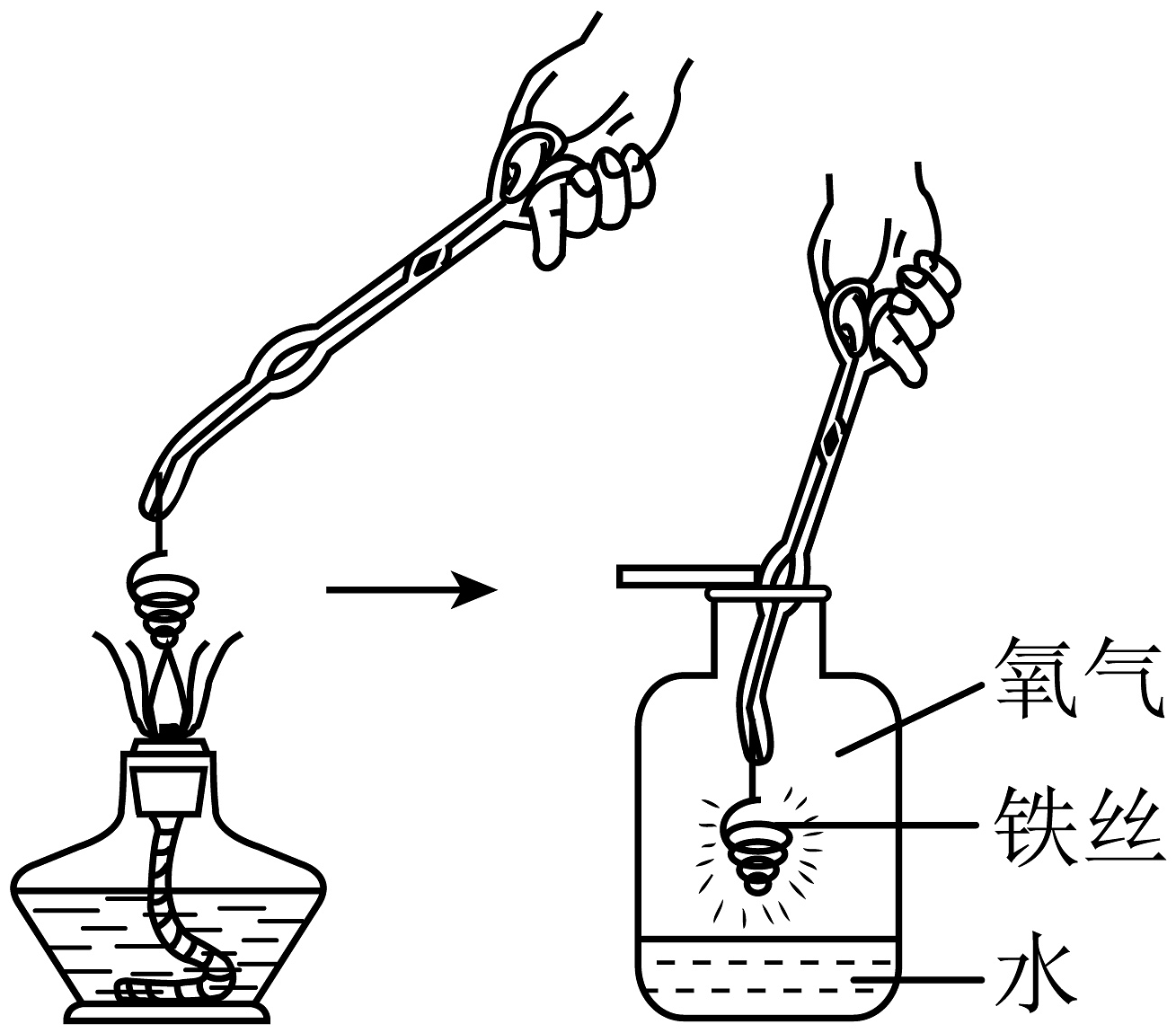
(4)兴趣小组用下图所示装置进行铁丝燃烧实验,该反应的符号表达式为。铁丝在空气中与氧气中反应的剧烈程度明显不同,原因是单位体积的空间里(填“氧分子”或“氧元素”)的数目越多,反应就越剧烈。
-
6、
有了水,才有了地球上的万物生灵。上善若水,水利万物。“追梦”小组同学以“探秘水世界”为主题进行如下探究,请回答下列问题。
任务一:自制净水器
该小组同学设计自制净水器装置如图所示。

(1)小卵石和石英砂的主要作用是除去(选填“可溶性”或“难溶性”)杂质。活性炭的作用是。
任务二:探究水的组成
【宏观辨识】根据实验探究水的组成
(2)水的分解;电解水一段时间后(装置如图),b管产生的气体为(填化学式)。

(3)水的合成:在密闭容器中将氢气和氧气的混合气体点燃,写出该反应的符号表达式。
(4)分析水的分解与合成的实验现象,可以得出水是由组成的。
【证据推理】结合实验现象推算水分子中氢、氧原子个数比。
(5)已知相同条件下气体的体积比等于其分子的个数比。根据电解水的实验现象,推导电解水的产物中氢、氧原子个数比为 , 进而推算出结果。
【模型构建】

(6)以分子构成的物质为例,图中“▲”表示的是。
-
7、2021年1月,全球首辆高温超导磁悬浮列车在中国问世。液氮在磁悬浮列车中发挥着重要的作用,它可在−196℃时通过分离液态空气的方法获得。请回答下列问题。(1)、液氮的化学式为。(2)、通过分离液态空气法获得液氮,是利用了氮气的(选填“物理性质”或“化学性质”)。(3)、在一定条件下氮气能与氧气发生反应生成一氧化氮,用符号表达式可表示为。
-
8、阅读下列资料,完成下面小题。
高锰酸钾(KMnO4)是一种受热或见光易分解的晶体,可用于实验室制取氧气,反应原理为。KMnO4溶液可用作消毒剂。
(1)、下列物质中属于氧化物的是A、KMnO4 B、K2MnO4 C、MnO2 D、O2(2)、下列关于高锰酸钾的说法正确的是A、高锰酸钾应保存于棕色试剂瓶 B、高锰酸钾受热不易发生分解 C、高锰酸钾难溶于水 D、制氧气时高锰酸钾中氧元素全部转化为氧气 -
9、化学与人类健康密切相关,如图是某葡萄糖酸锌口服液的标签。下列说法正确的是
 A、葡萄糖酸锌只含非金属元素 B、葡萄糖酸锌中碳元素质量分数最大 C、每支口服液含葡萄糖酸锌 D、葡萄糖酸锌中碳、氢、氧、锌元素质量比为
A、葡萄糖酸锌只含非金属元素 B、葡萄糖酸锌中碳元素质量分数最大 C、每支口服液含葡萄糖酸锌 D、葡萄糖酸锌中碳、氢、氧、锌元素质量比为 -
10、
某兴趣小组同学用红磷测定空气中氧气的含量,实验结束后对集气瓶中是否还含有氧气产生质疑,设计如图1所示装置探究燃烧后氧气浓度的变化情况。
【提出问题】足量红磷在密闭的容器内燃烧熄灭后,容器中是否有氧气剩余?
【作出猜想】猜想一:有氧气剩余;猜想二:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。

(1)激光笔的作用是。
(2)红磷燃烧产物()与瓶底的水发生化合反应生成磷酸(),写出该反应的化学方程式。
【实验结论】
(3)根据上述实验现象,得出的结论是:猜想正确。
(4)燃烧法“测定空气中氧气含量”时,选择(填“红磷”或“白磷”)更合适。
【拓展延伸】
(5)图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。在图2中(填字母序号)点时红磷燃烧熄灭;白磷开始燃烧至燃烧结束对应的曲线为段(用图2中字母表示)。
【实验改进】为提高测定空气中氧气含量实验的精确度,化学兴趣小组又对实验进行了创新改进。
①取一根玻璃管用橡皮塞将一端密封;
②将食品脱氧剂粉末迅速装入玻璃管,立即向管口注入一滴水将玻璃管密封,水滴的下端标为A,弹动玻璃管使脱氧剂粉末分布均匀且紧密,脱氧剂的上端标为O,如图3甲所示;
③水平滚动玻璃管,使食品脱氧剂粉末平铺在玻璃管中,静置至水滴不再移动时,水滴的右端标为B,如图3乙所示;
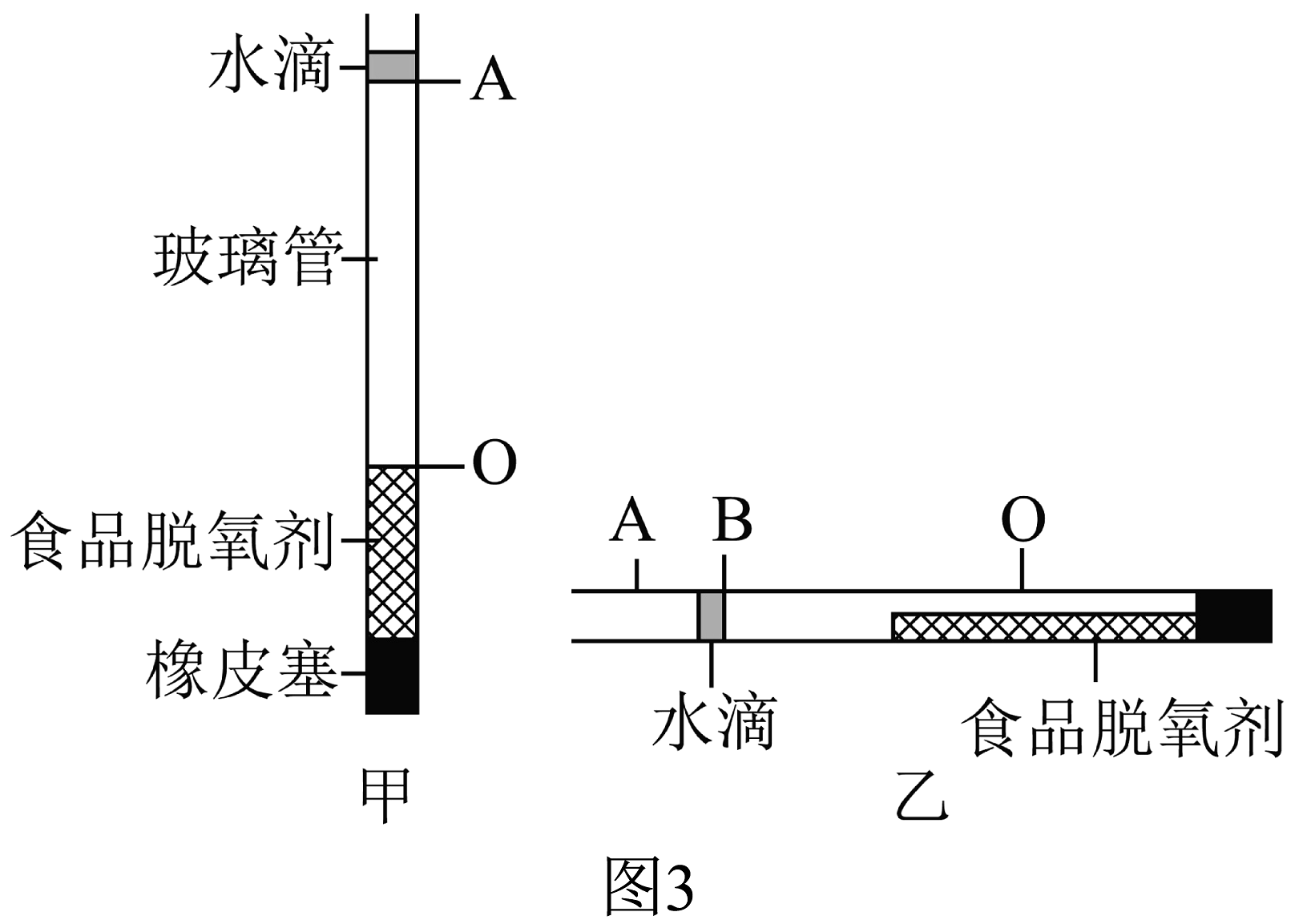
④测量出AO段和AB段的长度,将数据记录在表格中。
实验
AO/mm
AB/mm
数据
500.0
104.5
(6)根据表格中的实验数据,可知空气中氧气含量为(用百分数表示)。
(7)实验步骤②中,弹动玻璃管使脱氧剂粉末分布均匀且紧密的目的是。
(8)实验步骤③中,若没有将食品脱氧剂粉末平铺在玻璃管中,会导致实验结果(选填“偏大”或“偏小”或“不变”)。
-
11、
“圆梦”化学兴趣小组在老师的指导下开展了以“制作叶脉书签”为主题的项目式学习,实验小组按照以下流程开展了探究活动。

请结合任务回答下列问题。
【任务一】配制氢氧化钠溶液
兴趣小组的同学用氢氧化钠固体和水分别配制1%、5%和10%的氢氧化钠溶液(水的密度为)。
(1)为完成实验,除药匙、烧杯、托盘天平、量筒、胶头滴管、细口瓶外,还须用到的仪器是________(填名称)。
(2)配制的氢氧化钠溶液,需要氢氧化钠固体________g。该同学用量筒量取实验所用的蒸馏水,读数视线如图所示,实际量取水的体积下________(选填“”“”或“”);若其他操作均正确,该同学所配NaOH溶液中溶质的质量分数________(选填“偏大”、“偏小”或“不变”)。

(3)将氢氧化钠固体溶于水,用手触摸烧杯,感觉发烫,说明________。
(4)若用100g溶质质量分数为10%的氢氧化钠溶液配制溶质质量分数为5%的氢氧化钠溶液,需要加水的质量为________g。
【任务二】探究制作“叶脉书签”的最佳条件
实验Ⅰ:相同煮沸时间内,将树叶放入不同浓度的氢氧化钠溶液,处理后叶片变化如下表。
NaOH
1%
5%
10%
叶片变化
留有很多叶肉
留有较多叶肉
残留很少叶肉
实验Ⅱ:在10%的氢氧化钠溶液里,将树叶进行不同时间的煮沸,处理后叶片变化如下表。
煮沸时间
叶片变化
留有较多叶肉
残留很少叶肉
叶片卷起来,叶肉与叶脉不易分离
(5)实验Ⅰ的探究目的是________。
(6)通过实验Ⅰ、Ⅱ可知,制作“叶脉书签”的最佳条件是___________(填字母序号)。
A. 1%、 B. 5%、 C. 10%、 D. 10%、 -
12、
掌握实验室制取气体的一般思路和方法是必备的化学素养。“筑梦”学习小组走进实验室制取气体并探究其性质和用途。请回答有关问题。
(一)氧气的制取探究
Ⅰ.实验室制取氧气。实验室现有过氧化氢溶液、高锰酸钾、二氧化锰以及下列装置。
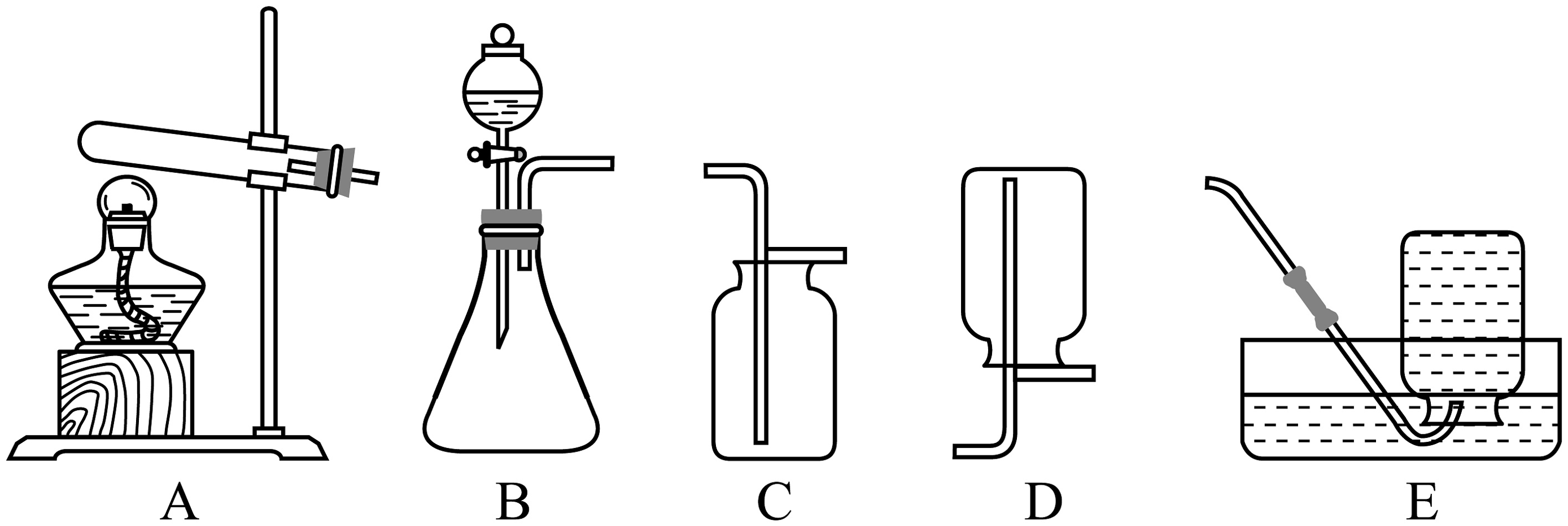
(1)实验室选择气体发生装置需考虑的因素是。若用现有药品和装置B制取氧气,反应的化学方程式为;若选用加热高锰酸钾的方法制取氧气,应选择的发生装置为(填装置字母序号)。
(2)实验室制取氧气可选用的收集装置为(填装置字母序号)。实验室制取气体选择收集方法时,下列气体性质必须考虑的是(填序号)。
①颜色②密度③在水中的溶解情况④可燃性⑤能否与水反应
Ⅱ.兴趣小组用图甲所示装置探究不同催化剂对过氧化氢分解的催化效果。取大小相同的新鲜土豆块和新鲜猪肝块作催化剂,分别加入10mL相同浓度的过氧化氢溶液后,用传感器测量装置中气压的变化如图乙中曲线a、b所示。

(3)两种催化剂中催化效率更高的是 , 从曲线a、b的变化可以看出,过氧化氢分解的反应是(填“放热”或“吸热”)反应。曲线a、b最终达到相同的压强,说明。
(二)氧气的性质探究
(4)兴趣小组用如图所示装置进行铁丝燃烧实验,该反应的化学方程式为。铁丝在空气中与氧气中反应的剧烈程度明显不同,原因是单位体积的空间里与铁原子接触的(填“氧分子”或“氧元素”)的数目越多,反应就越剧烈。

-
13、
有了水,才有了地球上的万物生灵。上善若水,水利万物。“追梦”小组同学以“探秘水世界”为主题进行如下探究,请回答下列问题。

任务一:自制净水器
该小组同学设计自制净水器装置如图所示。
(1)小卵石和石英砂的主要作用是除去(选填“可溶性”或“难溶性”)杂质。活性炭的作用是。
任务二:探究水的组成

【宏观辨识】根据实验探究水的组成
(2)水的分解:电解水一段时间后(装置如右图),b管产生的气体为(填化学式)。
(3)水的合成:在密闭容器中将氢气和氧气的混合气体点燃,写出该反应的化学方程式。
(4)分析水的分解与合成的实验现象,可以得出水是由组成的。
【证据推理】结合实验现象推算水分子中氢、氧原子个数比。
(5)已知相同条件下气体的体积比等于其分子的个数比。根据电解水的实验现象,推导电解水的产物中氢、氧原子个数比为 , 进而推算出结果。

【模型构建】
(6)以分子构成的物质为例,图中“▲”表示的是。
-
14、2024年6月,嫦娥六号成功实现月球背面南极地区月壤采集,经分析得出月球上含有、、、、、等元素,图1为硒元素在周期表中的部分信息及其原子结构示意图,图2为其它原子结构示意图。请回答下列问题。
 (1)、硒的相对原子质量为 , n的值为。(2)、Na、Mg、Si三种元素的本质区别是。(3)、镁原子在化学反应中容易(填“得到”或“失去”)电子形成稳定结构。氦原子失去2个电子后形成的粒子称为粒子,粒子的化学符号为。(4)、某化合物中氮元素和硅元素的化合价分别为−3和+4,则该化合物的化学式为。
(1)、硒的相对原子质量为 , n的值为。(2)、Na、Mg、Si三种元素的本质区别是。(3)、镁原子在化学反应中容易(填“得到”或“失去”)电子形成稳定结构。氦原子失去2个电子后形成的粒子称为粒子,粒子的化学符号为。(4)、某化合物中氮元素和硅元素的化合价分别为−3和+4,则该化合物的化学式为。 -
15、2021年1月,全球首辆高温超导磁悬浮列车在中国问世。液氮在磁悬浮列车中发挥着重要的作用,它可在-196℃时通过分离液态空气的方法获得。请回答下列问题。(1)、液氮的化学式为。(2)、通过分离液态空气法获得液氮,是利用了氮气的(选填“物理性质”或“化学性质”)。(3)、在一定条件下氮气能与氧气发生反应生成一氧化氮,用化学方程式可表示为。
-
16、“宏观—微观—符号”三重表征是化学上认识物质及其变化特有的思维方式,请根据图示回答问题。
 (1)、图1为物质的组成及构成关系,图中②表示的是。(2)、图2为密闭容器中物质变化过程的微观示意图,图中“●”代表碳原子,“○”代表氧原子,过程Ⅰ反的基本类型是 , 该变化中的最小粒子是(用化学符号表示)。过程Ⅱ变化的微观本质是。
(1)、图1为物质的组成及构成关系,图中②表示的是。(2)、图2为密闭容器中物质变化过程的微观示意图,图中“●”代表碳原子,“○”代表氧原子,过程Ⅰ反的基本类型是 , 该变化中的最小粒子是(用化学符号表示)。过程Ⅱ变化的微观本质是。 -
17、在高原地区会出现缺氧反应,可以用固体燃料氧气发生器制备氧气。其原理为:向氧气发生器加入粉末状的铁粉和氯酸钠();点燃铁粉,铁粉剧烈燃烧,放出大量的热,受热分解为NaCl和。下列说法正确的是A、点燃铁粉放出的热量可以为氯酸钠分解提供能量 B、氯酸钠受热分解的方程式为: C、若需制备32kg氧气,则理论上需要分解106.5kg的氯酸钠 D、一定条件下,若用和制备相同质量的氧气,理论上需要的质量更多
-
18、某学习小组同学查阅资料发现,氢气和二氧化碳在同一条件下会发生两个化学反应,反应过程如下图所示,通过反应I可以制取燃料甲醇。下列说法错误的是
 A、两个反应中均有水产生 B、甲醇的化学式可以表示为 C、反应I中共涉及到三种氧化物 D、反应Ⅱ前后,分子数目没有发生改变
A、两个反应中均有水产生 B、甲醇的化学式可以表示为 C、反应I中共涉及到三种氧化物 D、反应Ⅱ前后,分子数目没有发生改变 -
19、推理是学习化学的一种常用方法。下列推理正确的是A、金属原子失去电子可变成阳离子,所以阳离子一定含金属元素 B、单质由同种元素组成,则由同种元素组成的纯净物一定是单质 C、氧化物是含有氧元素的化合物,则含有氧元素的化合物一定是氧化物 D、在同一化合物中,金属元素显正价,所以非金属元素一定显负价
-
20、下列实验方案不能达到实验目的的是
选项
实验目的
实验方案
A
检验氧气
将带火星的木条伸入集气气瓶中,观察现象
B
回收过氧化氢溶液制取氧气后的二氧化锰
过滤、洗涤、干燥
C
检验蜡烛中是否含有碳元素
蜡烛火焰上方罩一只干冷烧杯,观察现象
D
除去氮气中的氧气
将气体缓缓通过红热的木炭粉
A、A B、B C、C D、D