-
1、小明周末和妈妈一起做午餐,他发现以下一些变化,有一种变化与其它三种变化不相同,它是A、食盐溶解 B、肉切成片 C、米煮成饭 D、蒜捣碎成末
-
2、某校化学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入 13.7g氢氧化钠溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠反应的化学方程式为:NH4NO3+NaOHNaNO3+H2O+NH3↑)。把产生的 NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质量,结果如下表所示:
时间/s
0
20
30
40
60
80
100
120
增加的质量/g
0
0.7
0.9
1.2
1.5
1.6
1.7
1.7
试回答下列问题:
(1)、求硝酸铵样品的纯度为(2)、求反应后所得的硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的质量) -
3、膨松剂在我们的日常饮食中屡见不鲜,小到包子馒头,大到其它的肉类食品,膨松剂的运用十分的广泛。某面包膨松剂由碳酸氢钠和碳酸氢铵一种或两种物质组成,甲同学想对其成分进行检验。查阅资料后,他设计了如图所示的实验装置(实验开始前弹簧夹都处于关闭状态),并分3步进行实验。

资料:①膨松剂在面包制作过程中发生化学反应:2NaHCO3Na2CO3+H2O+CO2↑,NH4HCO3NH3↑+H2O+CO2↑;②氨气溶于水所得溶液为氨水,呈碱性。
实验操作:
第1步:关闭K2 , 打开K1 , 经过加热,D中出现了明显现象。
第2步:关闭K1 , 打开K2 , 加热至试管B中的水里气泡不再产生。
第3步:观察到大试管中还有剩余物质。
根据以上信息回答以下问题:
(1)从“第2步”可知,装置B的作用是。
(2)如果没有装置C,D中可能不会出现什么实验现象?。
(3)写出实验中膨松剂的物质组成:。
-
4、科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考。从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种。为了确定该气体的成分,他们进行了如下探究。
查阅资料:
I.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;
II.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能。
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2 , 把它直接通入澄清石灰水,并观察实验现象。
乙同学认为甲同学的做法不合理。请用化学方程式表示其原因。
(2)同学们设计了一套合理的实验装置,如下图所示(铁架台已略去)。请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水,氢氧化钠溶液,酸性高锰酸钾溶液,浓硫酸,无水硫酸铜,碱石灰 (假设每步反应都是完全的)

①写出E装置中试剂的名称或化学式。
②若观察到(填装置序号)中澄清石灰水变浑浊, 证明原气体中有CO2;
③若观察到现象, 证明原气体中有H2无CO。
-
5、金属在生产生活中得到广泛应用,(1)、铁制品生锈对生活中影响较大,可用稀盐酸清除铁锈,写出清除铁锈的化学方程式:;(2)、现有两种金属单质组成的混合物,向100g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示,下列说法不正确的原是_________
 A、若混合物为Zn、Al,则m可能是0.2g B、若混合物为Zn、Cu,则m=0.2g C、若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3% D、若混合物为Fe、Cu,m=0.1g,则该混合物中Fe的质量分数可能是 50%
A、若混合物为Zn、Al,则m可能是0.2g B、若混合物为Zn、Cu,则m=0.2g C、若混合物为Fe、Al,则稀盐酸中溶质质量分数一定小于7.3% D、若混合物为Fe、Cu,m=0.1g,则该混合物中Fe的质量分数可能是 50% -
6、将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进实验(Na2CO3 , 受热不分解)
 (1)、A样品中与BaCl2溶液反应的Na2CO3的质量是。(2)、化学式Na2CO3·nH2O中n是。(3)、对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.1%)
(1)、A样品中与BaCl2溶液反应的Na2CO3的质量是。(2)、化学式Na2CO3·nH2O中n是。(3)、对C样品的操作结束后,所得NaCl溶液的溶质质量分数是多少?(精确到0.1%) -
7、某溶液含有Cu(NO3)2和AgNO3 , 现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示。下列说法不正确的是
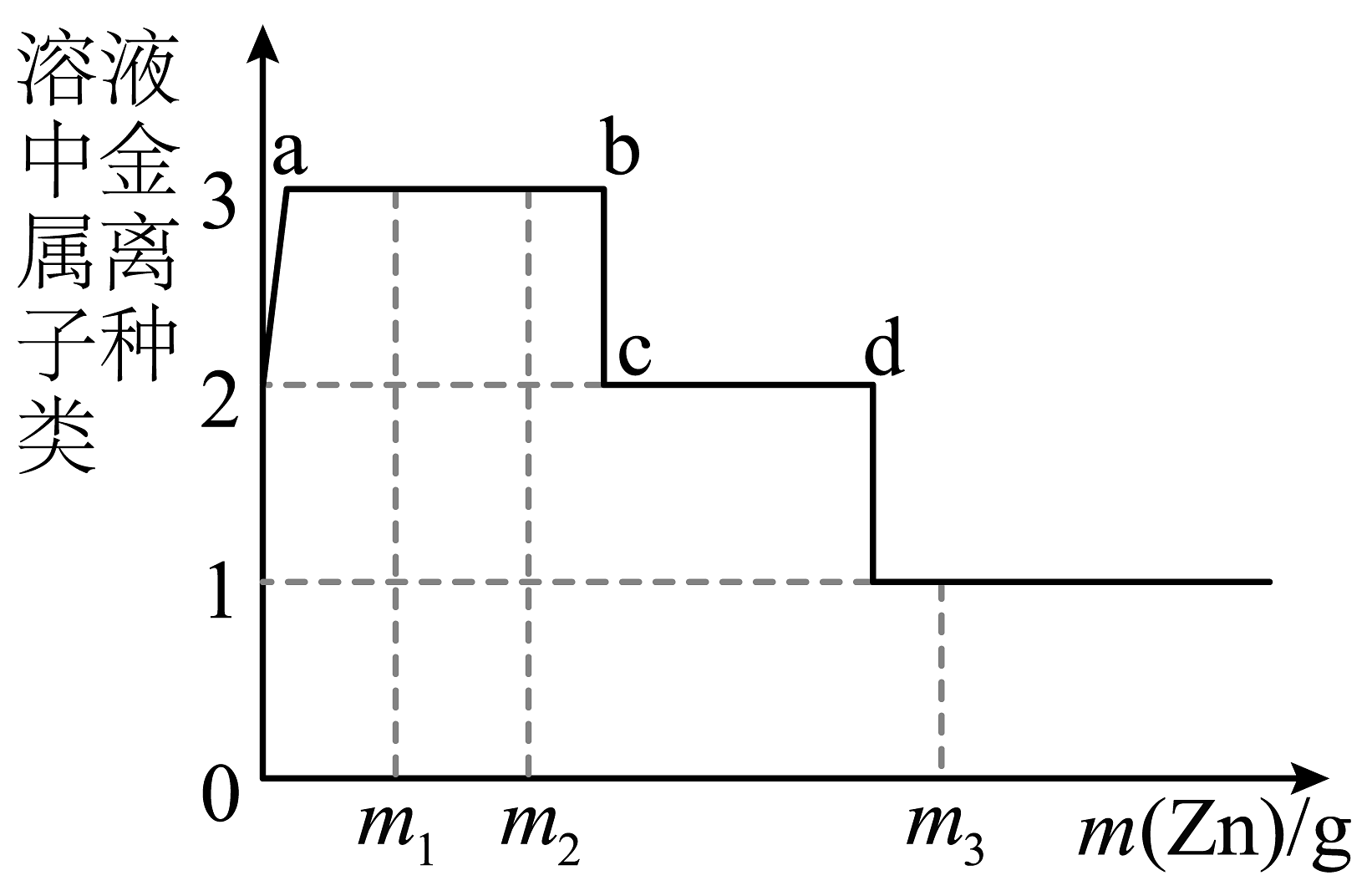 A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等
A、a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ B、c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ C、当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ D、当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等 -
8、甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是
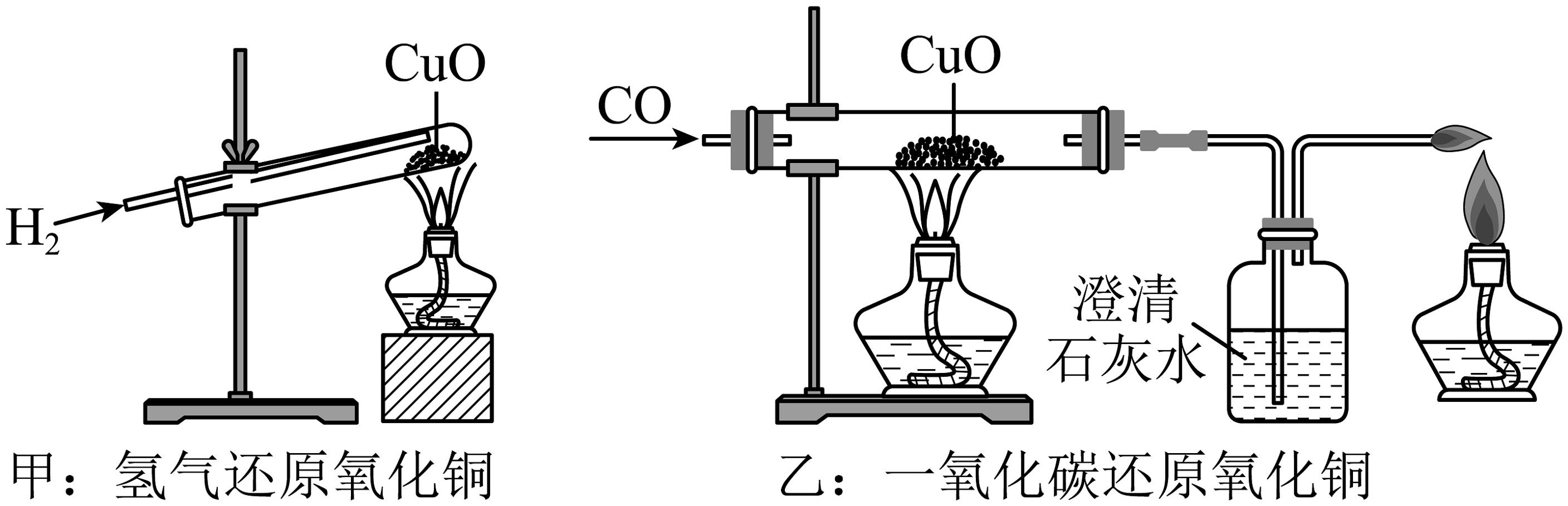 A、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲实验试管口向下倾斜可防止反应生成的水倒流
A、甲乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 D、甲实验试管口向下倾斜可防止反应生成的水倒流 -
9、在托盘天平两边各放上一个盛有36.5克浓度为20%盐酸的烧杯,调节天平至平衡。现将各一定量的两种物质分别放入两烧杯中,都恰好完全反应,此时天平仍保持平衡,则加入的物质可能是A、MgO和MgCO3 B、Mg和MgCO3 C、MgO和Mg(OH)2 D、MgO和Mg
-
10、将一些氧化铜粉末加入到200克49%的硫酸溶液中,微热至氧化铜全部溶解。再向该蓝色溶液中加入铁粉 80克,充分反应过滤,仍得到干燥后的固体物质56克。求:(1)、原加入的氧化铜质量是多少克?(2)、最后得到的溶液的质量分数是多少?
-
11、将等质量的锌粉和镁粉,分别放入质量相等的19.6%稀硫酸中,当酸过量时生成氢气质量随反应时间变化的曲线如甲图所示,当金属过量时生成氧气质量随反应时间变化的曲线如乙图所示,请回答:
 (1)、下列对于甲乙两图理解的说法正确的是上___________(可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出与锌等量的镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据)。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)
(1)、下列对于甲乙两图理解的说法正确的是上___________(可多选)。A、甲图中反应结束后两种金属可能都有剩余 B、乙图中反应结束后稀硫酸可能都没有剩余 C、甲图中反应结束后消耗两种金属的质量相等 D、乙图中反应结束后生成氢气的质量相等(2)、在丙图上画出与锌等量的镁粉与足量稀硫酸反应产生氢气的质量与稀硫酸质量的关系图(写出计算过程,并要求在图中标出曲线中必要的数据)。(Mg+H2SO4=MgSO4+H2↑;Zn+H2SO4=ZnSO4+H2↑)
-
12、在相同温度和相同体积的条件下,气体压强(p)与气体分子数目(n)成正比关系(p=kn)。若ag碳和 bg 氧气放入一密闭容器中,测得容器内的气体压强为p,然后,提供一定条件使容器内的物质发生充分反应,待温度复原时,得容器的气体压强仍然为p,则a与b的关系为。
-
13、将含有不溶性物质的硝酸钾固体的混合物放入一定量的水中充分搅拌,得到的实验数据如下:
表1:
温度/℃
20
40
60
剩余固体质量/g
136.8
72.2
20
表2:
温度/℃
20
30
40
50
60
70
80
溶解度/g
31.6
45.8
63.9
85.5
110
138
169
试计算:
(1)、原固体混合物中硝酸钾的质量是g。(2)、加入水的质量是g。 -
14、小乐查阅资料发现氯化铁可作过氧化氢溶液制取氧气的催化剂,为了验证这一说法并比较氯化铁和二氧化锰的催化能力强弱,小乐利用如图所示装置和下述实验步骤进行实验

步骤1:正确连接装置,并检查装置气密性;
步骤2:按表所示实验药品及用量进行实验
组别
5%的过氧化氢溶液/mL
催化剂种类及质量/g
60s内收集到氧气的体积/mL
1
20
无
2
20
二氧化锰m
3
20
氯化铁m
步骤3:待第3组实验完全反应后,进行如下处理
 (1)、装置连接的正确顺序是(用小写字母表示)。(2)、为了比较氯化铁和二氧化锰的催化能力强弱,在此实验中可依据的现象是。(3)、若氯化铁是过氧化氢溶液制取氧气的催化剂,则m、m1、m2符合的等式是。
(1)、装置连接的正确顺序是(用小写字母表示)。(2)、为了比较氯化铁和二氧化锰的催化能力强弱,在此实验中可依据的现象是。(3)、若氯化铁是过氧化氢溶液制取氧气的催化剂,则m、m1、m2符合的等式是。 -
15、将某无色混合气体依次进行如下实验(假设每步实验均作用完全):①通过氢氧化钠固体后,气体体积变小;②通过灼热的氧化铜粉末,粉末变为红色;③通过白色硫酸铜粉末,粉末变为蓝色:④通过澄清石灰水,溶液变浑浊。试推断原混合气体的组成可能是A、H2、CO B、CO、CO2、H2O(气) C、H2、CO2 D、H2、CO、H2O(气)
-
16、研究生石灰(CaO)露置于空气中变质的情况设计实验如下
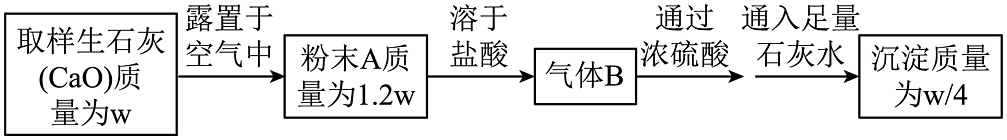
则下列结论错误的是
A、粉末A中CaO的质量为0.62w B、粉末A中钙元素的质量与生石灰样品中钙元素的质量相等 C、粉末A中CaO的吸收H2O的质量为0.09w D、由气体B可确定粉末A中含有 CaCO3由沉淀的质量可确定其质量为w/4 -
17、取 1.6g某物质在足量氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,关于该物质的组成有下列论断:①一定含 C、H;②一定不含 О;③可能含 О; ④一定含O;⑤分子中 C、H 的原子个数比为 1:2;⑥分子中C、H的原子个数比为 1:4.其中正确的是A、①②③ B、①②⑤ C、①③⑥ D、①④⑤
-
18、容器内有 A、B、C、D 四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是
物质
A
B
C
D
反应前质量/g
19.7
8.7
31.6
0.4
反应后质量/g
待测
17.4
0
3.6
A、反应后密闭容器中A的质量为19.7克 B、物质C一定是化合物,物质D可能是单质 C、反应过程中,物质B与D变化的质量比为87:36 D、A与C的相对分子质量之比为197:316 -
19、注射器是一种常见的医疗器械,它在初中科学实验中的巧妙使用可使实验操作更简洁、现象更明显。以下对注射器在实验中的使用及实验分析正确的是
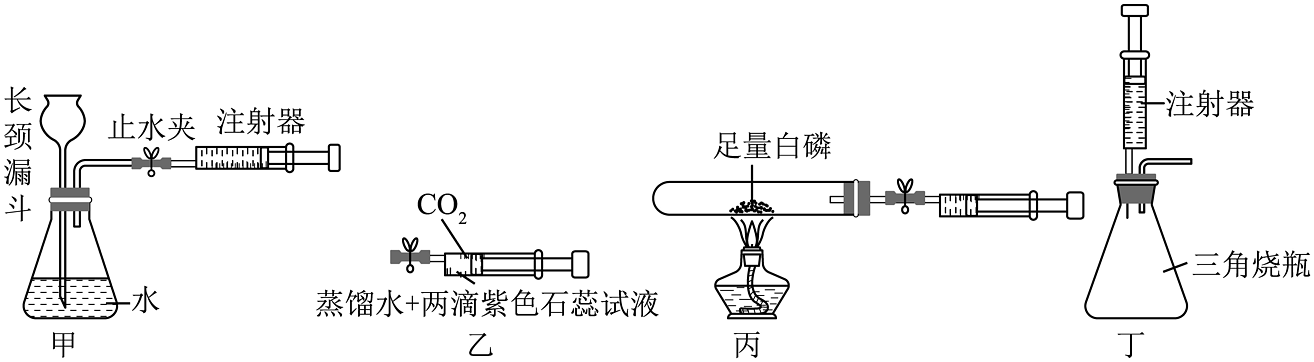 A、甲中注射器用于气密性检査,打开止水夹,快速向外拉活塞,若长颈漏斗口有气泡产生,则气密性一定良好 B、乙中注射器作反应容器,夹紧弹簧夹振荡,紫色石变红,则 CO2是酸 C、丙中的注射器可用于气体体积的测量,该装置测量的是红磷燃烧后试管中剩余气体的体积 D、丁中的注射器代替了长颈漏斗,优点之一为可节约试剂用量
A、甲中注射器用于气密性检査,打开止水夹,快速向外拉活塞,若长颈漏斗口有气泡产生,则气密性一定良好 B、乙中注射器作反应容器,夹紧弹簧夹振荡,紫色石变红,则 CO2是酸 C、丙中的注射器可用于气体体积的测量,该装置测量的是红磷燃烧后试管中剩余气体的体积 D、丁中的注射器代替了长颈漏斗,优点之一为可节约试剂用量 -
20、当汽车尾气产生的NO2在日光照射下分解成为NO和氧原子时,即开始光化学烟雾的循环,不断地产生O2 , 这个循环包括下列3个化学方程式:(1)NO2=NO+O;(2)___________;(3)O+O2=O3 , 则(2)中的化学方程式是A、NO+O=NO B、2NO+O2=2NO2 C、O3=O+O2 D、2N2+2O3=4NO+O2