-
1、金属材料在生活中有广泛的应用。下列有关金属和金属材料的说法正确的是A、黄铜比纯铜的硬度小 B、钢是纯净物,生铁是混合物 C、铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水 D、铜能与稀硫酸反应产生氢气
-
2、为了保护宁明青山绿水,我们要形成绿色生活方式,像保护眼睛一样保护自然和生态环境。下列行为不符合“低碳”理念的是A、自备购物布袋 B、按需取餐不浪费 C、减少使用一次性餐具 D、教室人空未关灯
-
3、据媒体报道,锡晶体格钟是一种新型原子钟,其准确度高得惊人,它能在50亿年间不慢一秒也不快一秒。右图为锶元素及其原子的相关信息,下列说法正确的是( )
 A、原子核内核电荷数为87 B、锶属于非金属元素,相对原子质量为87.62 C、锶离子中有40个电子 D、它与氯原子可形成化学式为SrCl2的化合物
A、原子核内核电荷数为87 B、锶属于非金属元素,相对原子质量为87.62 C、锶离子中有40个电子 D、它与氯原子可形成化学式为SrCl2的化合物 -
4、化学世界绚丽多彩,下列实验现象描述正确的是A、硫粉在空气中燃烧产生蓝紫色火焰 B、将铁钉加入硫酸铜溶液中,溶液由蓝色变为黄色 C、酚酞溶液中滴入浓氨水会变蓝色 D、镁条在空气中燃烧产生耀眼白光
-
5、规范的操作是安全地进行实验并获得成功的重要保证。下列实验操作正确的是


A.倾倒液体
B.加热液体


C.读取液体体积
D.稀释浓硫酸
A、A B、B C、C D、D -
6、各种物质之间存在着多种相互作用,也不断发生着变化。下列变化属于化学变化的是A、冰雪融化 B、酒精挥发 C、镁条燃烧 D、矿石粉碎
-
7、某兴趣小组为研究酸碱中和反应,取氧氧化钠溶液于烧杯中,并逐滴加入质量分数为的稀盐酸,滴加过程中用传感器测得烧杯中溶液的随加入稀盐酸的质量变化关系,如图1所示。
 (1)、的稀盐酸需要用的浓盐酸进行稀释。(2)、图1中酸碱刚好完全反应的点是、、中的点,点对应溶液中的溶质有(写化学式)(3)、计算氢氧化钠溶液的溶质的质量分数。(写出计算过程)(4)、根据图2分析,该反应的微观实质是。
(1)、的稀盐酸需要用的浓盐酸进行稀释。(2)、图1中酸碱刚好完全反应的点是、、中的点,点对应溶液中的溶质有(写化学式)(3)、计算氢氧化钠溶液的溶质的质量分数。(写出计算过程)(4)、根据图2分析,该反应的微观实质是。 -
8、某化工厂以废金属(主要成分为Fe和Cu,表面有少量油污)为原料回收海绵铜,并制备氯化铁的工艺流程如图所示。

已知:易溶于水且不与氢氧化钠反应,在“氧化”中起催化作用,该反应的化学方程式为:
回答下列问题:
(1)、废金属回收利用是保护金属资源的有效途径之一,它有利于。(2)、“洗涤”的目的是去除废金属表面的油污,试剂X最好选用(填标号)。a.水 b.氢氧化钠溶液 c.稀硫酸
(3)、“酸浸”中发生反应的化学方程式为。(4)、在“氧化”过程中,反应前后化合价发生变化的元素有(写元素符号)。(5)、向“滤渣乙”中加入适量盐酸,发生的化学反应方程式为。最后得到的溶液为色。(6)、现有100t含铁为28%的废金属,利用上述流程制备溶液,若过程中铁元素无损失,最后得到的溶液中的质量为t。 -
9、
松花蛋是我国特有的一种传统美食。某课外活动小组的同学对“松花蛋制作”进行了如下探究。
探究一:松花蛋的酸碱性。
(1)同学们取少量松花蛋粉(制作松花蛋泥的原料),加入足量水,搅拌,过滤。在滤液中滴入 , 滤液变红色,证明滤液中含有碱性物质。此时滤液的7(填“>”“<”或“=”)。
探究二:滤液中的碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】①松花蛋粉中主要含有生石灰、食盐、纯碱()等。
②溶液呈中性,溶液呈碱性。
【分析推理】
(2)松花蛋粉加水调制滤液时发生的反应: , (写化学方程式)。
【提出猜想】
(3)猜想一:只有;猜想二:有和;猜想三:有。
【实验探究】
(4)填写下表
操作
现象
结论
取滤液少许,向其中加入过量的稀盐酸
无明显现象
猜想不成立
另取滤液少许,向其中加入溶液
猜想二成立
【项目拓展】
(5)为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析,这一工艺改进的原因是既能防止 , 又能补充人体所需的元素(写元素符号)。
-
10、“水为食之先”,《燔石篇》中介绍了用明矾使河水变得清澈的技术。
 (1)、明矾中铝离子的符号是 , 乙池净水主要利用了木炭的性。(2)、净化后的水用于酿酒,《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上……其清如水,味极浓烈,盖酒露也。”
(1)、明矾中铝离子的符号是 , 乙池净水主要利用了木炭的性。(2)、净化后的水用于酿酒,《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上……其清如水,味极浓烈,盖酒露也。”①古法酿酒所用原理与现代净水方法中的相似。
②在甑桶中的粮食加入酒曲发酵酿酒发生的是(填“缓慢氧化”或“剧烈氧化”),酒的主要成分是乙醇,乙醇在氧气中完全燃烧生成两种氧化物,其反应的化学方程式为。
③铁可以用作炊具是利用了性。用长木棒挑开灶内木材堆后,火焰重新变旺,这是因为。
-
11、如图是、、三种物质的溶解度曲线,下列说法不正确的是
 A、时,将物质加入到水中充分搅拌,得到的饱和溶液 B、点表示时,、两种物质的溶解度相等 C、将等质量的、两种物质的饱和溶液降温至 , 析出溶质质量 D、时,将等质量的、、三种物质的饱和溶液降温至 , 所得溶液中溶质质量分数由大到小的顺序是
A、时,将物质加入到水中充分搅拌,得到的饱和溶液 B、点表示时,、两种物质的溶解度相等 C、将等质量的、两种物质的饱和溶液降温至 , 析出溶质质量 D、时,将等质量的、、三种物质的饱和溶液降温至 , 所得溶液中溶质质量分数由大到小的顺序是 -
12、保护环境卫生,学会垃圾分类。快递纸箱属于下列图示中的A、
 B、
B、 C、
C、 D、
D、
-
13、为我国制碱工业作出了杰出贡献,被称为“我国化学工业的先驱”的是A、张青莲 B、侯德榜 C、拉瓦锡 D、道尔顿
-
14、生活中处处有化学,某食堂午餐食谱有米饭、炒鸡蛋、骨头汤,从营养均衡上看还应该补充的食物是A、红烧鲤鱼 B、凉拌黄瓜 C、玉米馒头 D、糖醋排骨
-
15、活性CuO用于印刷电路板等。由废铜屑(假设不含其他金属)制备活性CuO的过程如图1。回答下列问题:
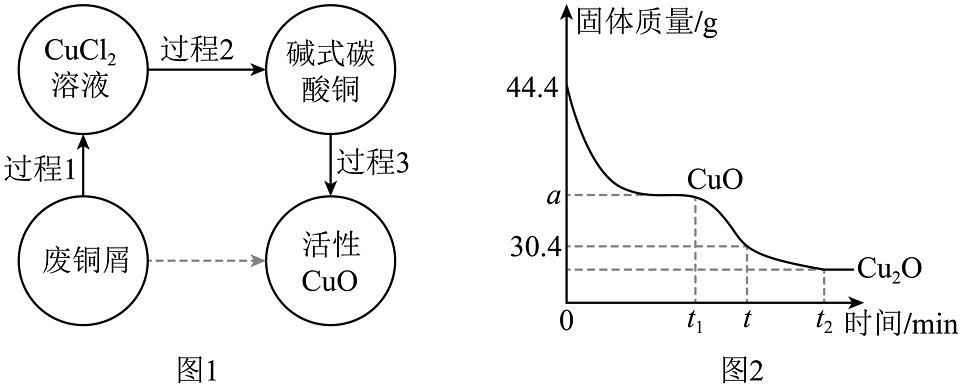 (1)、“过程1”包括:空气中灼烧和稀盐酸溶解。灼烧前可以用来洗涤废铜屑表面的油污,灼烧发生的化学方程式是。(2)、“过程2”的化学方程式2CuCl2+2Na2CO3+H2O=Cu2(OH)2CO3↓+4NaCl+CO2↑,若要得到44.4g碱式碳酸铜,理论上需要10.6%的碳酸钠溶液的质量是多少?(写出计算过程)。(3)、“过程3”的化学方程式Cu2(OH)2CO32CuO+H2O +CO2↑(如图2),理论上可制得活性CuO的质量a为g;若继续加热,CuO会继续分解,当tmin时,剩余gCuO未分解。
(1)、“过程1”包括:空气中灼烧和稀盐酸溶解。灼烧前可以用来洗涤废铜屑表面的油污,灼烧发生的化学方程式是。(2)、“过程2”的化学方程式2CuCl2+2Na2CO3+H2O=Cu2(OH)2CO3↓+4NaCl+CO2↑,若要得到44.4g碱式碳酸铜,理论上需要10.6%的碳酸钠溶液的质量是多少?(写出计算过程)。(3)、“过程3”的化学方程式Cu2(OH)2CO32CuO+H2O +CO2↑(如图2),理论上可制得活性CuO的质量a为g;若继续加热,CuO会继续分解,当tmin时,剩余gCuO未分解。 -
16、
古今很多金属制品造型优美、应用广泛。
I.西汉青铜雁鱼灯的造型和工作原理如图。灯里面是空的,灯罩可自由开合,腹部的清水用于吸收燃烧产生的废气。
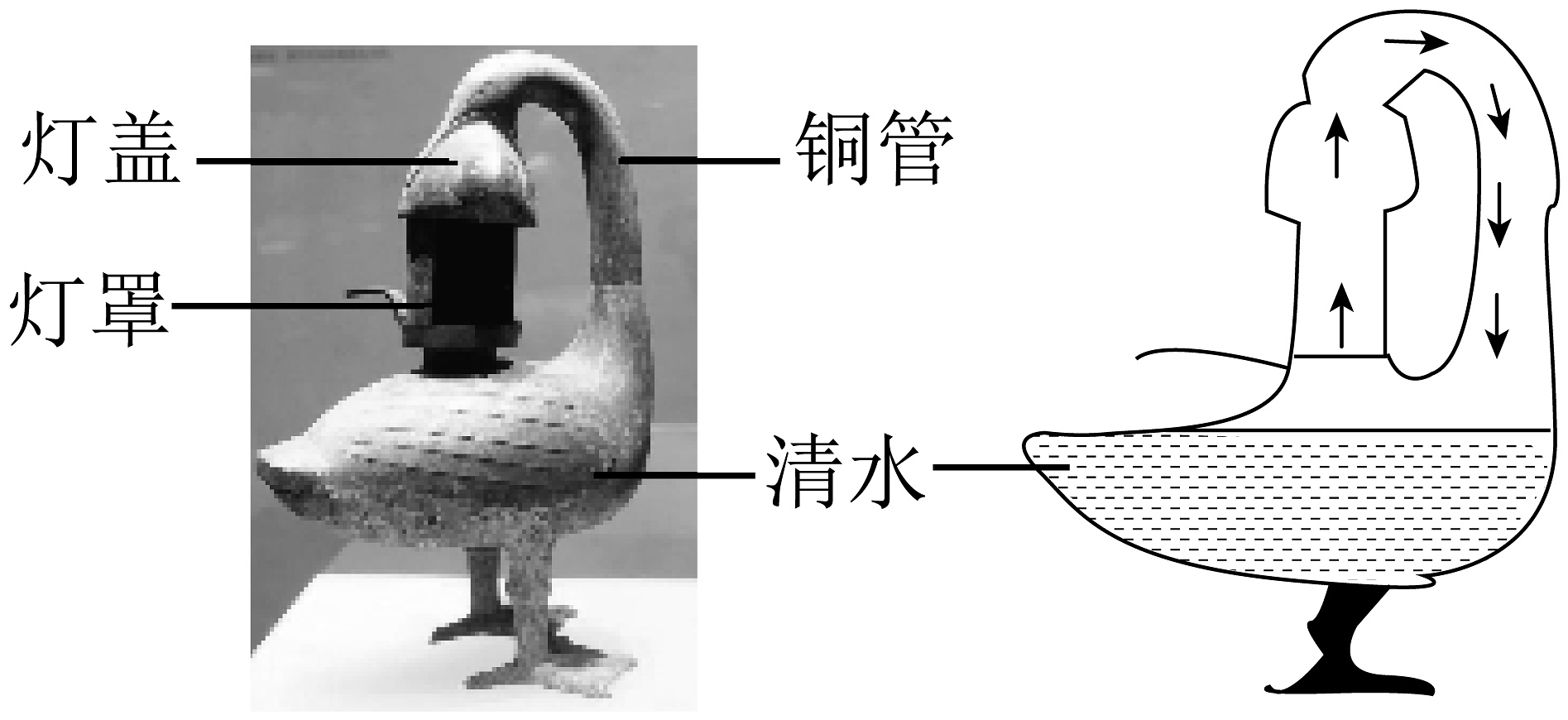
(1)《考工记》记载了青铜成分:“六分其金(‘金’指铜),而锡居其一”,则青铜属于________(填“金属”或“合成”)材料。
(2)出土时灯表面存在绿色锈蚀[主要成分为碱式碳酸铜,化学式为],________。
(3)灯采用淆水(石油,含C、H、S等元素)为燃料,当看到有大量黑烟产生时,应该________(填“扩大”或“减小”)进风口。燃料完全燃烧产生的气体中有污染性的是________,此时若取出少量腹部的溶液,加入紫色石蕊溶液,溶液变________。
II.金属蚀刻画是利用化学反应在金属表面形成凹凸图案。
(4)将铝板表面打磨并贴上保护膜后刻画出图案,再滴加蚀刻液发生反应,蚀刻出一朵红色玫瑰花如图。打磨的目的是________。

(5)工业上,金属镍(Ni)蚀刻可用于生产半导体器件。已知金属活动性: , 据此判断下列能蚀刻镍单质的有_______(填标号)。
A. 稀盐酸 B. 溶液 C. 溶液 D. 溶液 -
17、2021年5月22日,“杂交水稻之父”袁隆平先生逝世、他带着梦的“种子”去了远方,却将粮食的种子留给了后来人。所以,同学们,一粥一饭当思来之不易。完成下列小题:
 (1)、水稻种植过程中的部分流程如下,其中属于化学变化的是A、整地犁田 B、手工插秧 C、农药除虫 D、收割稻谷(2)、碾磨稻壳时,有时加上一薄层滑石粉,滑石粉的主要成分为硅酸镁(MgSiO3),硅酸镁属于A、单质 B、化合物 C、氧化物 D、混合物(3)、焦亚硫酸钠(Na2S2O5)对谷粒有很好的抗氧化作用。焦亚硫酸钠中硫元素的化合价为A、0 B、+2 C、+4 D、+6
(1)、水稻种植过程中的部分流程如下,其中属于化学变化的是A、整地犁田 B、手工插秧 C、农药除虫 D、收割稻谷(2)、碾磨稻壳时,有时加上一薄层滑石粉,滑石粉的主要成分为硅酸镁(MgSiO3),硅酸镁属于A、单质 B、化合物 C、氧化物 D、混合物(3)、焦亚硫酸钠(Na2S2O5)对谷粒有很好的抗氧化作用。焦亚硫酸钠中硫元素的化合价为A、0 B、+2 C、+4 D、+6 -
18、纳米氧化亚铜(Cu2O)固体有优越的光催化性能被应用于废水处理,同时是制备传感器和高温超导材料。烧结法制备纳米氧化亚铜是以纯铜粉为原料,工艺如下:
 (1)、Cu2O中铜、氧元素的质量比为;Cu2O中Cu元素的化合价是。(2)、反应①是在氧气中进行灼烧,其反应的化学方程式为。(3)、反应②是在密闭条件下进行烧结,反应的化学方程式为CuO+CuCu2O制备80kg 含Cu2O 90%的纳米氧化亚铜, 理论上需要 CuO 的质量是多少?(写出计算过程)(4)、准确称取320g纯铜粉,置于充有氧气的密闭容器中加热。容器内物质恰好完全反应,得到纳米氧化亚铜。容器中固体质量如图所示,请判断:温度为700℃时,固体中含有的物质是。
(1)、Cu2O中铜、氧元素的质量比为;Cu2O中Cu元素的化合价是。(2)、反应①是在氧气中进行灼烧,其反应的化学方程式为。(3)、反应②是在密闭条件下进行烧结,反应的化学方程式为CuO+CuCu2O制备80kg 含Cu2O 90%的纳米氧化亚铜, 理论上需要 CuO 的质量是多少?(写出计算过程)(4)、准确称取320g纯铜粉,置于充有氧气的密闭容器中加热。容器内物质恰好完全反应,得到纳米氧化亚铜。容器中固体质量如图所示,请判断:温度为700℃时,固体中含有的物质是。
-
19、CaCl2可用于食品加工、制药等领域。工业上生产CaCl2主要有以下两种方法:
方法一:利用氨碱法制取纯碱后的废液(含有NH4Cl、NaCl)和石灰浆制备CaCl2

方法二:利用石灰石和稀盐酸制备
 (1)、方法一:操作Ⅰ的名称是。废液中的NaCl是由构成的(填“分子”、“原子”或“离子”) 。(2)、方法二 反应器中发生反应的化学方程式为;该方法中,粉碎机和搅拌器所起的作用是。(3)、两种方法对比,方法一制备的CaCl2纯度比较低,原因可能是。(4)、两种方法都会产生大量二氧化碳,大气中二氧化碳含量不断上升,会导致。传统方法中一般用碱对二氧化碳进行捕集吸收,下表中列举了两种碱的价格,工业上会使用捕集吸收二氧化碳。
(1)、方法一:操作Ⅰ的名称是。废液中的NaCl是由构成的(填“分子”、“原子”或“离子”) 。(2)、方法二 反应器中发生反应的化学方程式为;该方法中,粉碎机和搅拌器所起的作用是。(3)、两种方法对比,方法一制备的CaCl2纯度比较低,原因可能是。(4)、两种方法都会产生大量二氧化碳,大气中二氧化碳含量不断上升,会导致。传统方法中一般用碱对二氧化碳进行捕集吸收,下表中列举了两种碱的价格,工业上会使用捕集吸收二氧化碳。Ca(OH)2
NaOH
价格
730元/吨
1600元/吨
我国科学家已经合成出一种催化剂,可以使二氧化碳和氢气在240℃、3MPa时高效稳定地转化为乙醇和水,请写出该反应的化学方程式。
-
20、
空气净化器对室内空气中的粉尘、异味等污染物起到减少甚至清除的作用。化学兴趣小组的同学们对室内空气污染物的来源、成分及防治产生浓厚的兴趣,展开了项目化学习之旅。
项目一:了解室内空气污染物的来源
室内空气污染物主要分为3类:颗粒污染物【可能含有Na2SO4、Na2CO3、(NH4)2SO4等】、微生物污染物和气体污染物,其中的气体污染物主要是装修材料所释放的甲醛、苯等。此外,日常生活中的吸烟、烹饪等行为也会使室内空气受到污染。
(1)甲醛有刺激性气味,从微观角度分析能闻到其气味的原因是。(2)农业上,(NH4)2SO4可用作肥(填“氮”、“磷”或“钾”)。项目二:分析颗粒污染物的成分
(3)同学们从空气净化器的过滤网上收集了一些颗粒污染物,放在烧杯中,加入足量蒸馏水,搅拌,静置。因为颗粒污染物可能含有Na2SO4、Na2CO3、(NH4)2SO4等,所以同学们进行以下实验:实验操作
实验现象
实验结论
步骤1
取少量烧杯中的上层清液, 用pH计进行测定
pH<7
空气污染物没有
步骤2
另取少量烧杯中的上层清液, 滴加BaCl2溶液
空气污染物中有(NH4)2SO4
【得出结论】颗粒污染物中含有(NH4)2SO4 ,
【反思评价】
(4)有同学认为该实验结论不一定正确,理由是 , 因此需要改进实验。【实验改进】
(5)同学们另取一定量的颗粒污染物于研钵中,向其中加入少量熟石灰,混合,研磨,现象是 , 说明含有(NH4)2SO4。【解释总结】
(6)颗粒污染物中含有(NH4)2SO4 , 则实验步骤 2中发生反应的化学方程式是。项目三:交流室内空气污染的防治
(7)空气净化器中的过滤网除去空气中颗粒污染物的方法属于(填“物理变化”或“化学变化”)。结合“项目一”的材料,为减少室内空气污染,在日常生活中应该做到的是(写一条)。