-
1、铜器在潮湿的空气中久置,表面会生成一种绿色固体,称之为“铜绿”。兴趣小组为探究“铜绿”的性质进行的下列实验操作中,正确的是A、取“铜绿”样品
 B、点燃酒精灯
B、点燃酒精灯 C、加热“铜绿”
C、加热“铜绿”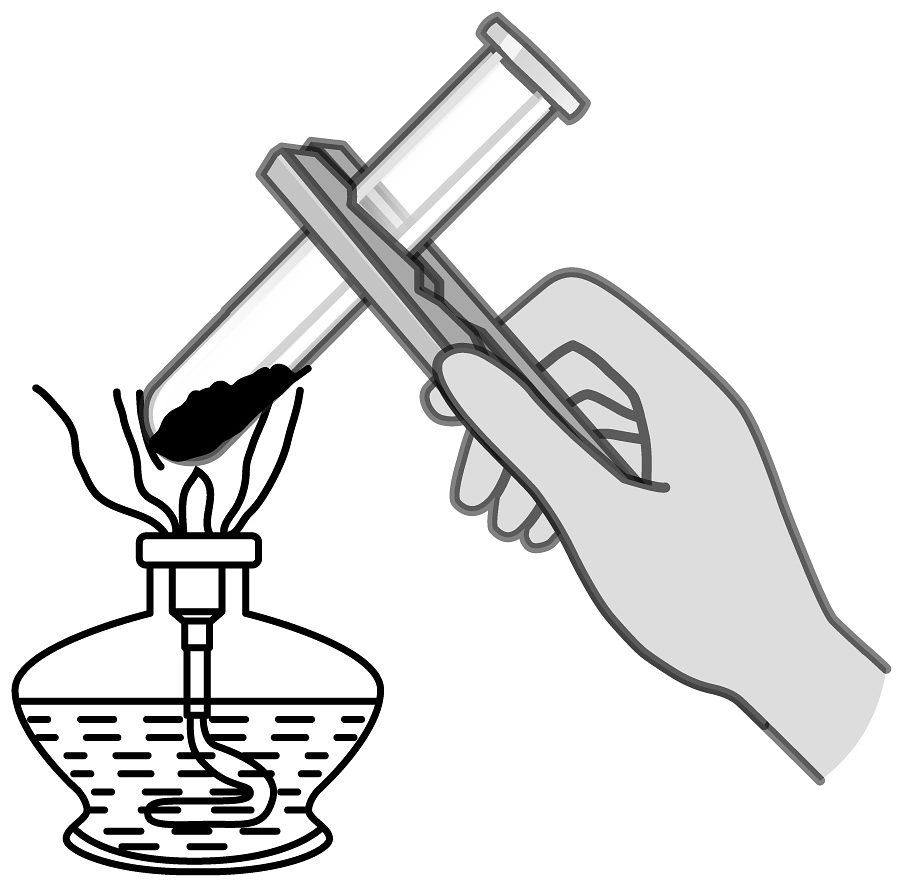 D、加入稀盐酸
D、加入稀盐酸
-
2、水是生命之源,从化学视角研究水有重要意义。下列说法正确的是A、水由氢气和氧气组成 B、水蒸发属于化学变化 C、清澈的井水属于混合物 D、生活污水可直排河流
-
3、下列实验仪器中,既可用作反应容器,又可用酒精灯直接加热的是A、滴管 B、试管 C、量筒 D、烧杯
-
4、化学的发展推动了社会的进步。下列科学家及成就对应不正确的是A、门捷列夫:提出原子学说 B、拉瓦锡:验证质量守恒定律 C、屠呦呦:研制出青蒿素 D、徐寿:参与翻译《化学鉴原》
-
5、中国传统文化中,下列变化与其他有本质区别的是A、粮食酿酒 B、彩陶烧制 C、火炉煮茶 D、海卤晒盐
-
6、某兴趣小组在实验室发现一瓶敞口放置的氢氧化钠固体(不含水分)。为测定氢氧化钠的变质情况,取13.3g变质的氢氧化钠样品于烧杯中,加入55.9g水使其完全溶解,再向烧杯中滴加稀盐酸至过量。测得生成气体质量与所加稀盐酸质量关系如图所示。请计算:
 (1)、13.3g样品中碳酸钠的质量。(2)、B点时,烧杯内溶液的溶质质量分数。
(1)、13.3g样品中碳酸钠的质量。(2)、B点时,烧杯内溶液的溶质质量分数。 -
7、某化学兴趣小组为探究盐酸的化学性质,进行了如图实验。
 (1)、实验A中观察到溶液由无色逐渐变成黄色,是因为反应生成了(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式。(2)、B中反应方程式为 , 向实验B反应后的溶液中滴加紫色石蕊溶液,观察到紫色石蕊溶液变为色。(3)、实验C中加入足量的稀盐酸,现象是 , 反应的微观实质是:。(4)、实验D通过溶液酸碱性变化的角度,证明酸碱发生中和反应。证明碱与酸发生反应的现象是。(5)、实验E通过证明反应物消失的角度,证明酸碱发生中和反应。可以通过图②中现象,证明图①中的酸碱发生了中和反应。要证明图①中的酸碱发生了中和反应,还可以选用的物质是______。(填序号)A、AgNO3溶液 B、石蕊试液 C、Fe粉 D、CaCO3(6)、某化学兴趣小组对金属钠在空气中燃烧及其产物的性质进行研究。
(1)、实验A中观察到溶液由无色逐渐变成黄色,是因为反应生成了(填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式。(2)、B中反应方程式为 , 向实验B反应后的溶液中滴加紫色石蕊溶液,观察到紫色石蕊溶液变为色。(3)、实验C中加入足量的稀盐酸,现象是 , 反应的微观实质是:。(4)、实验D通过溶液酸碱性变化的角度,证明酸碱发生中和反应。证明碱与酸发生反应的现象是。(5)、实验E通过证明反应物消失的角度,证明酸碱发生中和反应。可以通过图②中现象,证明图①中的酸碱发生了中和反应。要证明图①中的酸碱发生了中和反应,还可以选用的物质是______。(填序号)A、AgNO3溶液 B、石蕊试液 C、Fe粉 D、CaCO3(6)、某化学兴趣小组对金属钠在空气中燃烧及其产物的性质进行研究。【查阅资料】①2Na2O2+2H2O=4NaOH+O2↑;②2Na2O2+2CO2=2Na2CO3+O2。
【实验探究】取一小块钠放在石棉网上灼烧,金属钠燃烧并产生黄色火焰,最后生成淡黄色固体。将淡黄色固体露置于空气中,一段时间后变为白色粉末。同学们经过讨论,认为该白色粉末可能是:猜想I:NaOH;猜想II:Na2CO3;猜想III:。为确定该白色粉末的成分,进行如表实验:
实验步骤
实验现象
实验结论
步骤I:取少量白色粉末于试管中,加水溶解,滴加过量的溶液
反应的化学方程式是。
此白色粉末是Na2CO3 , 猜想II正确。
步骤II:静止后,向上层清液中滴加少量溶液
无明显现象
【反思】步骤I中加入试剂的作用是。
-
8、“84”消毒液(主要成分是NaClO)是一种常用的环境消毒剂,某同学用粗盐(含CaCl2、MgCl2、Na2SO4、泥沙等杂质)制“84”消毒液的流程如图:
 (1)、操作①的名称是。(2)、加入过量碳酸钠溶液的目的是。(3)、溶液E中含有的杂质离子有(写离子符号)。(4)、除杂后所得NaCl比原粗盐样品中的NaCl多,其原因是。(5)、NaCl溶液通电时生成Cl2(黄绿色气体)、H2和NaOH的化学方程式为。
(1)、操作①的名称是。(2)、加入过量碳酸钠溶液的目的是。(3)、溶液E中含有的杂质离子有(写离子符号)。(4)、除杂后所得NaCl比原粗盐样品中的NaCl多,其原因是。(5)、NaCl溶液通电时生成Cl2(黄绿色气体)、H2和NaOH的化学方程式为。 -
9、欲证明与发生了化学反应,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。
 (1)、图一,实验前形管两端液面相平,将溶液滴入试管中,恢复到室温后,形管中的液面 , 据此,甲同学得出与发生了化学反应的结论。(2)、图二,将氢氧化钠溶液滴入盛有二氧化碳的锥形瓶,当观察到的现象时,说明两者发生了化学反应。(3)、上述实验得到的实验结论的证据不充足,理由是。(4)、按图三所示装置进行实验。实验步骤如下:
(1)、图一,实验前形管两端液面相平,将溶液滴入试管中,恢复到室温后,形管中的液面 , 据此,甲同学得出与发生了化学反应的结论。(2)、图二,将氢氧化钠溶液滴入盛有二氧化碳的锥形瓶,当观察到的现象时,说明两者发生了化学反应。(3)、上述实验得到的实验结论的证据不充足,理由是。(4)、按图三所示装置进行实验。实验步骤如下:①检查装置的气密性,往装置中加入药品;
②关闭 , 将注射器中的溶液缓缓推入中;
③中物质充分作用后,打开。
步骤③中,打开后产生的现象有 , 从而证明与发生了化学反应。与反应的化学方程式为。
-
10、海洋是一个巨大的资源宝库,可以从中提取化工产品。(1)、工业上用反渗透膜法淡化海水,其原理是利用海水中各成分的不同分离出淡水,分离淡水后剩余的溶液,可以进行海水晒盐,海水晒盐是通过(填“蒸发结晶”或“降温结晶”)的方法获取食盐。(2)、在工业生产中,可以利用海水晒盐后的苦卤制镁,如图是从海水中提取镁的简单流程。

①工业生产中,反应I的化学方程式是。
②上述工艺流程中,发生中和反应的是(填序号)。
③从海水中提取MgCl2历经步骤I、II、III三步转换的主要目的是。
(3)、如图是某厂生产纯碱的工艺流程图:
请完成下列问题:
①流程I中为了除去杂质,加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液。下列说法正确的是。
A.加入三种溶液的顺序不能调整
B.加入三种溶液将粗盐水中的SO、Mg2+、Ca2+转化为沉淀
C.按流程I所加溶液的顺序除杂,过滤后得到四种沉淀
D.流程I得到的是纯净的氯化钠溶液
②在流程II中,如果加入氨气不是为了生产氯化铵,氨气在制碱过程中作用是。
③写出流程II和III中发生反应的化学方程式:。
④流程II中碳酸氢钠先结晶析出的原因是:。
-
11、学了酸的化学性质,某同学以稀硫酸为主题,绘制了“多彩酸世界”思维导图。
 (1)、若要实现①,请你填一种试剂的名称。(2)、若用Cu(OH)2实现②,反应的化学方程式是。(3)、若想实现③得到浅绿色溶液,可选用的单质是(填名称)。(4)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。
(1)、若要实现①,请你填一种试剂的名称。(2)、若用Cu(OH)2实现②,反应的化学方程式是。(3)、若想实现③得到浅绿色溶液,可选用的单质是(填名称)。(4)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。 -
12、请根据酸、碱、盐的相关知识,回答下列问题:(1)、食醋的溶质是醋酸,其溶质的质量分数越大酸性越强。在常温下,溶质质量分数为3%的食醋的pH(填“>”、“<”或“=”)4%的食醋的pH,有一瓶食醋的pH为3,若要使该食醋的pH升高而又不改变其中的溶质,可以采用的方法有。(2)、胃液中含有适量的盐酸。由于胃酸过多而引起的胃痛,可服用含有Mg(OH)2的药物来中和过多的胃酸,发生反应的化学方程式为。(3)、小明探究NaOH和CO2的反应。用如图装置进行实验,实验时先后将两种溶液快速推入,瓶内压强变化如图所示:

①先推入的溶液是 , 反应的化学方程式为。
②bc段压强不变的原因是。cd段压强变大,原因是(用化学方程式表示)。
-
13、化学与生产生活密切相关,回答下列问题:(1)、经环保局检测,某废水主要含有某种常见的酸(盐酸或硫酸)。
①要测出废水的酸碱性强弱程度,应选用下列的试剂是(填序号)。
A.pH试纸 B.无色酚酞 C.紫色石蕊试液 D.红色石蕊试纸
②废水导致土壤酸化,可使用(填写物质俗名)来中和土壤酸性。
(2)、可燃冰被誉为“未来能源”,其主要成分燃烧的化学方程式为。 -
14、下列图像能正确反映其对应关系的是A、
 向饱和的氢氧化钙溶液中加入少量的氧化钙
B、
向饱和的氢氧化钙溶液中加入少量的氧化钙
B、 某温度下,向接近饱和的硝酸钠溶液中加入硝酸钠固体
C、
某温度下,向接近饱和的硝酸钠溶液中加入硝酸钠固体
C、 向一定量Na2CO3和NaOH的混合溶液中逐滴加入稀盐酸
D、
向一定量Na2CO3和NaOH的混合溶液中逐滴加入稀盐酸
D、 向一定溶质质量分数的NaOH溶液中加水稀释
向一定溶质质量分数的NaOH溶液中加水稀释
-
15、下列除杂试剂和方法都正确的是
选项
物质(括号内为杂质)
加入的除杂试剂及方法
A
CO2(H2)
O2、点燃
B
CuO(CaO)
加水足量水溶解,过滤
C
稀硫酸(盐酸)
加适量AgNO3溶液,过滤
D
CaCO3(Na2CO3)
加入过量盐酸,过滤
A、A B、B C、C D、D -
16、下列各组溶液混合后,能发生化学反应且溶液总质量不变的是A、氢氯化钡溶液和稀盐酸 B、氢氧化钾溶液和氯化钠溶液 C、硫酸铜溶液和氯化钡溶液 D、碳酸钠溶液和稀盐酸
-
17、甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是
 A、t3℃时,甲、乙、丙的饱和溶液降温到t1℃时,析出晶体最多的是甲的溶液 B、t2℃时,将25g乙加入到50g水中,再降温到t1℃,所得溶液的溶质质量分数约为33.3% C、t1℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙 D、将t3℃甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是:乙>甲=丙
A、t3℃时,甲、乙、丙的饱和溶液降温到t1℃时,析出晶体最多的是甲的溶液 B、t2℃时,将25g乙加入到50g水中,再降温到t1℃,所得溶液的溶质质量分数约为33.3% C、t1℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙 D、将t3℃甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数由大到小的顺序是:乙>甲=丙 -
18、推理和归纳是化学学习和研究中常用的思维方法,下列推理正确的是A、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 B、碳酸盐与盐酸反应放出气体,所以能与盐酸反应放出气体的物质一定是碳酸盐 C、酸性物质能使石蕊试液变红色,则能使石蕊试液变红色的物质一定显酸性 D、酸能跟碱反应生成盐和水,能跟碱反应生成盐和水的物质不一定是酸
-
19、下列各组离子在pH=13的环境中能形成无色透明溶液的一组( )A、H+、Na+、Cl-、NO B、Na+、Mg2+、Cl-、NO C、Cu2+、K+、SO、Cl- D、Ba2+、Na+、SO、Cl-
-
20、下列有关海洋化学资源的说法,错误的是A、可燃冰被称为“未来能源”,其燃烧后几乎不产生任何残渣或废气 B、蒸馏法淡化海水利用的原理是构成物质的微粒大小不同 C、为检验蒸馏法得到的冷凝水样中是否含有氯化钠,可向其中滴加几滴硝酸银溶液 D、海水中含量最多的盐是氯化钠