相关试卷
-
1、零碳能源—氨气。氨气()被广泛认为是未来理想的零碳燃料,在一定条件下,氨气能燃烧生成水和氮气。氨气很容易液化,是一种极易溶于水、无色、有刺激性气味的气体,对黏膜有刺激作用,其水溶液呈碱性。氨气比氢气更易液化储运,作为氢能源的载体有发展潜力。某研究中揭示了氮气与氢气在催化剂表面合成氨气的反应过程,该反应过程的微观示意图如图1所示。

合成氨的原料常用液态空气分离法、膜分离法(如图2)和分筛吸附法(如图3)获取。生产有煤气化、天然气重整及可再生能源电解水等方法,根据的来源,所合成的氨分别称为棕氨、蓝氨和绿氨。绿氨被归类为基本上零碳的氨。“间歇式清洁电力Haber-Bosch法合成氨工艺”利用和(经可再生能源电解水制得)在高温高压催化剂条件下反应制氨,是目前唯一大规模合成氨方法。该方法只使用可再生电力、水和空气,副产品只有氧气,是清洁可持续的合成氨生产方式。

依据上文,回答下列问题:
(1)、氨气燃烧时发生的化学反应方程式为 , 属于化学基本反应类型中的反应。(2)、科学家研究寻找合成氨气反应催化剂的目的是。(3)、液态空气分离法、膜分离法、分子筛吸附法制都利用了物质(填“物理”或“化学”)性质不同进行分离。(4)、由图4可知分子筛吸附法制 , 情况下越有利于分离氮气和氧气。 (5)、Haber-Bosch工艺合成的氨属于(填“棕氨”或“蓝氨”或“绿氨”)。(6)、实验室可用加热熟石灰和氯化铵的混合物来制取氨气,选用的制取装置组合为。
(5)、Haber-Bosch工艺合成的氨属于(填“棕氨”或“蓝氨”或“绿氨”)。(6)、实验室可用加热熟石灰和氯化铵的混合物来制取氨气,选用的制取装置组合为。
-
2、如图是a、b、c三种物质的溶解度曲线。下列说法正确的是
 A、℃时a、b、c三种物质的溶解度由大到小的顺序是 B、℃时把30g a物质放入50g水中,可得到80g a物质的饱和溶液 C、要除去a溶液中混有的少量b物质,可用降温结晶的方法 D、从℃降温到℃,可将c物质的不饱和溶液变成饱和
A、℃时a、b、c三种物质的溶解度由大到小的顺序是 B、℃时把30g a物质放入50g水中,可得到80g a物质的饱和溶液 C、要除去a溶液中混有的少量b物质,可用降温结晶的方法 D、从℃降温到℃,可将c物质的不饱和溶液变成饱和 -
3、如图是初中阶段的常见物质,其中乙是密度最小的气体,如图表示了各物质之间的转化关系(“→”表示物质之间可以发生转化)。下列有关描述错误的是
 A、物质甲的化学式是 B、物质乙在点燃前要先进行验纯 C、丙是由地壳中含量最多的元素组成的单质 D、丁属于空气污染物之一
A、物质甲的化学式是 B、物质乙在点燃前要先进行验纯 C、丙是由地壳中含量最多的元素组成的单质 D、丁属于空气污染物之一 -
4、从如下某化学反应的微观示意图中,获得的信息错误的是
 A、该反应前后原子的种类、数目保持不变 B、反应为化合反应 C、参加反应的反应物的分子个数比为 D、
A、该反应前后原子的种类、数目保持不变 B、反应为化合反应 C、参加反应的反应物的分子个数比为 D、 是一种氧化物
是一种氧化物
-
5、化学用语是学习化学的工具。请帮助小深同学分析,下列化学用语错误的是A、硫酸镁的化学式: B、铁离子: C、氯化钠中钠元素的化合价: D、氩气:
-
6、阅读以下材料,完成下面小题。
从空间站在轨实验到2024年6月25日嫦娥六号实现世界首次月球背面采样,彰显了中国航天技术的强大实力。航天科技的进步,化学发挥着不可替代的作用。火箭外壳主要材料为铝合金和钛合金。如图为钛元素在元素周期表中的信息及其原子结构示意图。部分运载火箭装载的燃料和助燃剂分别是偏二甲肼()和四氧化二氮,二者接触即可发生反应,释放出强大的能量,将载人飞船送入预定轨道。
(1)、下下列关于钛元素说法正确的是 A、如图所示原子结构示意图中X的数值为8 B、钛原子的相对原子质量为47.87g C、钛原子与氦原子的化学性质相似 D、钛原子容易失去电子形成钛离子(2)、下列关于偏二甲肼()说法正确的是A、偏二甲肼分子由三种元素组成 B、偏二甲肼中含有氮分子 C、偏二甲肼分子由12个原子构成 D、偏二甲肼中氢元素的质量分数最小
A、如图所示原子结构示意图中X的数值为8 B、钛原子的相对原子质量为47.87g C、钛原子与氦原子的化学性质相似 D、钛原子容易失去电子形成钛离子(2)、下列关于偏二甲肼()说法正确的是A、偏二甲肼分子由三种元素组成 B、偏二甲肼中含有氮分子 C、偏二甲肼分子由12个原子构成 D、偏二甲肼中氢元素的质量分数最小 -
7、下列实验操作中,正确的是


A.倾倒液体
B.称量氢氧化钠


C.测定溶液的pH
D.稀释浓硫酸
A、A B、B C、C D、D -
8、下列各图中
 和
和 分别表示不同元素的原子,其中表示混合物的是 A、
分别表示不同元素的原子,其中表示混合物的是 A、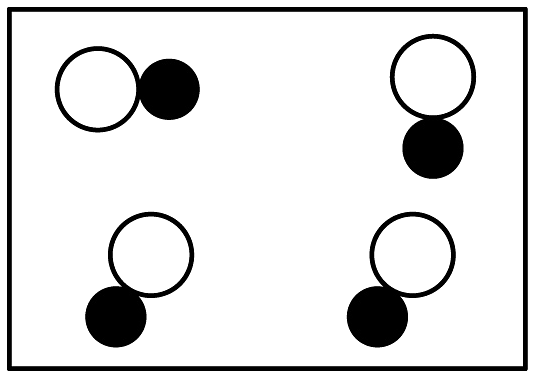 B、
B、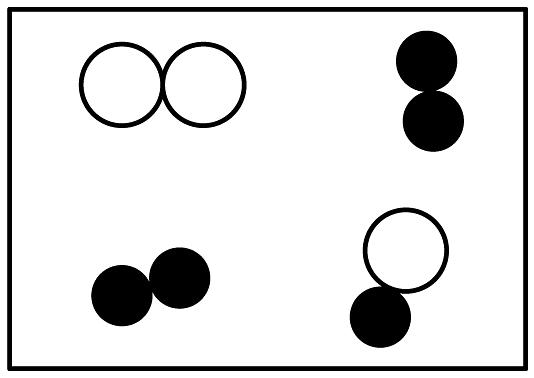 C、
C、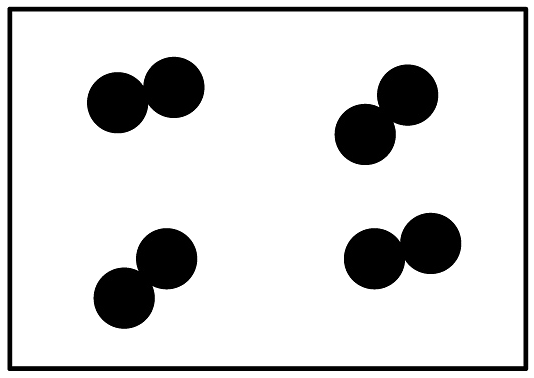 D、
D、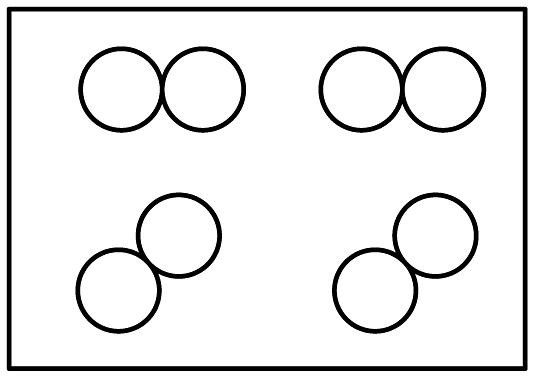
-
9、某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
步骤1:分别称取两份质量为25.0g的石灰石样品,并加工成块状和粉末状;
步骤2:将两份样品分别投入两个锥形瓶中,各加入足量的同种稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:
 (1)、由图①中曲线分析得出,影响该化学反应速率的因素是。(2)、每份样品充分反应后。生成二氧化碳的质量为g。(3)、求该样品中碳酸钙的质量分数。(写出计算过程)(4)、小组同学用如图②装置测量二氧化碳体积,装置中放植物油作用是。
(1)、由图①中曲线分析得出,影响该化学反应速率的因素是。(2)、每份样品充分反应后。生成二氧化碳的质量为g。(3)、求该样品中碳酸钙的质量分数。(写出计算过程)(4)、小组同学用如图②装置测量二氧化碳体积,装置中放植物油作用是。 -
10、
水是人类宝贵的自然资源。
Ⅰ.水的组成
某小组同学设计如下图1装置进行电解水实验,先在电解器玻璃管里加满水(含少量NaOH),再接通直流电源。

(1)a、b两支玻璃管中生成气体的体积比约为。
(2)电解水的微观过程如下图2所示,补全横线上的模型图。结合图示分析,下列说法正确的有(填序号)。

A.保持水化学性质的粒子是水分子
B.化学反应前后元素种类不变
C.构成氧气的微观粒子是氧原子
(3)为探究不同电压和不同浓度NaOH溶液对电解水速率的影响,小组同学进行多次实验,测..得产生20mLH2所需时间如下图3。结合图示分析,电解溶质质量分数为5%的NaOH溶液时,随着电压的增大,电解水速率;上述实验中,电解水速率最快的条件是。

Ⅱ.水的净化
市面上一种“生命吸管”便携式净水器如上图4所示:

(4)纺织网的作用相当于过滤操作,实验室进行该操作时,用到的玻璃仪器有玻璃棒、烧杯、漏斗,其中玻璃棒的作用是。
(5)活性炭的作用是。
(6)“生命吸管”中得到的饮用水是(填“纯净物”或“混合物”)。
Ⅲ水的爱护
(7)“爱护水资源,从我做起”。请写出一种你在生活中节约用水的措施:。
-
11、
【基础实验和跨学科实践】
Ⅰ.下图中A~E是实验室制取和收集气体的部分装置。请完成下列问题:

(1)写出图中标号仪器名称:a。
(2)在实验室用高锰酸钾制氧气时应该选择的发生装置是 , 反应的化学方程式为 , 装置中还缺少一种实验用品。
(3)实验室用B装置制取二氧化碳时,分液漏斗内应盛放的试剂是;收集装置应选择(填序号),检验二氧化碳已收集满的方法是。
Ⅱ.“碳封存”与“碳转化”是实现碳中和目标不可或缺的重要技术选择。
(4)“碳封存”:从微观角度分析二氧化碳易被压缩的原因:。
(5)“碳转化”:在一定条件下,利用新型电解装置可将二氧化碳转化为甲酸(HCOOH),化学方程式为 , 甲酸中氢、氧原子个数比为。
-
12、【科普阅读】
石墨烯(Graphene)是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。石墨烯具有许多“极端”的物理性质,被称为“黑金”,是“新材料之王”。本身重量不足1mg的石墨烯,可以做成一块的石墨烯吊床。石墨烯是现今世界上存在最硬的物质,具有极强的导热性能和优良的透光性能,导电性比银还强。有预言称,石墨烯将成为硅的替代品,计算机处理器的运行速度将会快数百倍。石墨烯在电子、复合材料、医疗健康等多领域具有广泛应用,不同领域的应用分布如图所示。

氧化石墨烯薄膜与水接触后可形成约0.9纳米宽的通道,可让水分子可以快速通过,能高效滤去海水中的盐分,用于海水淡化。石墨烯的基本化学性质与石墨类似,实验结果表明,石墨烯的着火点在700-800℃左右。
依据上文,回答问题。
(1)、“本身重量不足1毫克的石墨烯,可以做成一块1平方米的石墨烯吊床”,说明石墨烯具有良好的性。(2)、由上图可见,石墨烯中每个碳原子周围连接个碳原子,其物理性质与金刚石不同的原因是。(3)、目前“石墨烯”应用占比最高的在领域,“氧化石墨烯薄膜”可用于。(4)、实验表明,石墨烯在氧气能燃烧,反应的化学方程式为。(5)、下来关于石墨烯的说法错误的是________(填序号)。A、金刚石的硬度大于石墨烯 B、石墨烯是由碳元素组成的单质 C、用机械剥离法制备石墨烯属于物理变化 D、石墨烯有许多“极端”的物理性质,是因为其具有特殊的结构 -
13、请回答下列问题。(1)、请用恰当的化学用语表示。
①赤铁矿的主要成分是;
②人体中含量最高的金属元素;
③氢氧化钡;
④标出二氧化锰中锰元素的化合价;
⑤3个镁离子。
(2)、按要求写出下列数字“2”表达的含义:①;
②CO2。
-
14、为探究Al、Fe、Cu、Ag四种金属的活动性强弱,某同学进行了如下实验(实验所用金属片形状、大小均相同),下列说法不正确的是
 A、对比甲、乙实验能说明铁的活动性比铜的强 B、丙的实验现象是铜片表面有银白色物质析出,溶液颜色由无色变为蓝色 C、实验前金属要打磨,以除去其表面的氧化物 D、为探究四种金属活动性强弱,丁要补充的实验应是铝片与硫酸铜溶液的反应
A、对比甲、乙实验能说明铁的活动性比铜的强 B、丙的实验现象是铜片表面有银白色物质析出,溶液颜色由无色变为蓝色 C、实验前金属要打磨,以除去其表面的氧化物 D、为探究四种金属活动性强弱,丁要补充的实验应是铝片与硫酸铜溶液的反应 -
15、证据推理是学习化学的重要方法,下列推理正确的是A、金属在自然界中都是以化合物的形式存在 B、纯净物只含有一种元素,只含有一种元素的物质一定是纯净物 C、活泼金属与酸反应生成气体,能与酸反应生成气体的不一定是活泼金属 D、置换反应生成单质和化合物,生成单质和化合物的反应一定是置换反应
-
16、劳动创造美好生活。下列劳动实践项目与所述化学知识没有关联的是
选项
劳动实践项目
化学知识
A
用氦气做探空气球
氦气密度小
B
微型空气质量检测仪测定CO2含量
CO2可用于灭火
C
炒菜时油锅着火,用锅盖盖灭
隔绝氧气
D
将湿衣服放在阳光下晾晒
温度越高,分子运动速率越快
A、A B、B C、C D、D -
17、广东凉茶被列为国家首批非物质文化遗产。凉茶具有清热解毒、凉血利咽功效,主要成分是黑芥子甙(C10H17NO9S2),可以预防感冒。下列有关说法正确的是A、黑芥子甙是氧化物 B、黑芥子甙中含有38个原子 C、黑芥子甙中H、O、S的质量比为17:9:2 D、黑芥子甙含有5种元素
-
18、2024年11月4日,神舟十八号载人飞船成功返回地面,圆满完成任务。搭载神舟飞船的火箭常用液氢作燃料,氢在元素周期表中的部分信息如下图所示,请回答下列小题:
 (1)、下列代表两个氢分子的是A、H2 B、2H C、2H2 D、2H+(2)、空间站内的气体组成和地表空气基本一致,其中体积分数约为21%的气体是A、氮气 B、氧气 C、二氧化碳 D、稀有气体(3)、下列有关氢的说法错误的是A、元素符号H B、属于非金属元素 C、相对原子质量为1.008g D、氢原子中核外电子数为1(4)、氢元素和氧元素的本质区别是A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同(5)、生产、生活中离不开能源。下列属于新能源的是A、煤 B、石油 C、天然气 D、氢能
(1)、下列代表两个氢分子的是A、H2 B、2H C、2H2 D、2H+(2)、空间站内的气体组成和地表空气基本一致,其中体积分数约为21%的气体是A、氮气 B、氧气 C、二氧化碳 D、稀有气体(3)、下列有关氢的说法错误的是A、元素符号H B、属于非金属元素 C、相对原子质量为1.008g D、氢原子中核外电子数为1(4)、氢元素和氧元素的本质区别是A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同(5)、生产、生活中离不开能源。下列属于新能源的是A、煤 B、石油 C、天然气 D、氢能 -
19、一种可同步回收废电池正极材料的锂和处理工业废气中的装置工作原理如图1所示。
 (1)、中,Fe和Li的质量比为(填最简整数比);(2)、碳布上,到的转化中氮元素化合价(填“升高”或“降低”)。(3)、该回收系统可将能转化为电能。(4)、已知转化的方程式为: , 制备理论上需消耗kg。(写出计算过程)(5)、某废电池正极材料组成如图2所示,Fe和Li的质量比为2:1。装置作用一段时间,生成 , 若作用过程中锂损耗为正极材料中锂元素总质量的20%,则该电池的正极材料中铁元素的质量为kg。
(1)、中,Fe和Li的质量比为(填最简整数比);(2)、碳布上,到的转化中氮元素化合价(填“升高”或“降低”)。(3)、该回收系统可将能转化为电能。(4)、已知转化的方程式为: , 制备理论上需消耗kg。(写出计算过程)(5)、某废电池正极材料组成如图2所示,Fe和Li的质量比为2:1。装置作用一段时间,生成 , 若作用过程中锂损耗为正极材料中锂元素总质量的20%,则该电池的正极材料中铁元素的质量为kg。 -
20、
实验小组利用废硫酸液制备并研究加热分解的产物。
实验一:制备 , 实验流程如图:

(1)加入过量的目的是。
(2)上述流程中可循环使用的物质有和。
(3)不用水而用饱和溶液洗涤反应Ⅲ所得晶体的目的是。
(4)反应Ⅲ属于复分解反应,则可推出反应Ⅲ的化学方程式为。
实验二:研究加热分解的产物
【查阅资料】
Ⅰ.受热会逐步失去结晶水。在160℃时完全生成 , 1350℃时CaSO4开始分解。
Ⅱ.能使酸性溶液褪色;不能使酸性溶液褪色。
取纯净固体3.44g,用控温电热丝进行加热,测定固体质量随温度的变化情况如图所示。

(5)从曲线中可知产生水的质量为 g。
(6)用数据x可计算出H点固体是氧化钙,则x为。
(7)当加热固体至1350℃,将产生的气体通入酸性溶液中,发现溶液褪色,则该气体中含有(写化学式);此外,G~H还产生了氧气,该反应化学方程式为。