相关试卷
-
1、我国高度重视并积极推动氢能技术与产业发展,近年来我国制氢量已位居世界第一。(1)、制氢技术
制氢方法一:水光解制氢
①水在光催化剂作用下制备氢气的原理如图1所示。光解水时,由能转化为化学能。

制氢方法二:创新工艺
我国科学家研发的创新工艺利用稀土元素铈(Ce)的氧化物Ce2O3 , 实现了从甲烷中提取氢元素并转化为氢气的过程,其反应原理详见图2。

②写出反应器I中反应的化学方程式。
③反应器II反应CH4+2CeO2Ce2O3+2H2+CO,现有200kg含甲烷90%的天然气(杂质不参与反应)通入反应器II中,若甲烷完全反应,理论上反应器II中最多生成氢气的质量是多少?(写出计算过程)
④据图2,加入的Ce2O3经过反应器I、II一轮反应后又重新生成,且质量不变,再进入下一轮反应后又重生,如此循环。可推测Ce2O3在整个工艺中的作用是。
(2)、储氢图3是一些储氢材料的质量储氢密度(质量储氢密度=储氢后氢元素在储氢材料中的质量分数)。由图3可知,下列储氢材料中最理想的是(填序号)。

a.LaNi5H6 b.LiAlH4 C.Mg2FeH6 d.Al(BH4)3
-
2、
在化学实验操作中,小明和小红分别抽取了I、II组试题进行实验。

I组:O2和CO2的制取与性质探究
(1)实验室中装置A、B都可以用来制取氧气和二氧化碳,其中仪器a的名称是 , 实验室制取二氧化碳的反应的化学方程式为 , 装置C中凹陷的软质塑料瓶的。优点与装置(填“A”或“B”)相似。
(2)小明提出用装置C可以验证可燃物燃烧的条件,进行如下实验:
ⅰ.捏住乙处瓶身(如图所示)一段时间后,点燃丁处酒精灯,观察到丙处硫不燃烧。
ⅱ.继续实验:放开乙处瓶身,捏住甲处瓶身一段时间,观察到丙处的现象是。
通过对比实验ⅰ、ⅱ,可以得出结论:物质燃烧需要。并且能够得出CO2的化学性质之一是。
(3)戊中氢氧化钠溶液的作用是。
II组:兴趣小组利用数字化实验对氢氧化钠和稀盐酸中和反应进行探究,并用传感器记录数据,结果如图所示:
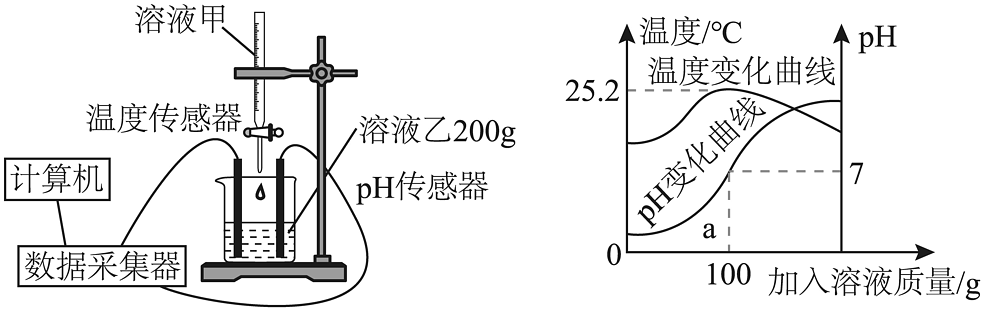
(4)a点时溶液所含的溶质是(填化学式),该反应为反应(填“吸热”或“放热”)。
-
3、硫元素以硫化物、硫酸盐、有机硫和单质硫等形式广泛存在于自然界。硫在某些系外行星的大气层中以H2S和SO2的形式存在,这些物质经过光化学反应,产生了S8和H2SO4;硫在地壳中的含量为0.048%,是自然界中重要的非金属元素,其在自然界的循环过程如图所示。硫还存在于人体中,是甲硫氨酸(C5H11O2NS)和半胱氨酸(C3H7NO2S)等氨基酸的组成元素。硫是植物维持生命活动所需的元素,可以通过施加硫肥(硫黄或可溶性硫酸盐溶液)补充。我国古代“四大发明”之一的黑火药,主要由硫黄、硝酸钾和木炭按一定比例混合而成。
 (1)、短文中光化学反应生成的硫单质的化学式是。(2)、甲硫氨酸C5H11O2NS是一种有机化合物,其中元素的质量分数最大。(3)、试选出一种能增强抗倒伏能力的钾肥:(填字母)。
(1)、短文中光化学反应生成的硫单质的化学式是。(2)、甲硫氨酸C5H11O2NS是一种有机化合物,其中元素的质量分数最大。(3)、试选出一种能增强抗倒伏能力的钾肥:(填字母)。a.NH4Cl b.KCl c.K2SO4 d.CO(NH2)2
(4)、黑火药燃爆会生成、和 , 写出黑火药燃爆的化学方程式:。(5)、由图可知,下列说法正确的是______(多选,填字母)。A、过程I中硫元素的化合价升高 B、减少使用化石能源可以减少SO2排放 C、含硫有机物和含硫无机物可相互转化 D、过程II是形成酸雨的原因之一 -
4、《天工开物》蕴含着丰富的化学知识与方法。其中关于银的冶炼过程如图所示。
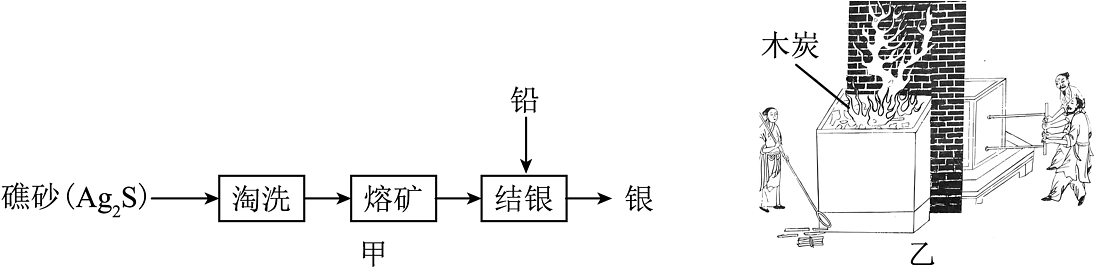 (1)、铅、银属于(填“金属”或“非金属”)单质。(2)、“淘洗”时可用水除去矿砂中的一些杂质,其原理是利用了。(3)、补充完整“熔矿”时氧气与Ag2S反应的化学方程式:2Ag2S+3O22SO2+2。(4)、“熔矿”“结银”操作如图乙所示,所需热量由木炭燃烧提供,木炭充分燃烧反应的化学方程式为。(5)、为使图乙中木炭燃烧更充分,可采取的措施是(写一条),当火候足够,即可熔化成铅银团块,铅银团块⑥(填“属于”或“不属于”)合金。
(1)、铅、银属于(填“金属”或“非金属”)单质。(2)、“淘洗”时可用水除去矿砂中的一些杂质,其原理是利用了。(3)、补充完整“熔矿”时氧气与Ag2S反应的化学方程式:2Ag2S+3O22SO2+2。(4)、“熔矿”“结银”操作如图乙所示,所需热量由木炭燃烧提供,木炭充分燃烧反应的化学方程式为。(5)、为使图乙中木炭燃烧更充分,可采取的措施是(写一条),当火候足够,即可熔化成铅银团块,铅银团块⑥(填“属于”或“不属于”)合金。 -
5、下列实验设计能达到实验目的的是
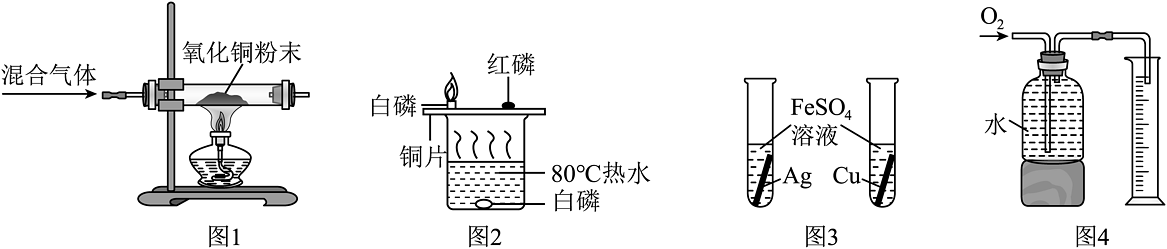 A、图1:除去CO中混有的CO2 B、图2:探究可燃物燃烧的条件 C、图3:比较Fe、Cu、Ag的金属活动性 D、图4:测定氧气的体积
A、图1:除去CO中混有的CO2 B、图2:探究可燃物燃烧的条件 C、图3:比较Fe、Cu、Ag的金属活动性 D、图4:测定氧气的体积 -
6、下列实验方案不合理的是
选项
实验目的
实验方案
A
稀释浓硫酸
将浓硫酸沿烧杯壁缓慢注入水中,不断搅拌
B
鉴别NaOH固体和NH4NO3固体
分别加水溶解,用温度计测量温度变化
C
除去NaCl固体中的少量Na2CO3
加入适量稀盐酸,蒸发结晶
D
回收KCl和MnO2混合物固体中的KCl
加水溶解、过滤、洗涤、干燥
A、A B、B C、C D、D -
7、下列对化学基本观念的认识不正确的是A、微粒观:保持二氧化碳化学性质的最小粒子是二氧化碳分子 B、守恒观:镁条在空气中燃烧后质量增加,不符合质量守恒定律 C、结构观:金刚石坚硬而石墨质软,是由于碳原子排列方式不同 D、能量观:化学反应过程伴随着能量变化,有能量变化的过程不一定发生化学变化
-
8、下列劳动实践与所述化学知识不相符的是
选项
劳动实践
化学知识
A
用加碘盐调味
碘元素能预防甲状腺肿大
B
氦气加压后变为液态
分子的间隔变大
C
活性炭用于自制净水器
活性炭具吸附性
D
铁锅洗净擦干后放置
铁在潮湿的空气中易生锈
A、A B、B C、C D、D -
9、化学用语是学习化学的重要工具下列化学用语表述错误的是A、碳酸氢钠:NaHCO3 B、2个水分子:2H2O C、柠檬酸中的阳离子:H1+ D、二氧化碳中氧元素的化合价:
-
10、被誉为“中国稀土之父”,带领团队研发了稀土分离技术,使我国能够自主分离稀土产品的化学家是A、张青莲 B、徐光宪 C、屠呦呦 D、侯德榜
-
11、分类是研究和认识问题的重要方法,下列分类中正确的是A、碱:熟石灰、烧碱、纯碱 B、混合物:生铁、空气、赤铁矿 C、合成材料:塑料、合金、合成橡胶 D、有机物:二氧化碳、酒精、葡萄糖
-
12、食在广东,名不虚传,以下过程中不包含化学变化的是A、
 烤制脆皮烧鹅
B、
烤制脆皮烧鹅
B、 粉浆蒸制肠粉
C、
粉浆蒸制肠粉
C、 捶打牛肉
D、
捶打牛肉
D、 蒸制叉烧包
蒸制叉烧包
-
13、
可用于冷冻剂、干燥剂、融雪剂、医药及冶金工业等。化学兴趣小组在完成实验室制取二氧化碳的实验后,欲对剩余废液的组成进行探究,并制定回收的方案。
【提出问题】实验室制取二氧化碳后的废液中含有哪些溶质?
【猜想与假设】猜想一:;
猜想二:和。
【查阅资料】溶液呈中性
【探究活动一】取少量废液等分成2份,甲、乙两组同学分别利用其中一份进行如下探究:
(1)甲组同学向废液中滴加紫色石蕊溶液,溶液变成________色,证明猜想二成立。
乙组同学用图1装置进行实验,将一定质量分数的碳酸钠溶液逐滴加入废液,测得数据如图2。

【数据分析】乙组同学对图2数据进行讨论分析,证明猜想二成立。
(2)a点的实验现象为________。
(3)b点发生反应的化学方程式为________。
(4)c点对应溶液中全部溶质的化学式为________。
【探究活动二】
(5)丙组同学提出直接蒸发溶剂可从剩余废液中回收纯净 , 理由是________。
【交流与反思】
(6)甲组同学认为丙组同学提出的方法会对空气造成污染。在不借助其他试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面___________(填选项序号)试剂。
A. Ca B. C. D. -
14、某同学用图甲装置验证质量守恒定律。
 (1)、将图甲中的两种溶液混合,观察到的现象,证明两者发生了化学反应,且天平 , 可验证质量守恒定律。(2)、仅利用图甲的器材,可继续验证质量守恒定律的实验是_____。A、冰融化成水 B、铜丝和硝酸银溶液反应(3)、该同学以电解水为例,用图乙从分子和原子的角度解释质量守恒定律的微观本质,请你帮他补充完整。
(1)、将图甲中的两种溶液混合,观察到的现象,证明两者发生了化学反应,且天平 , 可验证质量守恒定律。(2)、仅利用图甲的器材,可继续验证质量守恒定律的实验是_____。A、冰融化成水 B、铜丝和硝酸银溶液反应(3)、该同学以电解水为例,用图乙从分子和原子的角度解释质量守恒定律的微观本质,请你帮他补充完整。 -
15、如图为a、b、c三种固体物质在水中随温度变化的溶解度曲线,按要求填空。
 (1)、P点含义是。(2)、时,a、b、c物质的溶解度大小关系为。(3)、时,将50 g a加到50 g水中充分溶解,所得溶液的质量为g。
(1)、P点含义是。(2)、时,a、b、c物质的溶解度大小关系为。(3)、时,将50 g a加到50 g水中充分溶解,所得溶液的质量为g。 -
16、海上超级充电宝——“南鲲”号
2023年6月,我国自主研发的首台兆瓦级漂浮式波浪能发电装置“南鲲”号,在广东省珠海市投入试运行。
“南鲲”号采用“三边形”的设计,这样的设计可以使装置接受各个方向的海浪冲击,做到最大化吸收和利用波浪能。整套装置包括半潜平台、液压系统、发电系统、控制系统以及锚泊系统,利用半潜平台“吸收”波浪,再通过电能变换系统,从而实现从波浪能到液压能再到电能的三级能量转换。
波浪能作为一种蕴含在海洋中的可再生能源,因其可再生性和绿色环保的优点,已成为一种亟待开发的新能源。“南鲲”号的试运行标志着我国波浪能发电技术水平又上了一个大台阶。
 (1)、“南鲲”号采用“三边形”设计的优点是。(2)、电能变换系统的能量转化方式是→液压能→电能。(3)、与煤、石油等传统能源相比,波浪能的优点是。(写一条)
(1)、“南鲲”号采用“三边形”设计的优点是。(2)、电能变换系统的能量转化方式是→液压能→电能。(3)、与煤、石油等传统能源相比,波浪能的优点是。(写一条) -
17、化学的繁荣发展是无数科学家共同努力的结果。学好化学能让我们更好地理解生活中的一些现象和解决生产生活中的实际问题。完成下面小题。(1)、无数科学家为化学的发展作出了巨大贡献。
①张青莲测定的铟的相对原子质量被国际采用为新标准。下图为铟在元素周期表中的部分信息,铟的相对原子质量为。

②屠呦呦利用乙醚代替水从青蒿中提取出青蒿素,可推测青蒿素在乙醚中的溶解度(填“>”“<”或“=”)在水中的溶解度。
③史一安发明的“史氏环氧化反应”是世界有机催化发展史上的重要里程碑。史氏环氧化反应一般在弱碱性条件下进行。下列pH范围适宜的是(填序号)。
A.1~2 B.5~6 C.7~8 D.13~14
(2)、用所学的化学知识解释生活中的一些现象。①李白的草书《上阳台帖》能保存至今,原因是。
②锁芯因生锈转动不灵活,可以向其中加入铅笔芯粉末,这是因为铅笔芯的主要成分(填物质名称)有滑腻感。
③新买的汽车车内通常都有异味,人们会买一些活性炭包放在车中消除异味,这一做法体现了活性炭的。
(3)、我国八大高粱名酒之一古井贡酒产自安徽亳州,古井贡酒以当地优质高粱为原料,用大麦、小麦和豌豆制成中温大曲,取古井泉水酿制而成。其简要工艺如图:
回答下列问题:
①将高粱粉碎的目的是。
②“蒸料”时可以用木炭作为燃料,其充分燃烧的化学方程式为。
③“蒸馏”时乙醇会先一步蒸出,说明乙醇的沸点(填“大于”或“小于”)水的沸点。
-
18、水是一切生命之源。下列有关水的说法中正确的是A、地球上的总水储量很大,所以不需要节约用水 B、水和冰块混合得到混合物 C、水是一种最常用的溶剂 D、生活中可以通过过滤降低水的硬度
-
19、下列做法有利于实现“碳达峰、碳中和”的是A、发展火力发电 B、积极植树造林 C、开采化石燃料 D、露天焚烧垃圾
-
20、2024年4月,我国搭载了神舟十八号载人飞船的火箭发射成功。化学为航空航天领域的发展提供了强有力的支撑。完成下面小题。(1)、火箭的成功发射凝聚了科学家们的心血。优秀的科学工作者需要具备严谨求实的科学态度。下列行为与之不符的是A、熟悉实验流程,避免安全事故 B、遵守实验规则,规范实验操作 C、认真观察记录,重视异常现象 D、追求个人私利,剽窃他人成果(2)、液氢是常用的火箭燃料。下列从微观角度对氢气液化过程的分析,正确的是A、分子体积变大 B、分子数目减少 C、分子间隔变小 D、分子质量增大(3)、钛合金常用于制作载人飞船的某些部件。结合已有知识和图信息判断,下列说法错误的是
 A、将钛单质制成合金后,硬度增大 B、图中x的数值为+4 C、Ti2O3在图中对应的点是b点 D、工业制取图中a点对应物质的化学方程式为(4)、宇航员在太空中钙质流失严重,需要补钙。如图是某钙片标签的部分信息,下列说法正确的是
A、将钛单质制成合金后,硬度增大 B、图中x的数值为+4 C、Ti2O3在图中对应的点是b点 D、工业制取图中a点对应物质的化学方程式为(4)、宇航员在太空中钙质流失严重,需要补钙。如图是某钙片标签的部分信息,下列说法正确的是碳酸钙D3片
【成分】碳酸钙(CaCO3)、维生素D3等。
【规格】每片含碳酸钙0.75g。
【用法用量】口服,咀嚼后咽下。
成人:一次2片,一日1次,儿童酌量。
A、服用钙片可预防甲状腺肿大 B、碳酸钙由3种元素组成 C、碳酸钙的相对分子质量是100g D、按用量服用,成人每天从钙片中摄取钙元素的质量为0.3g