相关试卷
-
1、劳动实践中遇到的某些问题可用化学知识解决。下列选用的方法中错误的是
选项
劳动中出现的问题
解决方法
A
劳动工具生锈
用稀硫酸可以除锈
B
菠菜叶片整体发黄
可以施用钾肥
C
浇菜用的水中沙土太多
用纱布进行过滤
D
土壤酸性过强
用熟石灰进行中和
A、A B、B C、C D、D -
2、将55gKNO3固体加入50g水中充分溶解,测得溶液的质量随温度的变化曲线如下图所示,以下说法正确的是
 A、a点对应KNO3的不饱和溶液 B、KNO3溶解度随温度上升而减小 C、b和c两点对应溶液溶质质量分数不同 D、30℃时KNO3的溶解度为45.8g
A、a点对应KNO3的不饱和溶液 B、KNO3溶解度随温度上升而减小 C、b和c两点对应溶液溶质质量分数不同 D、30℃时KNO3的溶解度为45.8g -
3、下列符合实验操作要求的是A、边称量KNO3固体边吃零食 B、直接用手触摸溶液感知温度变化 C、操作时穿实验服并戴护目镜 D、实验后将剩余废液倒入下水道
-
4、均衡膳食能促进身体健康,在下列膳食搭配中,合理的选择是A、米饭、猪肉、鱼、鸡肉 B、米饭、瘦肉、鸡蛋、黄瓜、青菜 C、馒头、稀饭、鸡蛋、牛肉 D、玉米、白菜、青菜、萝卜
-
5、下列化学用语正确的是A、生石灰Ca(OH)2 B、氧化铁FeO C、纯碱Na2CO3 D、氯化铝AlCl2
-
6、薄荷素油的有效成分之一是薄荷醇,化学式为C10H20O,可用作香水等的赋香剂,关于薄荷醇的说法正确的是A、碳原子、氢原子和氧原子构成 B、属于氧化物 C、碳元素的质量分数最大 D、燃烧后产物中不可能有CO
-
7、智慧化学兴趣小组尝试自制薄荷素油并使用了如图所示装置,以下过程涉及化学变化的是
 A、采摘薄荷叶 B、清洗薄荷叶 C、粉碎薄荷叶 D、蒸馏获得薄荷素油
A、采摘薄荷叶 B、清洗薄荷叶 C、粉碎薄荷叶 D、蒸馏获得薄荷素油 -
8、薄荷素油具有可燃性,以下适合在薄荷素油生产车间张贴的警示标识为A、
 B、
B、 C、
C、 D、
D、
-
9、化学实验课上,老师要求各小组同学配制一定溶质质量分数的氢氧化钠溶液并测定其酸碱度。下列展示的部分操作中,正确的是A、
 称量
B、
称量
B、 量取
C、
量取
C、 溶解
D、
溶解
D、 测定
测定
-
10、氢气是清洁能源。硼氢化钠(NaBH)作为一种环境友好的固体储氢材料,可与水反应生成氢气,化学方程式为NaBH4+2H2O=NaBO2+4H2↑。(1)、氢气被称为清洁能源的原因是(2)、某工厂生产燃料电池需要12t氢气,理论上需要NaBH4的质量是多少(写出计算过程)?
-
11、学习了“常见的酸、碱、盐”后,某化学兴趣小组为探究NaHCO3和NaOH的性质,设计并进行了如下实验。
【实验一】探究NaHCO3固体的稳定性
该小组用下图所示装置进行实验。
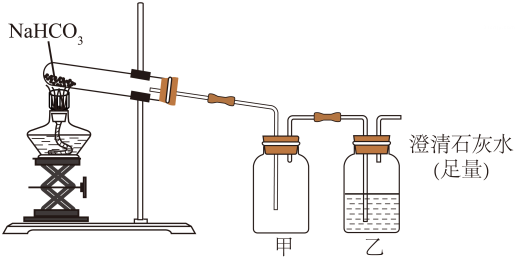 (1)、实验进行一段时间后,观察到甲中(填实验现象)时,证明有水生成;乙中澄清石灰水变浑浊,原因是(用化学方程式表示)。(2)、实验结论:NaHCO3固体受热能分解。
(1)、实验进行一段时间后,观察到甲中(填实验现象)时,证明有水生成;乙中澄清石灰水变浑浊,原因是(用化学方程式表示)。(2)、实验结论:NaHCO3固体受热能分解。【实验二】探究NaHCO3溶液的酸碱性
取少量NaHCO3溶液于试管中,向其中滴加1~2滴酚酞溶液,溶液变为浅红色。
实验结论:NaHCO3溶液呈性。
(3)、【实验三】探究NaHCO3溶液的稳定性常温下,在密闭容器(如右图)中放入盛有100mL蒸馏水的烧杯,开启CO2传感器,测得容器内CO2浓度基本不变;将蒸馏水换成100mLNaHCO3的稀溶液,开启CO2传感器,测得容器内CO2浓度增大。

用100mL蒸馏水做实验的目的是
(4)、实验三的结论是(5)、【实验四】数字化实验探究NaOH的性质常温下,取一定量的NaOH溶液,分成两等份。
向一份NaOH溶液滴入稀盐酸,用pH传感器测定该过程中的pH变化,测定结果如图曲线M。
向另一份NaOH溶液先通人一定量的CO,充分反应后得到溶液X。再向溶液X中滴入相同质量分数的稀盐酸,同时用pH传感器测定pH变化,得到pH随盐酸体积(mL)变化曲线N(未在图坐标系中画出)。

溶液X的pH(填“大于”“小于”或“等于”)A点的pH。
(6)、曲线N上横坐标为10时,对应溶液中的溶质是(填化学式)。 -
12、纳米氧化锌是一种新型高功能材料。工业上利用锌浸出液(主要含ZnSO4、CuSO4 , 和CdSO4等)通过水热法制备纳米氧化锌,主要流程示意图如下:

已知:金属活动性顺序为Zn>Cd(镉)>Cu。
回答下列问题:
(1)、锌浸出液需先加酸调节pH,适宜加入的酸是(填“稀盐酸”或“稀硫酸”)。(2)、锌粉除铜、镉比锌粒效果好的原因是 , 除铜反应的化学方程式为(3)、锌粉除铜、镉的试验结果如右图所示。增加锌粉用量,铜的去除率不变,镉的去除率上升的原因是(4)、水热合成后,“反应器2”中的混合物经(填操作名称)、洗涤、干燥得到产品。
-
13、小明和小安同学在实验室选用下列装置制取并收集氧气。
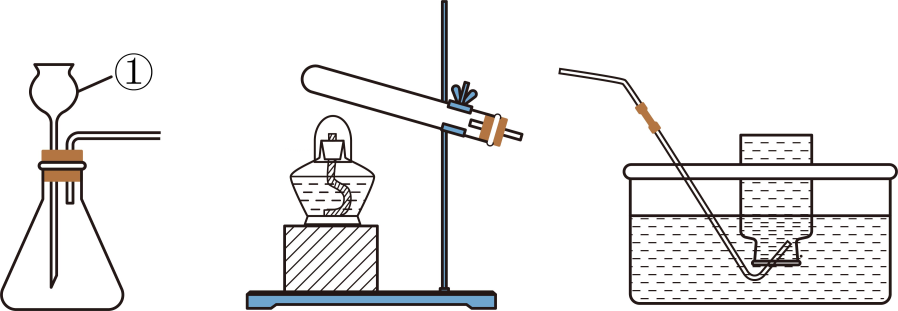
回答下列问题:
1.小明同学使用H2O2溶液进行实验。
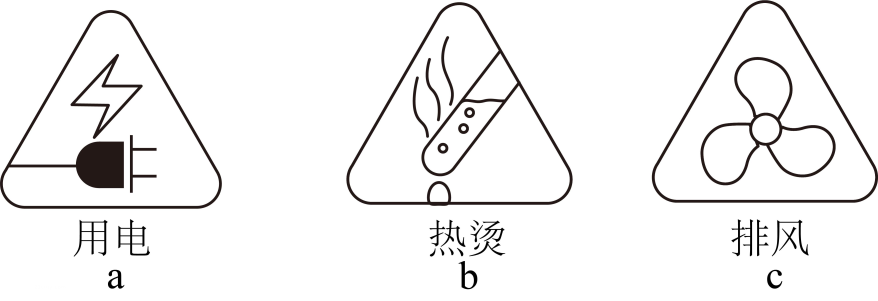
(1)、仪器①的名称是(2)、反应的化学方程式为(3)、II.小安同学使用KMnO4固体进行实验。在实验方案中,下列图标需要标注的是(填字母序号,下同)。
 (4)、向试管中加入KMnO4正确的操作是
(4)、向试管中加入KMnO4正确的操作是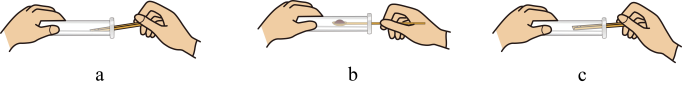 (5)、氧气收集完毕,将导管从水槽中取出,再熄灭酒精灯的原因是
(5)、氧气收集完毕,将导管从水槽中取出,再熄灭酒精灯的原因是 -
14、蛋雕是一种非物质文化遗产。某项目式学习小组开展了制作“蛋雕”的活动。实施过程如下:

回答下列问题:
(1)、”蛋壳裹蜡”是将蛋壳浸没在熔化的石蜡液中,然后取出、冷却,形成厚度适宜的石蜡保护层。此过程属于变化(填“化学”或“物理”)。(2)、蛋壳的主要成分为(填化学式)。小组同学在“蜡上作画”后,可选用(填“白醋”或“食盐水”)腐蚀蛋壳。(3)、石蜡一般在50~70℃熔化,“去除蜡衣”的合理方法是(填字母序号)。a.用砂纸打磨
b.用酒精灯火焰直接加热
c.置于80℃的热水中
(4)、作品完成后,合理处理使用过的石蜡的方法有(写出1点即可)。 -
15、科学家发明了一种利用二氧化碳的新技术:。在密闭容器中加入CO2和H2模拟该反应,反应物的总质量、各生成物的质量随时间变化如右图所示。下列说法正确的是( )
 A、M=0.28 B、X 的化学式为 CH4 C、反应前后分子种类不变 D、容器中碳、氧元素的质量比为1:2
A、M=0.28 B、X 的化学式为 CH4 C、反应前后分子种类不变 D、容器中碳、氧元素的质量比为1:2 -
16、不同温度下硝酸钾的溶解度如下表所示:
温度/℃
20
40
60
80
溶解度/g
31.6
63.9
110
169
60℃时,将31.6g硝酸钾固体溶于100g水中得到溶液。下列关于该溶液的说法正确的是( )
A、溶质的质量分数为31.6% B、再加入31.6g硝酸钾固体,不能继续溶解 C、冷却到20℃,变为饱和溶液 D、升温到80℃,溶质的质量分数增大 -
17、由下列实验操作和现象,得出的结论正确的是( )
选项
实验操作和现象
结论
A
将黄铜片和铜片互相刻画,铜片上出现划痕
铜的硬度大于黄铜
B
取一小片氢氧化钠固体放在表面皿上,放置一会儿,固体表面变潮湿
氢氧化钠易潮解
C
向硫酸铜溶液中滴加某溶液,产生蓝色沉淀
该溶液一定含氢氧化钾
D
向充满二氧化碳的质地较软塑料瓶中加入一定量的水,立即旋紧瓶塞、振荡,塑料瓶变瘪
二氧化碳与水发生了化学反应
A、A B、B C、C D、D -
18、压电式打火机的工作示意图如下。按下按钮,液态丁烷迅速汽化,同时压电陶瓷工作产生高温,丁烷被点燃。下列说法错误的是( )
 A、打火机工作时涉及多种能量转化 B、打火机外壳用的塑料是一种天然高分子材料 C、压电陶瓷工作使温度达到丁烷的着火点 D、生活中应避免打火机受到外力撞击
A、打火机工作时涉及多种能量转化 B、打火机外壳用的塑料是一种天然高分子材料 C、压电陶瓷工作使温度达到丁烷的着火点 D、生活中应避免打火机受到外力撞击 -
19、阅读下列材料,完成问题。
元素周期表中原子序数57~71的元素以及航(Sc)和钇(Y),它们的性质相似,在科技、生产中有广泛的用途。钆(Gd)被誉为“世界上最冷的金属”。掺杂了Gd2O3的Cu可高效催化甲醇(CH3OH)与水的反应,其微观示意图如下:
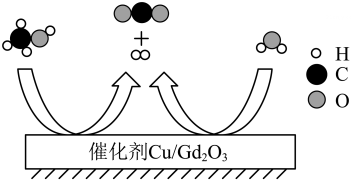 (1)、有关该反应的说法中,正确的是( )A、甲醇含有4个氢原子 B、两种反应物均属于氧化物 C、反应前后催化剂的质量不变 D、属于置换反应(2)、右图为元素周期表中钱元素的信息。下列说法错误的是( )
(1)、有关该反应的说法中,正确的是( )A、甲醇含有4个氢原子 B、两种反应物均属于氧化物 C、反应前后催化剂的质量不变 D、属于置换反应(2)、右图为元素周期表中钱元素的信息。下列说法错误的是( )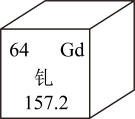 A、Gd 属于金属元素 B、Gd与Y的性质相似 C、Gd 的相对原子质量为157.2 g D、Gd2O3中Gd 的化合价为+3价
A、Gd 属于金属元素 B、Gd与Y的性质相似 C、Gd 的相对原子质量为157.2 g D、Gd2O3中Gd 的化合价为+3价 -
20、下列劳动实践与所述化学知识没有关联的是( )
选项
劳动实践
化学知识
A
晾晒湿衣服
水在一定条件下可发生分解反应
B
擦干洗净后的铁锅
铁在潮湿的空气中易生锈
C
用活性炭等自制净水器
活性炭具有吸附性
D
给劳动基地的蔬菜施用尿素
尿素是一种化肥
A、A B、B C、C D、D