相关试卷
-
1、对下列实验中的水,其解释没有体现水的主要作用的是A、用红磷测定空气中氧气含量时,集气瓶中的水:更快地吸收白烟 B、铁丝在氧气中燃烧,集气瓶中的水:防止生成物污染空气 C、硫粉在氧气中燃烧时,集气瓶中的水:降温、吸收二氧化硫气体 D、排水法收集氧气,集气瓶中的水:排出集气瓶内的空气
-
2、电能是电气时代不可或缺的二次能源。下列发电方式中,利用了化学能源的是A、水力发电 B、风力发电 C、燃煤发电 D、太阳能发电
-
3、近年用红外激光技术研究液氢,发现液氢中含有。则属于A、单质 B、分子 C、原子 D、离子
-
4、下列属于纯净物的是A、洁净空气 B、纯牛奶 C、桂江河水 D、液态氮气
-
5、下列实验操作中,正确的是( )A、取用粉末药品
 B、点燃酒精灯
B、点燃酒精灯 C、闻气味
C、闻气味 D、验满氧气
D、验满氧气
-
6、中国天宫空间站三名航天员每日需要 , 固体燃料氧气发生器制氧,是航天员安全可靠的供氧途径之一。向氧气发生器加入粉末状的铁粉和氯酸钠();点燃铁粉,铁粉剧烈燃烧,放出大量的热,受热分解为NaCl和。(1)、氯酸钠受热分解所需的能量来自于;(2)、三名航天员4天所需共9.6kg,则理论上至少需要加热分解的质量为多少?(的相对分子质量为106.5,列出化学方程式写出完整过程计算)
-
7、某实验小组对净化水的各种方法进行实验,把收集到的一瓶浑浊的河水最终制成蒸馏水。其实验过程如图所示,请回答以下问题:
 (1)、A物质的作用是。(2)、操作①为过滤,进行该操作时用到铁架台、玻璃棒、烧杯、等仪器,其中玻璃棒的作用是。若经过操作①得到的液体C仍然浑浊,其原因可能是(填字母序号)。
(1)、A物质的作用是。(2)、操作①为过滤,进行该操作时用到铁架台、玻璃棒、烧杯、等仪器,其中玻璃棒的作用是。若经过操作①得到的液体C仍然浑浊,其原因可能是(填字母序号)。a.漏斗内的滤纸破损 b.漏斗下端未紧靠烧杯内壁 c.漏斗内液面高于滤纸边缘
(3)、操作②的目的是除去水中的异味、色素,则应选用的物质是。(4)、操作③为蒸馏,在烧瓶中加入几粒沸石或碎瓷片的目的是化。 -
8、某化学兴趣小组以“气体制备”为主题开展项目式学习。根据如图回答有关问题:
 (1)、课堂分组实验:实验室制取氧气
(1)、课堂分组实验:实验室制取氧气Ⅰ.写出标号a仪器的名称。
Ⅱ.用加热高锰酸钾的方法制取较纯净的氧气,可以选用的发生和收集装置为(填序号),反应的化学方程式为。
(2)、家庭小实验:家庭简易制氧机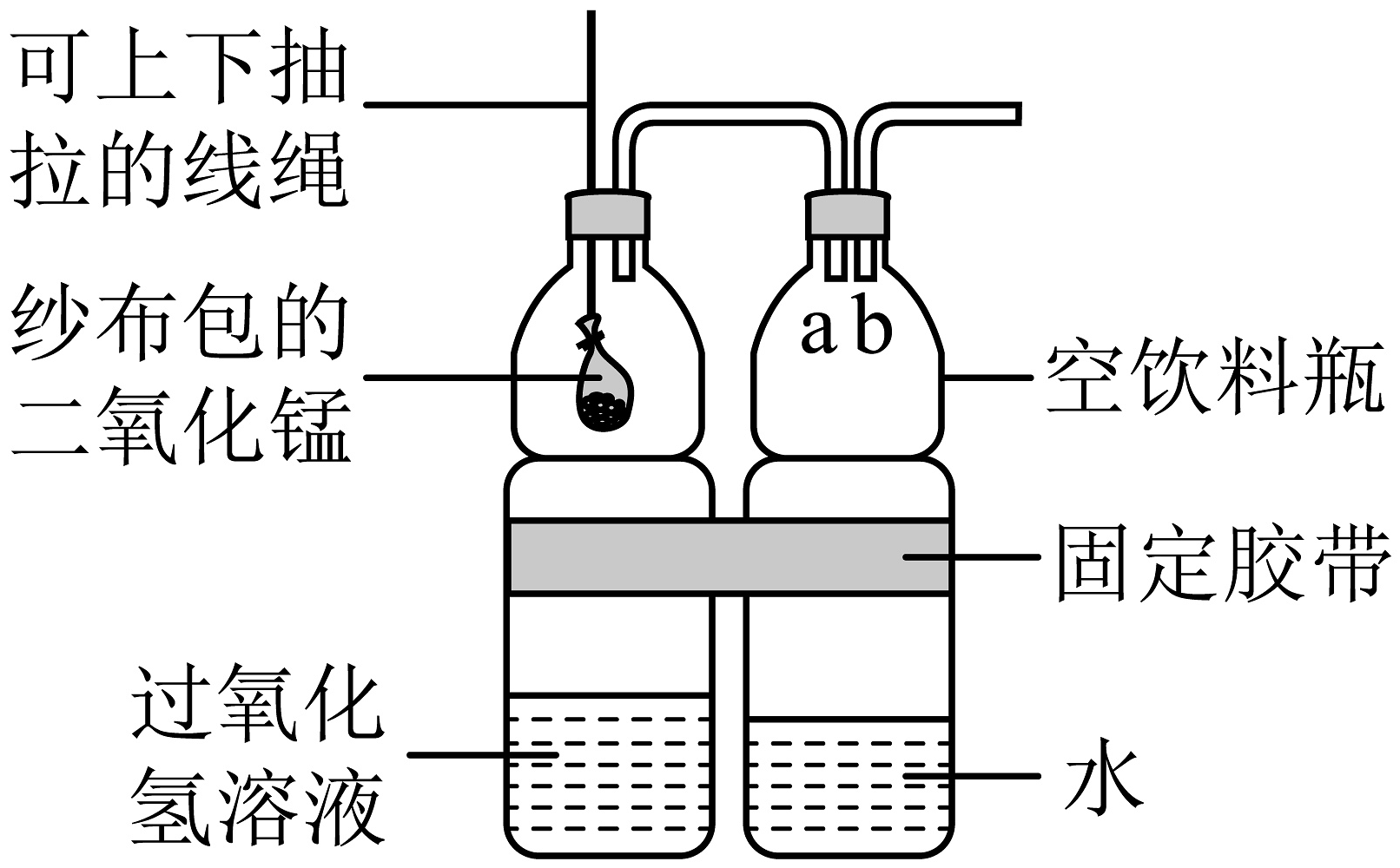
Ⅰ.根据过氧化氢分解产生氧气原理,兴趣小组在家完成家庭简易制氧机。相较实验室制取氧气,简易制氧机设计的可以通过拉动线绳实现二氧化锰与过氧化氢溶液的接触与分离,从而达到的目的,体现实验设计的优点。
Ⅱ.为了弥补装置的不足,更好地监测氧气的流速,同学们发现可将装置中右侧饮料瓶中(填“a”或“b”)端导管延长伸入水面以下。
-
9、阅读科普短文,回答下列问题:
镁(Mg)是一种年轻的金属,1808年英国化学家戴维用电解法最早制得少量的镁。
镁呈银白色,熔点为649℃,质轻、密度为。镁的化学性质活泼,能与许多物质发生化学反应,镁在氧气中燃烧生成氧化镁,镁在氮气中燃烧生成氮化镁,镁在二氧化碳中燃烧生成碳和氧化镁。工业上主要利用电解熔融的氯化镁制取金属镁,同时生成氯气。
烟花和照明弹里都含有镁粉,是利用了镁在空气中燃烧能发出耀眼的白光,金属镁与战争有着密切的关系,除照明弹里有镁粉外,燃烧弹里也装有镁粉。每架飞机的外表是用耗费近半吨镁的铝镁合金制成的。世界上镁产量最高的年份,往往就是发生战争的年份。因此,镁产量就成了战争的晴雨表和指示剂,人们常把镁称为“国防金属”。
(1)、镁与第9号元素形成的化合物的化学式是。(2)、镁原子和镁离子本质区别。(3)、写出镁在二氧化碳中燃烧的化学方程式。(4)、在测定空气中氧气含量的实验中,不能用镁代替红磷,其原因是。 -
10、建构模型是学习化学的重要方法,下列模型错误的是
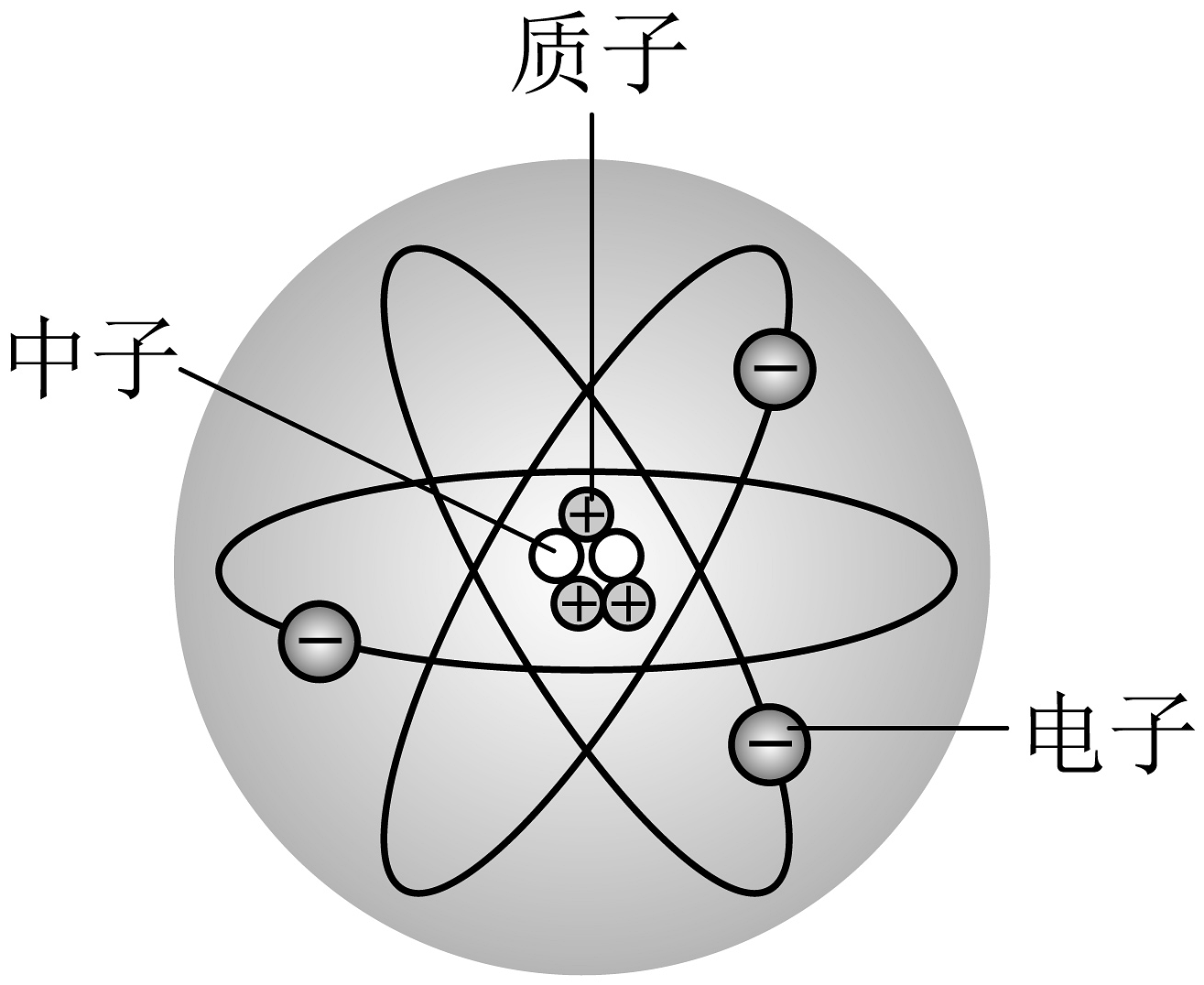



A.原子的结构
B.物质的分类
C.空气的组成
D.反应类型的关系
A、A B、B C、C D、D -
11、下列归类正确的是
选项
归类
物质
A
可直接加热的仪器
烧杯、试管、燃烧匙
B
常见的单质
氮气、氨气、液态氧
C
电中性的微观粒子
原子、中子、水分子
D
常见的氧化物
高锰酸钾、五氧化二磷、氧化铁
A、A B、B C、C D、D -
12、阅读下列材料,完成下列小题。
杭州亚运会开幕式主火炬的燃料——“零碳甲醇(CH3OH)”备受瞩目,这是全球首次对“零碳甲醇”的实践应用。目前,该燃料已广泛应用在船舶、汽车等领域。“零碳甲醇”是利用焦炉气中的副产品氢气和从工业尾气中捕捉的二氧化碳在一种纳米催化剂的作用下反应得到的,其微观示意图如图。

有关该反应的说法,正确的是
A、反应物均为单质 B、丁的化学式为H2O C、参加反应的甲与乙的质量比为3∶1 D、反应前后“纳米催化剂”的性质不变 -
13、生活中的现象,用分子的相关知识解释不正确的是A、湿衣服在日照下比在阴暗处干的更快,说明分子的运动速率与温度有关 B、成熟的香蕉会散发出浓浓的香味,说明分子在不断的运动 C、水沸腾时,掀开壶盖,说明分子的大小随温度的升高而增大 D、液化石油气经加压后贮存在钢瓶中,说明分子之间有间隔
-
14、2024年世界环境日中国主题是“全面推进美丽中国建设”。全面践行“绿水青山就是金山银山”这一理念,下列做法符合这一理念的是A、节假日燃放烟花爆竹增加节日气氛 B、提倡绿色出行,大力发展公共交通 C、生活污水直接排入河道 D、垃圾分类投放,并露天焚烧
-
15、远到恒星、行星,近到树木、花草,物质世界一刻不停地发生着变化。下列过程发生了化学变化的是
①烘烤食物 ②钢铁生锈 ③头发长长 ④酒精挥发 ⑤石蜡熔化 ⑥牡丹开花 ⑦铁铸成铁锅
A、①②④⑥ B、①②③⑥ C、①②③④⑤⑥ D、①②③④⑤⑥⑦ -
16、水杨酸的化学式为C7H6O3 , 常用于制备阿司匹林。请根据其化学式回答下列问题:(1)、水杨酸中氢元素与氧元素的质量比是。(2)、13.8g水杨酸中含有氧元素的质量是g。
-
17、实验室常用如图装置来制取氧气:
 (1)、用双氧水和二氧化锰制取氧气时,可选用的发生装置是(填字母);该反应的符号表达式。(2)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。制取甲烷的发生装置可选用 , 收集干燥的甲烷可选用 , F装置可收集和储存甲烷,若用水将装置中的甲烷排出,水应从(填a或b)端通入。
(1)、用双氧水和二氧化锰制取氧气时,可选用的发生装置是(填字母);该反应的符号表达式。(2)、实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。甲烷的密度比空气小,不溶于水。制取甲烷的发生装置可选用 , 收集干燥的甲烷可选用 , F装置可收集和储存甲烷,若用水将装置中的甲烷排出,水应从(填a或b)端通入。 -
18、如图是水电解实验示意图
 (1)、该实验使用的电源应是(填交流电或直流电):A连接电源的极。(2)、做该实验往往在水中加入少量的氢氧化钠和稀硫酸的目的是。(3)、观察到的现象是。(4)、通过该实验可以得出的结论是。(任写一条)(5)、该反应的符号表达式是。
(1)、该实验使用的电源应是(填交流电或直流电):A连接电源的极。(2)、做该实验往往在水中加入少量的氢氧化钠和稀硫酸的目的是。(3)、观察到的现象是。(4)、通过该实验可以得出的结论是。(任写一条)(5)、该反应的符号表达式是。 -
19、如图是某学生绘制的元素周期表的一部分:

请根据相关信息与知识回答:
(1)、氦、氖、氩等稀有气体的化学性质很不活泼,其原因是;(2)、原子序数为13的元素的原子失去电子后形成离子是(粒子符号);(3)、在同一族中,各元素的原子结构呈现的规律有(任写一点)。 -
20、用化学符号填空:(1)、地壳中含量最多的元素:;(2)、氩气:;(3)、2个氮原子:;(4)、高锰酸钾制取氧气表达式:;(5)、氧化镁中镁元素的化合价:;(6)、2个碳酸根离子:;