相关试卷
-
1、下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )A、 B、 C、 D、
-
2、下列离子方程式错误的为( )A、大理石与盐酸反应: B、氢氧化钠与硝酸反应: C、小苏打溶液与石灰水反应: D、铜片与硝酸银溶液反应:
-
3、下列反应能用表示的是( )A、 B、 C、 D、
-
4、下列离子在溶液中能大量共存的是( )A、 , , 、 B、、、、 C、、 , 、 D、 , , ,
-
5、下列属于电解质的是( )A、 B、饱和食盐水 C、 D、
-
6、下列电离方程式书写不正确的是( )A、 B、 C、 D、
-
7、下列物质间所示的转化能一步实现的是( )A、 B、 C、 D、
-
8、分类法是学习和研究化学的一种重要方法。下列关于的分类不正确的是( )A、氧化物 B、钠盐 C、碳酸盐 D、正盐
-
9、某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应。你认为相连环中物质间发生的反应中没有涉及的基本反应类型是( )
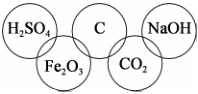 A、化合反应 B、分解反应 C、置换反应 D、复分解反应
A、化合反应 B、分解反应 C、置换反应 D、复分解反应 -
10、2023年第19届杭州亚运会呈现了一届“中国特色、浙江风采、杭州韵味、精彩纷呈”的体育文化盛会。下列亚运会事项中发生化学变化的是( )A、开幕式燃放数字烟花 B、播放具有感染力的音乐 C、机械狗运送铁饼 D、汪顺和数字人共同点燃主火炬
-
11、研究化学反应中的能量和速率变化对生产、生活有着重要意义。(1)、I.某些常见化学键的键能(将气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
完全燃烧生成和气态水放出的能量为kJ。该反应中反应物的总能量(填“>”、“<”或“=”)生成物的总能量。化学键
键能/()
414
803
463
498
(2)、II.实验室模拟热气循环法合成尿素,与在一定条件下发生反应:。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
实验编号
初始浓度/()
初始浓度/()
催化剂的比表面积/()
①
280
82
②
③
350
a
82
控制变量是科学研究的重要方法,因此表中数据: , 。
(3)、对比实验①③,目的是验证(填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。(4)、一定温度下,向1L密闭容器中充入和发生反应: , 若起始压强为 , 反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内, , 的平衡转化率为%。(5)、下列情况中,一定能说明上述反应达到平衡的是____(填标号)。A、的体积分数保持不变 B、反应体系中气体的密度保持不变 C、反应消耗 , 同时生成 D、的质量保持不变(6)、“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到时,电路中转移的电子的物质的量为mol。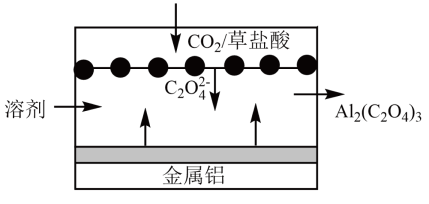
-
12、宏观辨识与微观探析是化学学科核心素养之一、根据所学知识,回答下列问题:(1)、拟卤离子主要有、、 , 性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。
①已知还原性; , 写出酸性条件下加热时,和KSCN(aq)反应的离子方程式:。
②与水反应生成的含氧酸的结构式为。氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰()废水,含氰废水中加入足量的 , 发生反应的离子方程式为。理论上处理含氰废水(含),需要消耗g(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:。
(2)、酒精仪中酸性重铬酸钾(稀硫酸酸化)可将乙醇氧化成乙酸,本身被还原成。写出该反应的离子方程式:;在该反应中还原剂是(填化学式)。氧化23g乙醇时转移电子的物质的量为。(3)、和都属于离子型化合物,前者跟水反应生成和 , 写出跟水反应的化学方程式:。 -
13、生物地球氮化学循环模式图的一部分如图,请根据所学知识回答问题。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。
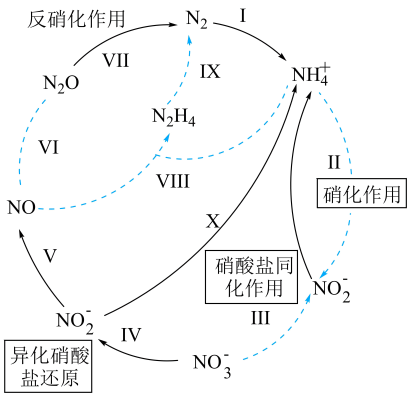 (1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。
(1)、属于氮的固定的是(填标号)。(2)、利用如图装置可以制备、检验和收集NO。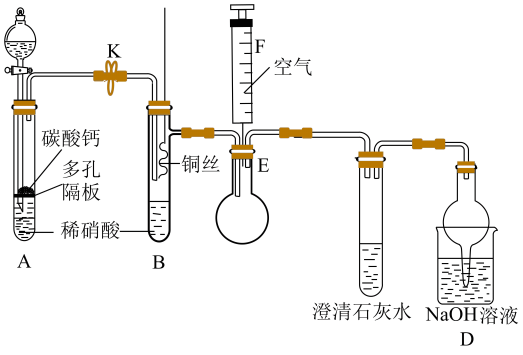
①实验前先打开开关K通入一段时间,其目的是。采用抽拉铜丝与稀硝酸反应的优点为。
②检验生成的气体为NO的操作是。
③装置D的作用是。
(3)、NO与反应生成的离子方程式为 , 该反应中氧化产物与还原产物的物质的量之比为。(4)、写出铵根经硝化作用直接转化为硝酸根的离子方程式: , 铵根浓度或pH过大,都会使硝化作用减弱的可能原因为。 -
14、主族元素A、B、C、D、E、F、G、H在元素周期表中的相对位置如图所示。已知上述8种元素的原子最外层电子数之和等于47,C与H的质子数之和为43.请回答下列问题:
A
B
C
D
E
F
G
H
(1)、G在元素周期表中位于第周期第族。(2)、在C、D、G的最简单氢化物中,最不稳定的是(填化学式),常温下,B的最简单氢化物的水溶液的pH(填“>”、“<”或“=”)7.(3)、单质A(填“能”或“不能”)与B的最高价氧化物对应的水化物的浓溶液发生反应。(4)、E的简单氢化物通入胆矾溶液中,产物含红色单质和两种最高价含氧酸,该反应的离子方程式为。(5)、3molF单质通入热KOH溶液中完全反应,共转移5mol电子。在该反应中,氧化剂与还原剂的质量之比为。(6)、一定条件下,AC、BC和熔盐(能传导)能形成原电池(产物为无污染气体),其中负极通入的是(填化学式),正极的电极反应为。 -
15、某固体混合物可能由、、FeS、、、中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是( )
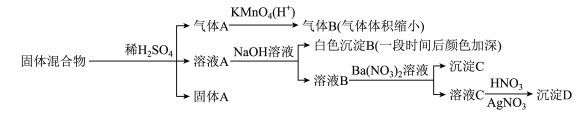 A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、
A、气体A中一定含有 B、固体A中一定含有S和 C、该固体混合物至少含和FeS中的一种 D、该固体混合物中一定含有、、 -
16、某温度下,在2L恒容密闭容器中加入3.0molX,发生反应 , 反应过程中有关数据如下表:
时间/min
0
5
10
15
20
25
Z的物质的量/mol
0
0.1
0.18
0.25
025
0.25
下列说法错误的是( )
A、5min时,Y的浓度为 B、0~10min内,Y的平均反应速率为 C、当容器内的值不变时,该反应达到平衡状态 D、当混合气体的密度不再改变时,该反应达到最大限度 -
17、由W、X、Y、Z四种原子序数依次增大的短周期主族元素组成的化合物M可作肥料,W、X、Y、Z分属三个短周期,其中X、Z位于同一主族,Y是地壳中含量最多的元素,且四种元素的原子序数之和为31,下列说法正确的是( )A、由W、X组成的某种化合物与水可形成分子间氢键 B、最简单氢化物的稳定性:X>Z>Y C、简单离子半径:X>Z>Y D、Z的最高价氧化物对应的水化物为二元强酸
-
18、下列实验操作或做法正确且能达到目的的是( )
选项
实验操作或做法
目的
A
向盛有固体的锥形瓶中滴加稀盐酸,产生无色气体
证明氯元素的非金属性强于硫元素
B
实验室将生成的乙酸乙酯导入饱和的溶液中,分液
使乙酸乙酯产品更加纯净
C
向2支盛有5 mL不同浓度溶液的试管中同时加入2 mL 5%的溶液,观察实验现象
探究浓度对反应速率的影响
D
向淀粉水解液中直接加入新制银氨溶液并水浴加热,未形成银镜
说明淀粉未发生水解
A、A B、B C、C D、D -
19、下列方程式正确的是( )A、向溴的四氯化碳溶液中通入乙烯,溶液褪色: B、向明矾溶液中加入过量氨水: C、用稀硝酸除去铜粉中的少量铁粉: D、向溴水中通入 , 溶液褪色:
-
20、属于钠的化合物,具有很强的氧化性。少量与溶液能发生如下反应:(方程式未配平),设为阿伏加德罗常数的值,下列说法错误的是( )A、1L 1 溶液含的数目为2 B、1mol 可制得的胶粒数为 C、78g 含有共价键的数目为 D、每生成1mol X,转移的电子数为