相关试卷
-
1、臭氧能氧化CN- , 故常被用来治理电镀工业中的含氰废水,其化学反应原理为下列说法正确的是( )A、O3和O2互为同位素关系 B、该反应是熵减的过程 C、该反应中,每生成1 mol N2转移6 mol电子 D、反应中所涉及的N2、O2为非极性分子,O3为极性分子
-
2、按照国家绿色发展规划,与化学化工相关的新质生产力涉及了“新能源”“绿色低碳” “新材料”等问题。下列有关说法错误的是( )
 A、潮汐能、波浪能、生物质能和氢能均属于新型能源 B、“绿色低碳”是指采用含碳量低的烃类作为燃料 C、如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 D、国产红旗轿车中部分材料采用了碳纤维,碳纤维属于新型无机非金属材料
A、潮汐能、波浪能、生物质能和氢能均属于新型能源 B、“绿色低碳”是指采用含碳量低的烃类作为燃料 C、如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想 D、国产红旗轿车中部分材料采用了碳纤维,碳纤维属于新型无机非金属材料 -
3、下列示意图或图示正确的是( )

A.HClO的空间填充模型
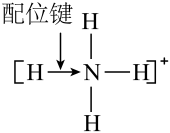
B.的结构式


C.HF分子间的氢键
D.丙氨酸的手性异构体
A、A B、B C、C D、D -
4、化学与生活、生产密切相关。下列叙述错误的是( )A、误服氯化钡应大量吞食牛奶、生蛋清,还应加服纯碱解毒 B、广泛pH试纸不能准确测得“84”消毒液的pH C、CO2排放量的增加将破坏海洋珊瑚礁(主要成分CaCO3)的生存 D、节日燃放烟花是利用金属的焰色试验,这与原子核外电子跃迁有关
-
5、有机化合物H是合成药物盐酸维拉帕米的重要中间体,其合成路线如下。

回答下列问题:
(1)、A分子中所含官能团的名称为 , D生成E的反应类型为。(2)、的结构简式为 , 则其化学名称是。 (3)、A~E中含有手性碳原子的化合物是(填序号)。化合物G中的C原子的杂化方式有种。(4)、化合物F的结构简式为。(5)、由C生成D的化学方程式为。(6)、仅含一种官能团的芳香化合物W是B的同分异构体,1molW能与2molNaOH溶液发生反应,W共有种(不考虑立体异构体),其中核磁共振氢谱有四组峰,且峰面积之比为6∶2∶1∶1的结构简式为(任写一种)。
, 则其化学名称是。 (3)、A~E中含有手性碳原子的化合物是(填序号)。化合物G中的C原子的杂化方式有种。(4)、化合物F的结构简式为。(5)、由C生成D的化学方程式为。(6)、仅含一种官能团的芳香化合物W是B的同分异构体,1molW能与2molNaOH溶液发生反应,W共有种(不考虑立体异构体),其中核磁共振氢谱有四组峰,且峰面积之比为6∶2∶1∶1的结构简式为(任写一种)。 -
6、近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。
. 在催化加氢制的反应体系中,发生的主要反应如下:
反应a:
反应b:
反应c:
(1)、已知反应b中相关化学键键能数据如下表:化学键
H-H
C=O
C≡O
H-O
x
803
1076
465
计算:x= , 。
(2)、恒温恒容时,下列能说明反应a一定达到平衡状态的是____(填标号)。A、 B、 C、混合气体的密度不再发生变化 D、混合气体中的百分含量保持不变(3)、在催化剂作用下,将物质的量之比为1:2的和的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 , , 、为速率常数,x为物质的量分数。①平衡时,转化率为60%,和的物质的量之比为1:1,若反应b的 , 则平衡。
②Arrhenius经验公式为 , 其中为活化能,T为热力学温度,k为速率常数,R和C为常数,则(用含、、T、R的代数式表示)。
(4)、其他条件相同时,反应温度对选择性的影响如下图所示。由图可知,温度相同时选择性的实验值略高于其平衡值,可能的原因是。(已知的选择性) (5)、 . 利用甲醇分解制取烯烃,涉及如下反应:
(5)、 . 利用甲醇分解制取烯烃,涉及如下反应:a.
b.
c.
恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时, , 平衡体系总压强为p,则650K反应c的平衡常数。

-
7、某研究小组模拟用硫酸化焙烧—水浸工艺从高砷铜冶炼烟尘中浸出铜、锌的流程如下。

已知:①高砷铜冶炼烟尘的主要化学成分为锌、铜、铅的砷酸盐及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与。各元素质量分数如下:
Cu
Zn
As
Pb
In
Ag
5.60%
15.60%
28.68%
2234%
0.073%
0.01%
②25℃时,硫酸铅的溶度积常数;
③浸出率的计算:浸出率。
回答下列问题:
(1)、基态Zn原子的价层电子排布式为。(2)、“焙烧”时,无烟煤除了为焙烧提供热量外,还表现的作用。请补全参与反应的化学方程式:。(3)、“水浸”时,所得浸渣的主要成分为(写化学式),往浸取液中加入的金属单质是(写化学式)。(4)、高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中为 , 请从理论上分析铅是否沉淀完全?(列式计算并得出结论)。(5)、铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用标准溶液滴定,滴定终点时消耗标准溶液21.00mL。(已知: , )
①滴定终点的现象为。
②忽略流程中的损失,可得铜的浸出率为。
-
8、(过碳酸钠)是一种集洗涤、漂白、杀菌于一体的氧化系漂白剂,是碳酸钠和过氧化氢形成的不稳定加合物,易溶于水,难溶于乙醇。制备相关资料如下。
制备装置:如图所示。

制备步骤:
i.按图组装仪器,控制实验温度不超过15℃;
ii.往A中加入25mL的过氧化氢(质量分数为30%)、硫酸镁和硅酸钠各0.1g,控温搅拌至所有试剂完全溶解;
iii.冷却至一定温度,加入100mL饱和碳酸钠溶液,搅拌反应30min,静置结晶;
iv.利用真空泵抽滤,滤饼用无水乙醇洗涤2~3次,通风橱风干得到产品过碳酸钠,滤液回收利用。
回答下列问题:
(1)、仪器A的名称为。(2)、制备过程中,为了避免温度升高,导致产率下降,“加入100mL饱和碳酸钠溶液”的正确方法是。(3)、步骤iv用无水乙醇洗涤的原因是。(4)、下列有关过碳酸钠说法错误的是____。A、过碳酸钠是一种混合物 B、过碳酸钠既具有碳酸钠的性质,又具有双氧水性质 C、往酸性高锰酸钾溶液中加入足量过碳酸钠,溶液褪成无色 D、过碳酸钠既可用作绿色漂白剂也可用作鱼塘供氧剂(5)、采用下列装置验证过碳酸钠中碳酸钠和过氧化氢的物质的量之比是2∶3(不考虑过碳酸钠含有杂质)。
①装置中的试剂为。
②装置接口的连接顺序为(用ABCDE字母表示)。
③若实验操作准确,则装置理论上应增重g。
-
9、赣南脐橙富含柠檬酸(用表示)。常温下,用溶液滴定溶液,滴定曲线如图所示。下列说法正确的是( )
(已知常温下柠檬酸的电离常数为: , , )
 A、a点溶液中: B、反应的平衡常数 C、b点溶液中, D、常温下,溶液加水稀释过程中,增大
A、a点溶液中: B、反应的平衡常数 C、b点溶液中, D、常温下,溶液加水稀释过程中,增大 -
10、(摩尔质量为)是生物医药、太阳能电池领域的理想荧光材料,其晶胞结构如图所示,A原子的分数坐标为。下列说法正确的是( )
 A、距离Cu最近的原子为In B、沿y轴投影可得晶胞投影图② C、晶胞中B原子分数坐标为 D、该晶体的密度为
A、距离Cu最近的原子为In B、沿y轴投影可得晶胞投影图② C、晶胞中B原子分数坐标为 D、该晶体的密度为 -
11、甲烷水蒸气重整制合成气[ ]是利用甲烷资源的途径之一、其他条件相同时,在不同催化剂(、、)作用下,反应相同时间后,的转化率随反应温度的变化如下图所示。下列说法错误的是( )
 A、该反应 B、平衡常数: C、催化剂催化效率: D、增大压强,增大倍数小于增大倍数
A、该反应 B、平衡常数: C、催化剂催化效率: D、增大压强,增大倍数小于增大倍数 -
12、二氧化氯(ClO2)是一种高效、安全的杀菌消毒剂。一种综合法制备ClO2的工艺流程及ClO2分子的结构(O-Cl-O的键角为117.6°)如图所示。

下列说法正确的是( )
A、Cl2与ClO2分子中所含化学键类型完全相同 B、ClO2分子中含有大π键(),Cl原子杂化方式为sp2杂化 C、“ClO2发生器”中,NaClO3的还原产物为Cl2 D、“电解”时,阳极与阴极产物的物质的量之比为3:1 -
13、利用可再生能源驱动耦合电催化HCHO氧化与CO2还原,同步实现CO2与HCHO高效转化为高附加值的化学产品,可有效消除酸性工业废水中的甲醛,减少碳排放,实现碳中和。耦合电催化反应系统原理如图所示。

下列说法正确的是( )
A、电源a极为正极,通过质子交换膜从右侧移向左侧 B、阳极的电极反应式为: C、外电路转移时,理论上可消除废水中0.5molHCHO D、电解生成1molHCOOH,理论上可消耗标准状况下 -
14、南昌大学科研团队在醇歧化方面取得突破性进展。利用氢碘酸的还原性和碘的氧化性将5-羟甲基糠醛歧化得到5-甲基糠醛(5-MF)和2,5-二甲酰基呋喃(DFF),其反应机理如图所示。下列说法正确的是( )
 A、过程①中5-羟甲基糠醛发生氧化反应 B、若用代替 , 该反应也一定能发生 C、5-MF与DFF均存在含有苯环的同分异构体 D、若以
A、过程①中5-羟甲基糠醛发生氧化反应 B、若用代替 , 该反应也一定能发生 C、5-MF与DFF均存在含有苯环的同分异构体 D、若以 为反应物,则歧化可得
为反应物,则歧化可得 和
和
-
15、离子化合物由四种原子序数依次增大的短周期主族元素W、X、Y、Z组成,其中阴、阳离子均由两种元素组成且均呈正四面体形。四种元素的原子序数之和为21,且W、Z元素的基态原子核外均只有1个未成对电子。下列说法错误的是( )A、第一电离能:Y>Z>X B、原子半径:X>Y>Z C、键角: D、的化学式:
-
16、一种光催化重整聚乳酸生成丙酮酸的过程如图所示。设为阿伏加德罗常数的值,下列说法错误的是( )
 A、1mol乳酸分子中含有键数目为 B、1mol乳酸比1mol丙酮酸多质子 C、生成1mol丙酮酸,需要消耗 D、1mol丙酮酸与足量溶液反应,生成分子数为
A、1mol乳酸分子中含有键数目为 B、1mol乳酸比1mol丙酮酸多质子 C、生成1mol丙酮酸,需要消耗 D、1mol丙酮酸与足量溶液反应,生成分子数为 -
17、双酚AF广泛应用于光学、微电子、航天等领域。可由六氟丙酮与苯酚在一定条件下合成得到,路线如下:

下列说法错误的是( )
A、上述过程中涉及加成反应 B、双酚AF中所有碳原子一定共平面 C、苯酚与双酚AF遇溶液均显色 D、双酚AF分子中苯环上的一溴代物有2种 -
18、下列操作或装置可以用于相应实验的是( )


A.制备晶体
B.测氯水的pH


C.分离水和
D.实验室制备
A、A B、B C、C D、D -
19、二氯化二硫()是一种常用的橡胶硫化剂,其结构如图所示。极易水解:。下列说法错误的是( )
 A、中S为+1价 B、是由非极性键与极性键构成的极性分子 C、上述反应中既作氧化剂又作还原剂 D、上述反应中氧化产物与还原产物的质量比为3:1
A、中S为+1价 B、是由非极性键与极性键构成的极性分子 C、上述反应中既作氧化剂又作还原剂 D、上述反应中氧化产物与还原产物的质量比为3:1 -
20、中华传统文化源远流长。下图是传统酿酒工艺的装置。

下列仪器与装置X(虚线框内)作用相同的是( )


A.直形冷凝管
B.蒸馏烧瓶


C.分液漏斗
D.锥形瓶
A、A B、B C、C D、D