相关试卷
-
1、纯碱的化学式是A、 B、 C、 D、
-
2、乙醇酸钠(HOCH2COONa)又称羟基乙酸钠,它是一种有机原料,其相对分子质量为98。羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。实验室拟用氯乙酸(ClCH2COOH)和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈的放热反应,具体实验步骤如下:

步骤1:如图所示装置的三颈烧瓶中,加入132.3g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程控制pH约为9至10之间。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤,滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加入适量乙醇中,冷却结晶,过滤、干燥,得到羟基乙酸钠。
请回答下列问题:
(1)、装置中仪器A的名称为。(2)、上图装置中仪器B为球形冷凝管,下列说法正确的是(填字母)。A.球形冷凝管与直形冷凝管相比,冷却面积更大,效果更好
B.球形冷凝管既可以作倾斜式蒸馏装置,也可用于垂直回流装置
C.在使用冷凝管进行蒸馏操作时,一般蒸馏物的沸点越高,蒸气越易冷凝
(3)、步骤1中,发生反应的化学方程式是。(4)、逐步加入40%NaOH溶液的目的是 , 。(5)、步骤2中,三颈烧瓶中如果忘加磁转子该如何操作。(6)、步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的。(7)、步骤4中,得到纯净羟基乙酸钠98.0g,则实验产率为(结果保留1位小数)。 -
3、有机碱,例如二甲基胺(
 )、苯胺(
)、苯胺( ),吡啶(
),吡啶( )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
已知如下信息:
①H2C=CH2

②
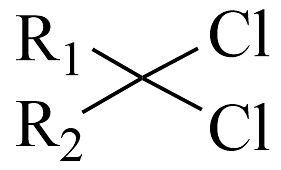 +RNH2
+RNH2
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为。
(2)由B生成C的化学方程式为。
(3)C中所含官能团的名称为。
(4)由C生成D的反应类型为。
(5)D的结构简式为。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有种,其中,芳香环上为二取代的结构简式为。
-
4、有机玻璃(
 )因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:
)因具有良好的性能而广泛应用于生产生活中。下图所示流程可用于合成有机玻璃,请回答下列问题:
已知:
(1)、C→D的第一次氧化反应条件为 , D的结构简式为:。(2)、G→H的另一种反应物化学式为 , D→E的反应类型为。(3)、E→F的化学方程式。(4)、写出F→有机玻璃的化学方程式。(5)、参考上述合成路线,以C2H4为原料(无机试剂任选),设计制备乳酸( )的合成路线。
)的合成路线。 -
5、1-溴丁烷可用于合成麻醉药盐酸丁卡因,也用于生产染料和香料,是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略):
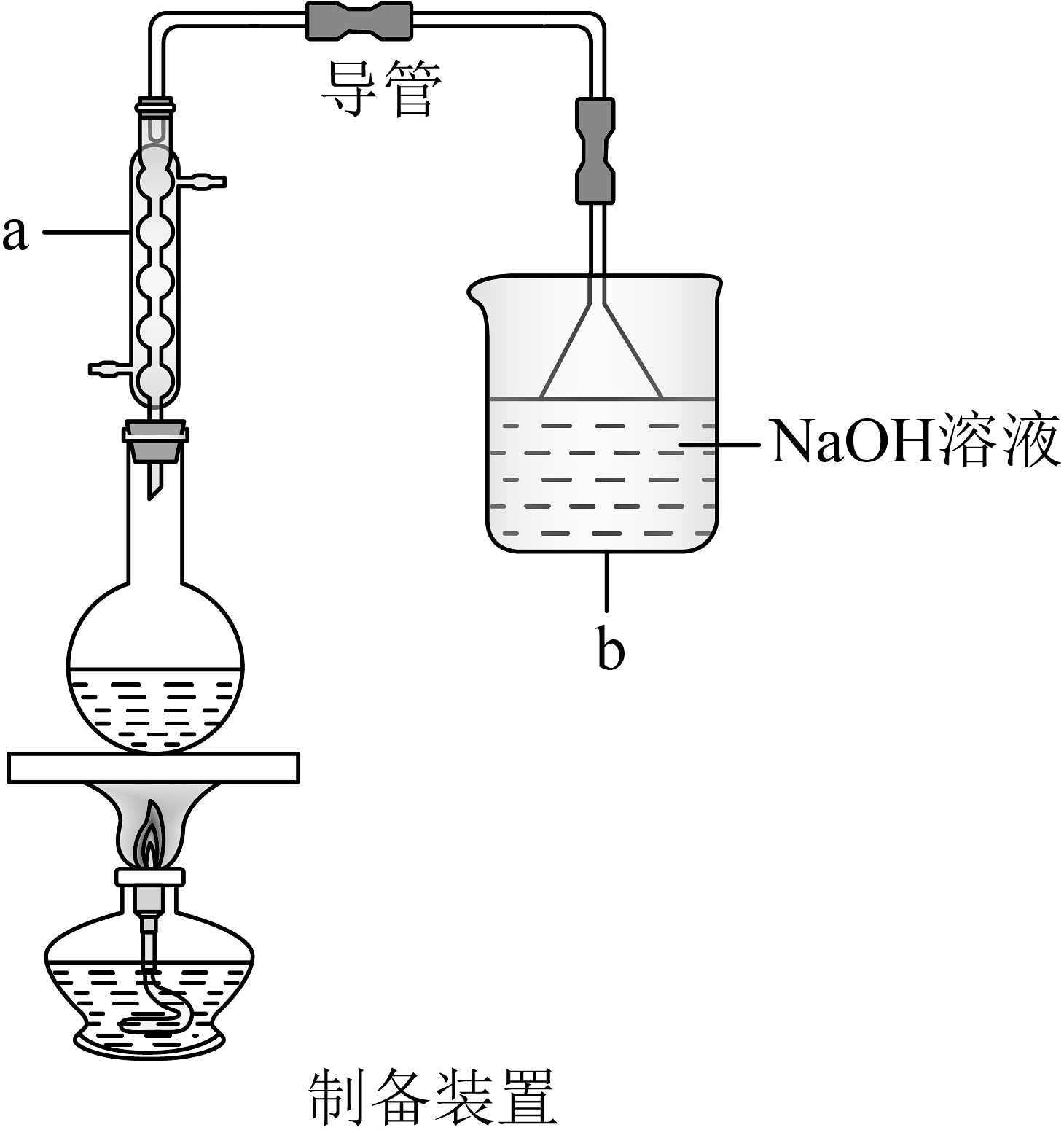
已知:ⅰ.NaBr+H2SO4(浓)=HBr↑+NaHSO4
ⅱ.CH3CH2CH2CH2OH+HBr→CH3CH2CH2CH2Br+H2O
ⅲ.2HBr+H2SO4(浓)=Br2+SO2+2H2O
请回答下列问题:
(1)、制备装置中a仪器的名称为。在反应时,若选用较浓的硫酸作为反应物,得到的产品会呈黄色,为除去颜色,最好选择下列的(填标号)溶液来洗涤产品。A.四氯化碳 B.硫酸钠 C.氢氧化钠 D.亚硫酸钠
产品选择上述溶液洗涤后,还需要用蒸馏水洗涤一次,洗涤液与产品分离的操作是(填操作名称)。
(2)、分离得到的有机层依次用适量的水、饱和NaHCO3溶液、水洗涤、用无水CaCl2干燥,蒸馏,得到最终产品。若投入正丁醇14.8g,得到产物15.6g,则1-溴丁烷的产率为%(保留一位小数)。(3)、探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验: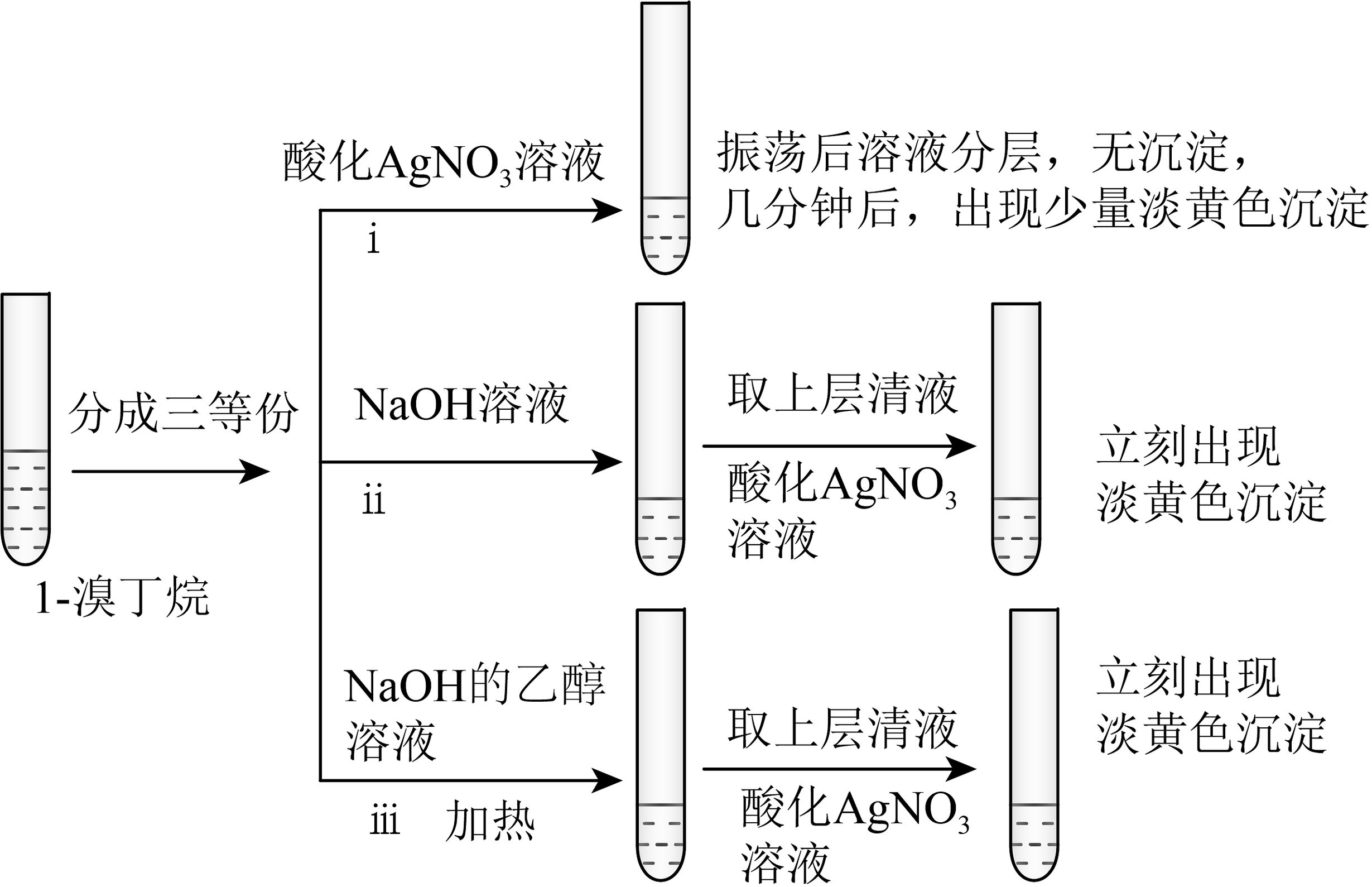
①对比ⅰ、ⅱ的实验现象,可得出卤代烃水解的实验结论是。
②为深入研究1-溴丁烷与NaOH水溶液是否能发生消去反应,小组设计如图装置探究(加热和夹持装置略去):

加热圆底烧瓶一段时间后,B中酸性高锰酸钾溶液褪色。
Ⅰ.甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是。
Ⅱ.乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是。
-
6、回答下列问题:(1)、下列各物质中,互为同分异构体的是(填序号。下同);互为同系物的是。
①NO2和N2O4
②12C和14C
③和
④
 和CH3CH2CH2CH2Cl
和CH3CH2CH2CH2Cl⑤
 和
和
⑥
 和
和 (2)、一种有机物Y的键线式如图所示:
(2)、一种有机物Y的键线式如图所示:
Y的分子式为;Y的一氯代物有种。
(3)、化合物 它的名称是。 (4)、充分燃烧2.8g某有机物A,生成8.8gCO2和3.6gH2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。求有机A的分子式。(5)、新制氢氧化铜检验乙醛的化学方程式。
它的名称是。 (4)、充分燃烧2.8g某有机物A,生成8.8gCO2和3.6gH2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。求有机A的分子式。(5)、新制氢氧化铜检验乙醛的化学方程式。 -
7、为了消除白色污染和减轻温室效应,设计以下路线吸收z物质,M为环状化合物。

下列说法不正确的是
A、试剂a可以是H2O2等氧化剂 B、M难溶于水 C、z的结构式为O=C=O D、由C3H6生成X、M的反应均为加成反应 -
8、下列有关高分子化合物的判断不正确的是A、聚合物
 可由异戊二烯缩聚制得
B、结构为-CH=CH-CH=CH-CH=CH-CH=CH-的高分子化合物,其单体是乙炔
C、有机硅聚醚
可由异戊二烯缩聚制得
B、结构为-CH=CH-CH=CH-CH=CH-CH=CH-的高分子化合物,其单体是乙炔
C、有机硅聚醚 可由单体
可由单体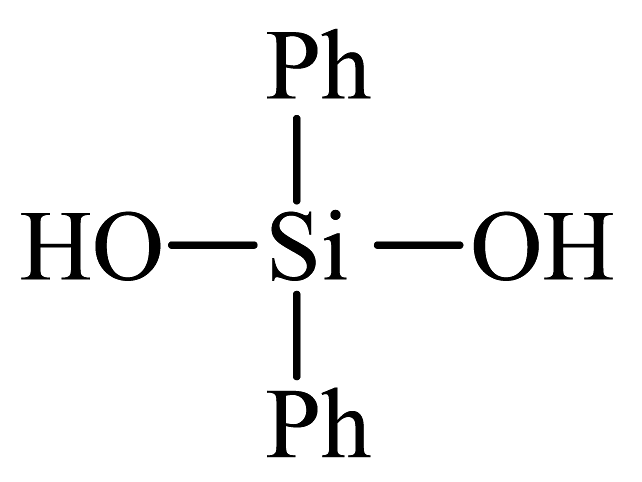 和
和 缩聚而成
D、聚合物
缩聚而成
D、聚合物 可由乙二酸和乙二醇缩聚而成
可由乙二酸和乙二醇缩聚而成
-
9、下列方程式与所给事实相符的是A、实验室用电石制乙炔:CaC2+H2O→C2H2↑+CaO B、醋酸与乙醇的反应:CH3COOH+C2H518OHCH3CO18OC2H5+H2O C、乙烯和次氯酸反应:CH2=CH2+HClO→CH3CH2OCl D、苯制溴苯:
 +Br2
+Br2
-
10、可用于鉴别以下三种化合物的一组试剂是

①银氨溶液; ②溴的四氯化碳溶液; ③氯化铁溶液; ④氢氧化钠溶液。
A、②与③ B、③与④ C、①与④ D、①与② -
11、有机物分子中原子(或原子团)之间的相互影响会导致它们化学性质的改变,下列叙述能说明上述观点的是( )A、等物质的量的乙二醇和乙醇分别与足量金属钠反应,乙二醇产生的氢气多 B、乙烯可发生加成反应,而乙烷不能 C、甲苯能使酸性高锰酸钾溶液褪色,甲基环己烷不能使酸性高锰酸钾溶液褪色 D、乙烯和苯都能和氢气发生加成反应
-
12、《本草纲目》中记载杜衡主治风寒咳逆,其有效成分杜衡素A的结构如图所示。下列有关杜衡素A的说法正确的是
 A、含有3种官能团 B、分子式为 C、能使酸性重铬酸钾溶液变色 D、可发生加成反应
A、含有3种官能团 B、分子式为 C、能使酸性重铬酸钾溶液变色 D、可发生加成反应 -
13、两种气态烃以任意比例混合,在105℃时1L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是A、CH4与C2H4 B、CH4与C3H4 C、C2H2与C3H6 D、C2H4与C3H4
-
14、下列有机实验中关于硫酸浓稀使用及作用完全正确的是
实验名称
硫酸浓稀
硫酸作用
A
苯的硝化
稀
催化剂
B
乙酸乙酯制备
浓
催化剂、吸水剂
C
实验室制乙烯
浓
吸水剂
D
蔗糖水解
浓
催化剂
A、A B、B C、C D、D -
15、设 NA 代表阿伏加德罗常数的数值,下列有关说法正确的是A、标准状况下,22.4L 甲醇中含有的氧原子数目为 NA B、1 mol 苯中含有的碳碳双键数目为 3NA C、30g 甲醛和乙酸的混合物中所含的原子总数为 4NA D、46gC2H6O 中一定含有 NA 个-OH
-
16、下列对有机物的命名中,正确的是A、
 2,3-二甲基-1-丙醇
B、
2,3-二甲基-1-丙醇
B、 邻甲基苯酚
C、CH3OOCCH3甲酸乙酯
D、
邻甲基苯酚
C、CH3OOCCH3甲酸乙酯
D、 2-甲基丙酸
2-甲基丙酸
-
17、下列关系不正确的是A、密度:四氯化碳>水>苯 B、沸点:正戊烷>异戊烷>新戊烷 C、同条件下燃烧黑烟浓度:乙炔>乙烯>乙烷 D、同物质的量物质燃烧耗 O2 量:己烷>苯>苯甲酸
-
18、下列说法正确的是A、有
 和
和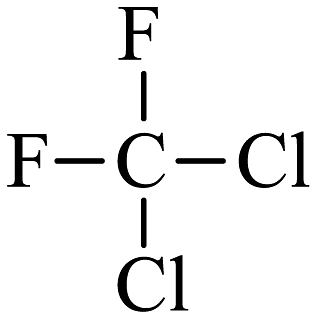 两种结构
B、
两种结构
B、 分子中所有原子均可共面
C、在碳原子数小于10的烷烃中,一氯代物不存在同分异构体的有4种
D、异戊烷有5种二氯代物
分子中所有原子均可共面
C、在碳原子数小于10的烷烃中,一氯代物不存在同分异构体的有4种
D、异戊烷有5种二氯代物
-
19、我国有众多非物质文化遗产,如剪纸、制香、湖笔等。下列物质的主要成分不是有机高分子材料的是
文化遗产


名称
A.剪纸中的“纸”
B.制香中的“香油”
文化遗产


名称
C.丝绸中的“丝”
D.湖笔笔头的“羊毫”
A、A B、B C、C D、D -
20、用含少量的溶液制备的过程如图所示。已知:室温下,。下列说法正确的是
 A、溶液呈酸性,且 B、除钙镁后的溶液中: C、溶液中: D、若将流程中换成 , 则制得的纯度更高
A、溶液呈酸性,且 B、除钙镁后的溶液中: C、溶液中: D、若将流程中换成 , 则制得的纯度更高