相关试卷
-
1、如图装置,试管中盛有水,气球中盛有干燥的颗粒,U形管中注有浅红色的水,将气球用橡皮筋紧缚在试管口,实验时将气球中的抖落到试管b的水中,将发生的现象是
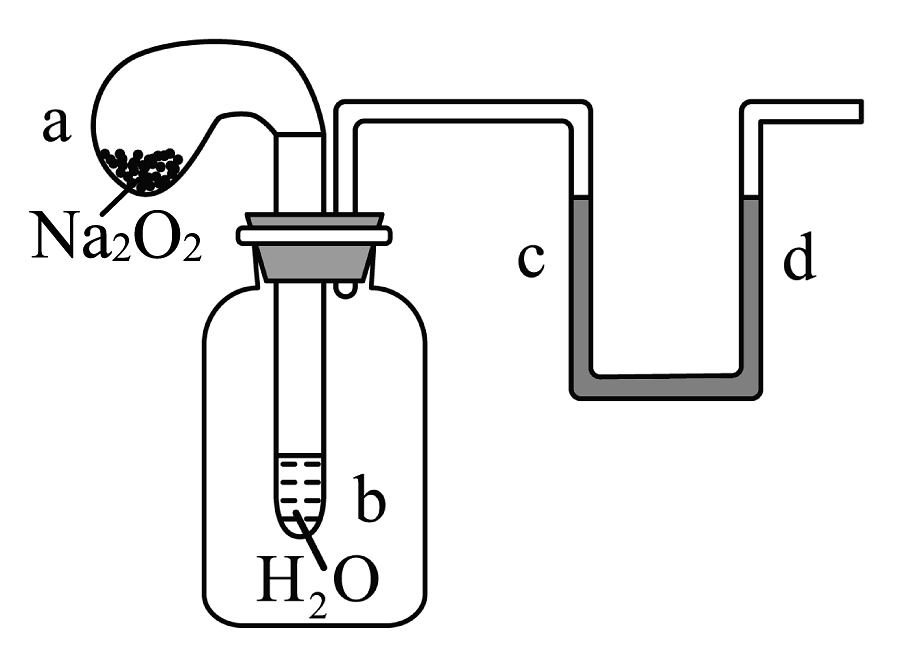 A、U形管内红水褪色 B、试管内溶液变红 C、气球a被吹大 D、U形管水位:
A、U形管内红水褪色 B、试管内溶液变红 C、气球a被吹大 D、U形管水位: -
2、下列各组离子在对应条件下一定能在大量共存的是A、遇石蕊变红的溶液:、、、 B、无色溶液:、、、 C、遇酚酞变红的溶液:、、、 D、在pH=1的溶液中:、、、
-
3、广东的物质文化遗产丰富多彩。下列物质主要由硅酸盐制成的是




A.吴川陶鼓
B.揭阳木雕
C.潮汕英歌舞服饰
D.佛山剪纸用纸
A、A B、B C、C D、D -
4、“跑道式”元素周期表结构如图所示:

下列有关叙述错误的是
A、元素a能与水置换出 , 且反应比与水反应更剧烈 B、元素b形成的两种单质分子的化学性质完全不同 C、元素c、d、e、f、g的原子最外层电子数相同,且对应的单质都有比较强的氧化性 D、位置h和i处均各含有15种元素 -
5、实验室制取的实验原理及装置均正确的是




A.制取
B.除去中的HCl
C.收集
D.吸收尾气中的
A、A B、B C、C D、D -
6、有机物G是一种医药中间体,其合成路线如下(部分试剂和反应条件略去)。
 (1)、根据化合物C的结构特征,分析预测其含氧官能团可能的化学性质,完成下表。
(1)、根据化合物C的结构特征,分析预测其含氧官能团可能的化学性质,完成下表。序号
反应试剂、条件
反应形成新官能团的名称
反应类型
①
H2/催化剂,加热
②
消去反应
(2)、化合物B生成C的反应是原子利用率100%的反应,则化合物a的结构简式为 , 化合物B中手性碳原子有个。(3)、化合物D生成E的化学方程式为。(4)、在B的同分异构体中,含有六元环结构且能发生银镜反应的有机物有种(不考虑立体异构)。(5)、根据上述信息,以甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)为有机原料,合成化合物 , 基于你的合成路线, 回答下列问题:
, 基于你的合成路线, 回答下列问题:①从甲苯出发, 第一步的化学方程式为。
②第二步生成有机产物的结构简式为。
-
7、
某兴趣小组设计相关实验方案对Cu2+、Ag+氧化性的强弱进行探究。
已知:①;
I.溶液准备
(1)配制溶液,需使用的玻璃仪器有烧杯、胶头滴管、、 , 测得该溶液的pH≈4。II.通过置换反应比较
(2)向溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性写出该反应的化学方程式是。Ⅲ.通过分别与同一物质反应进行比较
编号
实验操作
现象
实验i
向1.0mL1.0mol·L-1KI溶液中滴加1.0mL1.0mol·L-1AgNO3溶液
产生黄色沉淀,溶液无色
实验ii
向1.0mL1.0mol·L-1KI溶液中滴加1.0mL0.5mol·L-1Cu(NO3)2溶液
产生白色沉淀A,溶液变黄色
(3)①经检验,实验i中反应后溶液不含I2 , 则该反应产生的黄色沉淀是。②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有(填离子符号)。
b.白色沉淀A与AgNO3溶液反应的离子方程式是 , 说明氧化性
(4)分析“实验i”中Ag+未能氧化I- , 而“实验ii”中Cu2+能氧化I-的原因。①结合K值分析:因 , Ag+更易与I-发生复分解反应,生成AgI,故Ag+未能氧化I-;
②结合实验ii的反应方程式及其特点分析: , 促进反应向正反应方向进行,故Cu2+能更易氧化I-。
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为d中是Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
编号
实验iv
实验v
实验vi
装置



现象
无明显变化
a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转
c中溶液较慢变浅黄色;电流计指针偏转
(5)①实验v的现象说明Ag+能氧化Γ,a中溶液呈棕黄色的原因是(用电极反应式表示)。②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是 , 现象是c中溶液较慢变浅黄色;电流计指针偏转。
小组同学根据实验v和实验vi,可推断氧化性
-
8、
SO2和焦亚硫酸钠(Na2S2O5)可作食品添加剂。某小组进行如下探究:
I. 制备SO2
(1)①实验室用 NaHSO3和70%H2SO4制取SO2 , 反应的化学方程式为。
②欲收集干燥的SO2 , 选择下列必要的装置,按气流方向连接顺序为(填仪器接口的字母编号)。

Ⅱ. 探究焦亚硫酸钠的性质
(2)焦亚硫酸钠易被氧化而变质。该小组设计实验方案,检验焦亚硫酸钠样品氧化变质的程度,完成下列表中的内容。
已知: 2NaHSO3=Na2S2O5+H2O
实验编号
实验步骤
现象
结论
i
取少量样品于试管中,加入除氧蒸馏水
固体溶解,得到无色溶液
/
ii
取少量i的溶液于试管中,加入
样品已氧化变质
iii
另取少量i的溶液于试管中,加入酸性KMnO4溶液,振荡
样品未完全氧化变质
(3)为检验某白葡萄酒中是否含有Na2S2O5 , 甲同学设计的实验方案是用酸性KMnO4溶液进行检验, 乙同学认为该方案不可行, 乙同学的理由是。
Ⅲ.该小组利用下列装置测定空气中SO2的含量。

(4)①通空气样品的导管末端是带许多小孔的玻璃球泡, 其主要作用是;
②若空气流速为 当观察到时,结束计时,测定耗时为tmin。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2 , 的含量为mg·m-3。
-
9、科学家研发了一种绿色环保“全氧电池”,有望减少废旧电池产生的污染。其工作原理如图所示,下列说法正确的是
 A、K+向电极 a移动 B、电极b的电极反应式为 C、理论上, 当电极a释放出 (标准状况下)时,KOH 溶液质量减少32g D、“全氧电池”工作时将酸碱反应的中和能转化为电能
A、K+向电极 a移动 B、电极b的电极反应式为 C、理论上, 当电极a释放出 (标准状况下)时,KOH 溶液质量减少32g D、“全氧电池”工作时将酸碱反应的中和能转化为电能 -
10、某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是
 A、其他条件相同时,催化剂浓度越大,反应速率越大 B、其他条件相同时,降冰片烯浓度越大,反应速率越大 C、条件①,反应速率为 D、条件②,降冰片烯起始浓度为时,半衰期为
A、其他条件相同时,催化剂浓度越大,反应速率越大 B、其他条件相同时,降冰片烯浓度越大,反应速率越大 C、条件①,反应速率为 D、条件②,降冰片烯起始浓度为时,半衰期为 -
11、某化学小组用“84消毒液” (主要成分有 NaClO)制备氯气并探究其性质,进行如图所示的实验(a~d中均为浸有相应试液的棉花,夹持装置省略)。下列说法正确的是
 A、具支试管中反应生成了黄绿色气体,该反应体现了浓盐酸的酸性和还原性 B、a处变为橙色, b处变为蓝色,说明氧化性:Cl2>Br2>I2 C、c处褪色, 说明 Cl2具有还原性 D、d处褪色,说明Cl2具有漂白性
A、具支试管中反应生成了黄绿色气体,该反应体现了浓盐酸的酸性和还原性 B、a处变为橙色, b处变为蓝色,说明氧化性:Cl2>Br2>I2 C、c处褪色, 说明 Cl2具有还原性 D、d处褪色,说明Cl2具有漂白性 -
12、下列陈述Ⅰ和陈述Ⅱ均正确,且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
使用纯碱溶液去油污
Na2CO3水解使溶液显碱性
B
丙三醇用于配制化妆品
丙三醇能与高级脂肪酸反应生成脂
C
液氨可用作制冷剂
氨气易溶于水
D
工业用电解熔融AlCl3制取金属铝
金属铝的还原性很强
A、A B、B C、C D、D -
13、反应 放热且产生气体,可用于冬天石油开采。设NA为阿伏加德罗常数的值。下列叙述正确的是A、1mol NH4Cl含有共价键目为 5NA B、1.8gH2O 含有的质子数目为 NA C、浓度均为 和 NaNO2混合溶液中,Na+数目为0.1NA D、上述反应中,每生成0.1mol N2转移的电子数目为0.6NA
-
14、下列实验装置(部分夹持装置已略去) 可以达到对应实验目的是
目的
A. 制备氢氧化铁胶体
B.实验室制备氨气
C. 推断 Cl、C、Si的非金属性强弱
D. 制备并收集NO
装置



 A、A B、B C、C D、D
A、A B、B C、C D、D -
15、科学家合成出了一种高效电解质,其结构如图所示,其中W、Y、X、Z、Q均为短周期主族元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是
 A、Q的氧化物对应水化物均为强酸 B、元素非金属性的顺序为Z>Y>X C、W和X形成的化合物溶于水呈碱性 D、该电解质的阴离子中所有原子均满足8电子稳定结构
A、Q的氧化物对应水化物均为强酸 B、元素非金属性的顺序为Z>Y>X C、W和X形成的化合物溶于水呈碱性 D、该电解质的阴离子中所有原子均满足8电子稳定结构 -
16、部分含镁或含铜物质的分类与相应化合价关系如图所示,其中e为氯化物。下列推断不合理的是
 A、转化a→c→d在给定条件下均可一步反应实现 B、b可与盐酸反应生成e和a,b既有氧化性又有还原性 C、新制的d可用于检验葡萄糖中的醛基 D、经过e→d→e→a的转化可实现从海水中提取镁
A、转化a→c→d在给定条件下均可一步反应实现 B、b可与盐酸反应生成e和a,b既有氧化性又有还原性 C、新制的d可用于检验葡萄糖中的醛基 D、经过e→d→e→a的转化可实现从海水中提取镁 -
17、山奈酚是中药柴胡的药物成分之一,结构如图所示,下列有关山奈酚叙述正确的是
 A、该物质属于芳香烃 B、分子中所有碳原子一定共平面 C、不能使溴水和酸性 KMnO4溶液褪色 D、1mol 山奈酚最多与 3molNaOH 反应
A、该物质属于芳香烃 B、分子中所有碳原子一定共平面 C、不能使溴水和酸性 KMnO4溶液褪色 D、1mol 山奈酚最多与 3molNaOH 反应 -
18、下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
厨师用盐卤(主要成分MgCl2)点豆腐
豆浆中的蛋白质发生聚沉
B
工人用 FeCl3溶液作腐蚀液制作印刷电路板
金属铁的还原性比金属铜强
C
面包师用小苏打粉作膨松剂烘培糕点
NaHCO3受热易分解放出CO2
D
检测员用AgNO3滴定法测定水样中 Cl-的含量
Ag+与Cl-反应生成AgCl沉淀
A、A B、B C、C D、D -
19、化学处处呈现美。下列说法不正确的是A、加热固体碘出现大量紫色蒸气时,共价键断裂 B、茉莉花的芳香扑鼻而来,体现了分子是运动的 C、烟花燃放时呈现出五颜六色,是不同金属元素的焰色所致 D、甲烷分子为正四面体结构,四个氢原子完美对称,其键角和键长均相等
-
20、下列说法或化学用语表述正确的是A、N2的电子式: N⋮⋮N B、CH2Cl2中的共价键类型:非极性键和极性键 C、CO2的空间结构: V形 D、反-2-丁烯的结构简式:
