相关试卷
-
1、下列各组离子中,能在溶液里大量共存的是A、 B、 C、 D、
-
2、下列实验方案不能达到实验目的的是
A.检验乙醇与浓硫酸共热生成乙烯
B.检验1-溴丁烷发生消去反应生成丁烯


C.验证乙酸、碳酸、苯酚的酸性强弱
D.检验电石与水反应生成乙炔

 A、A B、B C、C D、D
A、A B、B C、C D、D -
3、某研究小组以甲苯为起始原料,按下列路线合成有机光电材料中间体K。

已知:①R-BrR-CNR-COOH;
②R-CHO+CH3CHOR-CH=CHCHO。
请回答:
(1)、反应Ⅰ所需试剂和反应条件分别是、。化合物M的结构简式是。(2)、下列说法不正确的是___________。A、化合物D分子中所有原子可能共平面 B、化合物E与苯甲酸互为同系物 C、E→F、G→J的反应类型分别为加成反应、取代反应 D、化合物N可由环戊二烯与乙烯经加成反应制得(3)、反应F→G第①步反应的化学方程式是。(4)、写出同时符合下列条件的化合物E的同分异构体的结构简式。①分子中含有苯环;遇氯化铁溶液显紫色;
②1H−NMR谱表明分子中有5种化学环境不同的氢原子;IR谱显示存在碳氧双键、碳碳双键。
(5)、设计以HCHO、CH3CHO为原料合成的合成 路线(用流程图表示,其它无机试剂任选)。
路线(用流程图表示,其它无机试剂任选)。 -
4、某兴趣小组设计如图实验装置制备次磷酸钠(NaH2PO2)。
已知:①白磷(P4)在空气中可自燃,与过量烧碱溶液混合,80~90℃时反应生成NaH2PO2和PH3。
②PH3是一种有强还原性的有毒气体,空气中可自燃,可与NaClO溶液反应生成NaH2PO2。
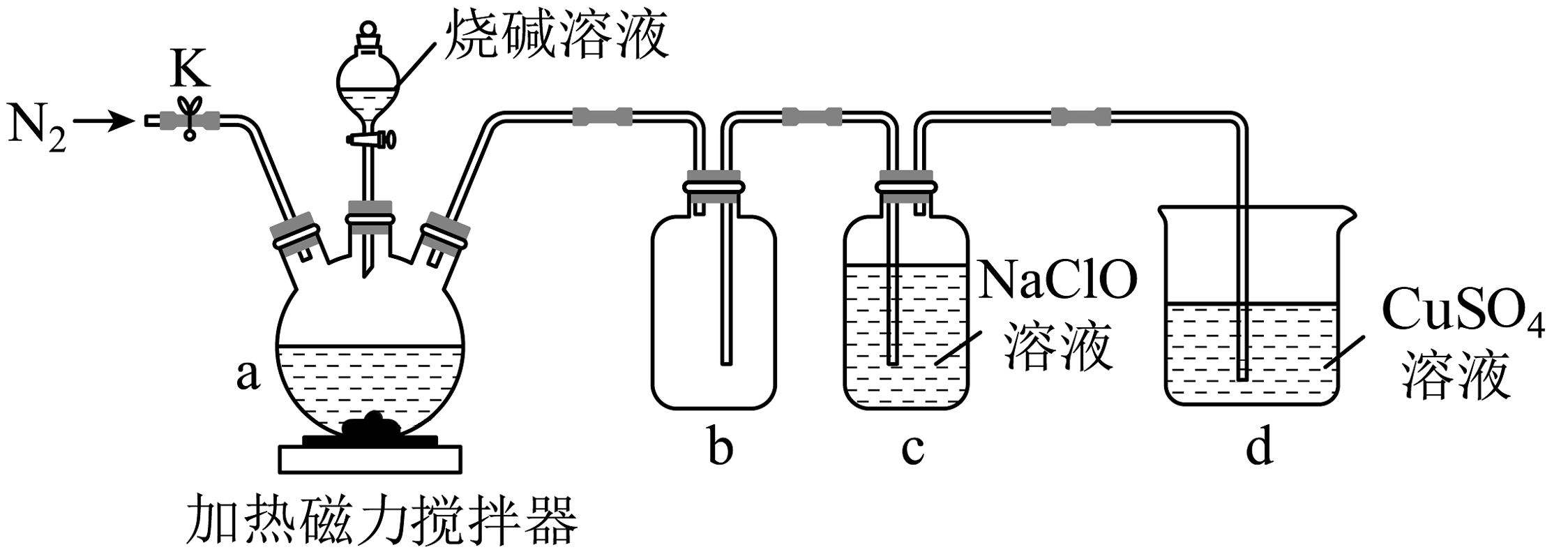
请回答:
(1)、①仪器a的名称是。②仪器b组成的装置的作用是。
(2)、检查装置气密性后,应先打开K通入N2一段时间,目的是。(3)、仪器c中充分反应后生成NaH2PO2和NaCl,经过一系列操作可获得固体NaH2PO2。相关物质的溶解度(S)如下:S(25℃)
S(100℃)
NaCl
37
39
NaH2PO2
100
667
从下列选项中选择合理的仪器和操作,补全如下步骤。[“___________”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。
取仪器c中溶液,用蒸发皿()→用(趁热过滤)→用烧杯(冷却结晶)→用漏斗(过滤得到NaH2PO2)→洗涤→干燥→NaH2PO2粗产品。
仪器:d.普通三角漏斗;e.铜制保温漏斗;
操作:f.蒸发浓缩至有大量晶体析出;g.蒸发浓缩至溶液表面出现晶膜。
(4)、下列有关说法不正确的是___________。A、次磷酸(H3PO2)是三元酸 B、为加快反应速率,投料前应先在通风橱内将白磷碾成薄片状 C、反应结束后应继续通入N2一段时间,可提高NaH2PO2产率 D、d中所盛硫酸铜溶液可用酸性高锰酸钾溶液代替(5)、产品纯度测定:取产品x g配成100 mL溶液,取10 mL于锥形瓶中,酸化后加入50 mL0.1000 mol/L的NH4Fe(SO4)2溶液,以邻二氮菲做指示剂,再用0.1000 mol/L的硫酸铈滴定至终点,平均消耗V mL。相关反应的离子方程式为:H2O+H2PO+2Fe3+=H2PO+2Fe2++2H+、Ce4++Fe2+=Ce3++Fe3+ , 产品纯度表达式为(用含x、V的式子表示)。 -
5、CH3OH是一种绿色燃料,可由CO或CO2制备。工业上制备CH3OH发生如下反应:反应1:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
反应2:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2kJ/mol
请回答:
(1)、CO(g)+2H2(g)CH3OH(g),该反应的ΔH=kJ/mol。(2)、将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。
①代表5MPa下α(CO2)随温度变化趋势的是曲线(填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是。
③P点对应的反应2的平衡常数Kp=。
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是。

⑤请在下图中画出5MPa时生成CH3OH、CO选择性(S)随温度变化的曲线。

-
6、化工原料氨基磺酸(H2NSO3H)是硫酸的羟基被氨基取代而形成的一种无机固体酸,可通过下列流程制备:

已知:氨基磺酸溶液呈强酸性,加热至60℃以上时发生水解反应。请回答:
(1)、步骤Ⅲ产物除H2NSO3H外,还生成了一种气体,反应的化学方程式是。(2)、氨基磺酸与氨基酸类似,是两性化合物,能与酸、碱反应生成盐。预测熔点大小关系是:H2NSO3HH2SO4(填“>”或“<”),理由是。(3)、下列说法不正确的是___________。A、液氨气化时要吸收大量的热,可用作制冷剂 B、H2NCOONH4既属于酯类物质又属于酰胺类物质 C、CO(NH2)2属于铵盐,含氮量高,可作氮肥 D、H2NSO3H发生水解反应后得到硫酸氢铵溶液(4)、氨气与光气(COCl2)反应也可生成CO(NH2)2和一种盐,反应的化学方程式是。(5)、设计实验方案检验氨基磺酸中的N元素。 -
7、石灰氮(CaCN2)可用作肥料、除草剂、杀菌剂、杀虫剂以及有机化工原料。请回答:(1)、石灰氮可与稀硫酸反应生成硫酸钙和氨基氰,氨基氰(CH2N2)的结构式是。(2)、氨基氰可水解生成尿素[(CO(NH2)2],C、N、O的第一电离能从大到小排列的顺序是。已知尿素分子中所有原子均共平面,则分子中C、N原子的杂化轨道类型分别是、。(3)、上世纪初曾用石灰氮与过热水蒸气反应制氨气,已知NH3沸点高于PH3、AsH3而低于SbH3、BiH3 , 原因是。(4)、石灰氮可由电石与氮气反应制得:CaC2+N2=CaCN2+C。CaC2的晶胞与NaCl相似,但由于C的结构导致晶胞沿一个方向拉长,设NA为阿伏加德罗常数的值,下列说法不正确的是___________。
 A、Ca2+填充在C围成的八面体空隙中 B、每个C周围距离最近且等距离的Ca2+有6个 C、一个晶胞内相距最远的Ca2+之间距离为pm D、CaC2晶体密度计算表达式为g/cm3
A、Ca2+填充在C围成的八面体空隙中 B、每个C周围距离最近且等距离的Ca2+有6个 C、一个晶胞内相距最远的Ca2+之间距离为pm D、CaC2晶体密度计算表达式为g/cm3 -
8、探究硫及其化合物的性质,记录到如下现象,下列方案设计和结论都正确的是
选项
实验方案
现象
结论
A
取某含氧酸盐溶液,加入稀硝酸酸化,若无明显现象,再加BaCl2溶液,观察现象
溶液中产生白色沉淀
说明该含氧酸盐溶液中含有
B
将SO2分别通入品红的乙醇溶液和品红的水溶液,观察现象
品红的乙醇溶液不褪色,品红的水溶液慢慢褪色
说明使品红褪色的不是SO2 , 而是SO2与水反应后的产物
C
将乙醇与浓硫酸混合于试管中加热,产生的气体通入酸性KMnO4稀溶液中,观察现象
紫色溶液褪色
说明浓硫酸具有脱水性,将乙醇转化为乙烯
D
将硫磺与浓KOH溶液共热,待固体消失后,加入足量稀硫酸,观察现象
溶液变浑浊
说明硫磺与碱反应生成硫化物和硫酸盐
A、A B、B C、C D、D -
9、常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgQ[Q表示或随pH的变化关系如图所示。已知常温下,Ksp(CaC2O4)=10-8.63 , 下列说法不正确的是
 A、NaHC2O4溶液中:c(H2C2O4)<c(C2O) B、若P点坐标为(4.19,x),则x=2.96 C、反应CaC2O4+2H+Ca2++H2C2O4的平衡常数K=10−3.21 D、当pH取值范围为(1.23,4.19)时c(HC2O)>c(C2O)>c(H2C2O4)
A、NaHC2O4溶液中:c(H2C2O4)<c(C2O) B、若P点坐标为(4.19,x),则x=2.96 C、反应CaC2O4+2H+Ca2++H2C2O4的平衡常数K=10−3.21 D、当pH取值范围为(1.23,4.19)时c(HC2O)>c(C2O)>c(H2C2O4) -
10、在1L密闭容器中充入0.2molCl2和0.3molNO,不同温度下发生反应Cl2(g)+2NO(g)2ClNO(g) ΔH<0,ClNO的体积分数随时间的变化如图所示。下列说法不正确的是
 A、实验Ⅰ、Ⅱ、Ⅲ反应温度大小关系:T1>T2>T3 B、实验Ⅱ相比实验Ⅰ、Ⅲ,除温度不同外还可能使用了催化剂 C、NO和Cl2的物质的量之比保持不变时,反应达到平衡状态 D、实验Ⅲ25min内用NO表示的反应速率为0.004mol/(L·min)
A、实验Ⅰ、Ⅱ、Ⅲ反应温度大小关系:T1>T2>T3 B、实验Ⅱ相比实验Ⅰ、Ⅲ,除温度不同外还可能使用了催化剂 C、NO和Cl2的物质的量之比保持不变时,反应达到平衡状态 D、实验Ⅲ25min内用NO表示的反应速率为0.004mol/(L·min) -
11、下列溶液中粒子的物质的量浓度关系不正确的是A、0.1mol·L−1Na2SO3溶液中:c(SO)>c(OH-)>c(HSO) B、NH4Cl溶液中加入等体积稀盐酸,NH4Cl溶液酸性可能减弱 C、室温下,将pH=3的醋酸溶液加水稀释100倍,所得溶液的pH>5 D、室温下,pH=3的盐酸与pH=11的氨水等体积混合:c(NH)+c(OH-)>c(Cl-)+c(H+)
-
12、N2O5在HClO4中发生反应:N2O5+3HClO4=2+3+H3O+。N2O5的结构如图,可看作H2O分子中H原子被硝基取代而形成。下列说法不正确的是
 A、N2O5是非极性分子 B、空间构型为正四面体形 C、中N杂化轨道类型为sp D、H3O+的键角大于H2O的键角
A、N2O5是非极性分子 B、空间构型为正四面体形 C、中N杂化轨道类型为sp D、H3O+的键角大于H2O的键角 -
13、T、W、X、Y、Z是原子序数依次增大的前四周期元素。基态原子中,T的各能级电子数相等;X的价层电子排布式为nsnnp2n;Y的核外电子填充在8个轨道中;Z有4个未成对电子。下列说法不正确的是A、电负性大小:X>W>Y B、最简单氢化物的沸点:W>T>Y C、最高价氧化物对应水化物的酸性:W>T>Y D、Y与W、Z与X均能形成原子个数比为4:3的化合物
-
14、有机物G是合成药物的中间体。下列说法不正确的是
 A、G分子中含有1个手性碳原子 B、G在酸或碱溶液中都可发生水解反应 C、1molG完全燃烧需消耗20molO2 D、1molG能与7molH2发生加成反应
A、G分子中含有1个手性碳原子 B、G在酸或碱溶液中都可发生水解反应 C、1molG完全燃烧需消耗20molO2 D、1molG能与7molH2发生加成反应 -
15、下列说法正确的是A、硝酸纤维和醋酸纤维均以纤维素为原料 B、聚乳酸和聚丙烯酸均通过缩聚反应制得 C、甲苯中混有苯酚,可加入适量浓溴水后过滤除去 D、核糖核酸(RNA)分子呈双螺旋结构
-
16、能正确表示下列反应的离子方程式是A、硝酸银溶液中滴入少量氨水:Ag++2NH3=[Ag(NH3)2]+ B、二氧化锰与浓盐酸共热:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O C、乙酰甲胺在稀盐酸中水解:CH3CONHCH3+H2O+H+CH3COOH+CH3NH D、次氯酸钙溶液中通入少量二氧化硫:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+
-
17、工业上用S8(分子结构:
 )与CH4为原料制备CS2 , 发生反应:S8+2CH4=2CS2+4H2S。设NA为阿伏加德罗常数的值,下列说法正确的是 A、S8既是氧化剂,又是还原剂 B、生成17gH2S,断开S−S键数为NA C、消耗1gCH4转移电子数为NA D、CS2中σ键与π键数量之比为2:1
)与CH4为原料制备CS2 , 发生反应:S8+2CH4=2CS2+4H2S。设NA为阿伏加德罗常数的值,下列说法正确的是 A、S8既是氧化剂,又是还原剂 B、生成17gH2S,断开S−S键数为NA C、消耗1gCH4转移电子数为NA D、CS2中σ键与π键数量之比为2:1 -
18、关于下列物质工业制备的说法正确的是A、烧碱:通过Na2O与H2O反应来制备 B、铝单质:通过电解AlCl3溶液来制备 C、盐酸:H2与Cl2燃烧生成HCl溶于水制得 D、粗硅:高温下用H2还原SiHCl3制得
-
19、物质的性质决定用途,下列两者对应关系正确的是A、NaHCO3可中和酸并受热分解产生CO2 , 可作蓬松剂 B、NO2具有较强的氧化性,可用于饮用水消毒 C、FeCl2具有还原性,可用于制作印刷电路板 D、H2S具有弱酸性,可除去废水中的Hg2+
-
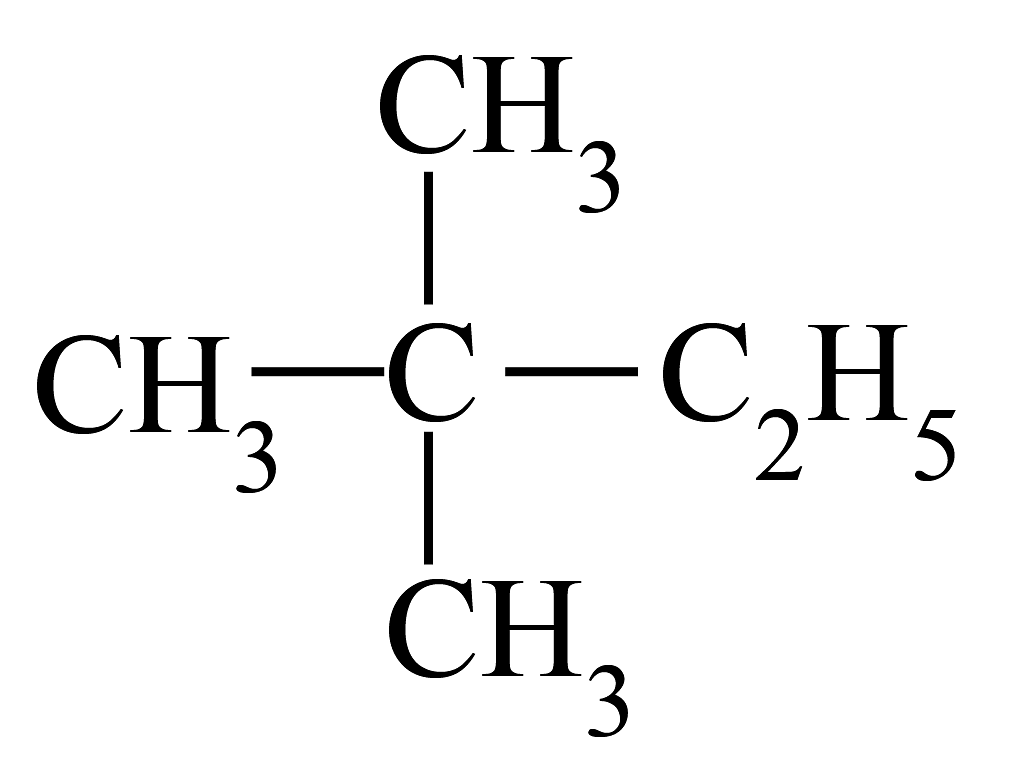
20、下列化学用语表示不正确的是A、2,2−二甲基丁烷的结构简式:
 B、三氟化硼分子的空间填充模型:
B、三氟化硼分子的空间填充模型: C、次氯酸分子的电子式:
C、次氯酸分子的电子式: D、基态氯原子的简化电子排布式:[Ar]4s24p5
D、基态氯原子的简化电子排布式:[Ar]4s24p5