相关试卷
-
1、新戊醇可发生如下转化:
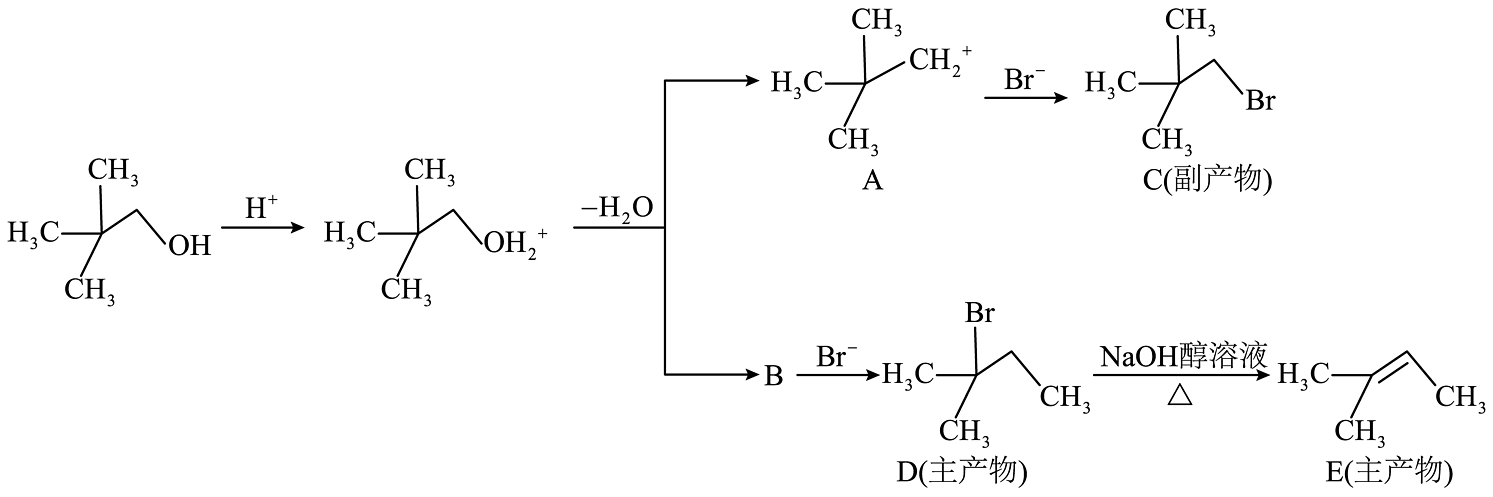
下列说法正确的是
A、产物C在NaOH醇溶液中加热能生成E B、化合物B的结构为 C、由上述机理可知:
C、由上述机理可知: (主产物)
D、化合物D到E反应的有机副产物是
(主产物)
D、化合物D到E反应的有机副产物是
-
2、将气体和按体积之比导入管式反应器(如图1)热解制 , 高于T℃下发生如下两个反应(反应过程用稀释):
Ⅰ:
Ⅱ:
在常压下反应相同时间后,不同温度下测得气体、及体积分数随温度的变化(如图2)。下列说法错误的是
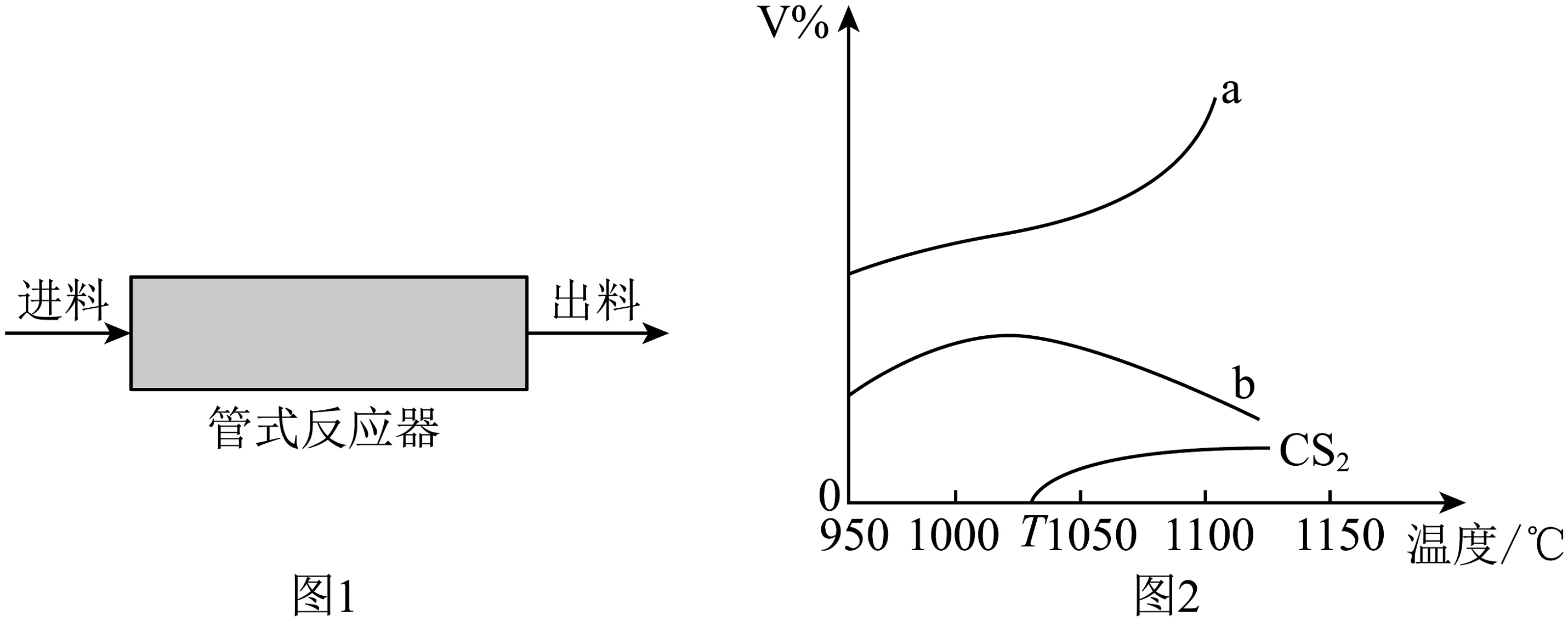 A、高于T℃,该体系总反应为: B、曲线b表示的体积分数随温度的变化 C、1000℃时,反应的活化能:反应Ⅰ<反应Ⅱ D、在1000℃、常压下,通入的体积分数保持不变,提高投料比 , 的转化率减小
A、高于T℃,该体系总反应为: B、曲线b表示的体积分数随温度的变化 C、1000℃时,反应的活化能:反应Ⅰ<反应Ⅱ D、在1000℃、常压下,通入的体积分数保持不变,提高投料比 , 的转化率减小 -
3、W、X、Y、Z、M为短周期主族元素,原子序数依次增大,分别位于三个不同短周期,最外层电子数之和为20。Z的最外层电子数与其K层电子数相等,是形成酸雨的物质之一。下列说法不正确的是A、熔点:ZY>ZM B、键角: C、热稳定性: D、分子的极性:
-
4、有机物A经元素分析仪测得有C、H、O三种元素组成,A的质谱、红外光谱、核磁共振氢谱图如下所示。下列关于A的说法不正确的是
 A、所有的原子可能在同一个平面上 B、能与溶液反应放出 C、能发生银镜反应 D、能与酸性溶液反应
A、所有的原子可能在同一个平面上 B、能与溶液反应放出 C、能发生银镜反应 D、能与酸性溶液反应 -
5、下列方程式正确的是A、碳酸钠溶液中通入少量二氧化硫: B、氢氧化铁溶于氢碘酸中: C、乙酰胺在足量盐酸中发生水解反应: D、铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):
-
6、物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
选项
结构或性质
用途
A
金刚石中的碳采取杂化轨道形成共价键三维骨架结构
金刚石可用作地质钻探材料
B
铝是活泼金属,常温下表面易形成致密的氧化膜
用铝粉可通过铝热反应制备金属镁
C
聚乳酸(
 )中含有酯基
)中含有酯基聚乳酸可用于制备可降解塑料
D
1-丁基-3-甲基咪唑六氟磷酸盐(
 )由体积较大的阴、阳离子组成的离子液体,有良好的导电性
)由体积较大的阴、阳离子组成的离子液体,有良好的导电性1-丁基-3-甲基咪唑六氟磷酸盐可被开发为原电池的电解质
A、A B、B C、C D、D -
7、反应 , 下列说法不正确的是A、中S的价态为 B、是氧化产物 C、氧化剂和还原剂的物质的量之比是 D、若消耗时,则反应转移的电子数为(表示阿伏加德罗常数的值)
-
8、化学与人类社会可持续发展息息相关。下列说法正确的是A、用碳原子取代晶体硅中的部分硅原子,可增强晶体的导电性 B、煤的干馏可以得到焦炭、煤油、出炉煤气等主要产品 C、生铁的硬度大,抗压性强,可用于铸造机器底座 D、味精的主要成分是谷氨酸,添加味精可增加食品的鲜味
-
9、利用下列装置和试剂进行实验,下图能达到实验目的的是
 A、图①可用于实验室制 B、图②可用于熔化固体烧碱 C、图③可用于除去中的HCl D、图④可用于向容量瓶转移溶液
A、图①可用于实验室制 B、图②可用于熔化固体烧碱 C、图③可用于除去中的HCl D、图④可用于向容量瓶转移溶液 -
10、下列表示不正确的是A、分子的球棍模型:
 B、HCl中共价键的电子云图:
B、HCl中共价键的电子云图: C、甲基的电子式:
C、甲基的电子式: D、2,3-二甲基丁烷的键线式:
D、2,3-二甲基丁烷的键线式:
-
11、物质的性质决定用途。下列说法正确的是A、具有漂白性,葡萄酒中添加起到漂白作用 B、溶液具有酸性,可用于腐蚀覆铜板制作印刷电路板 C、具有强氧化性,可清洗附在试管内壁的银镜 D、维生素C具有氧化性,可用于水果罐头的抗还原剂
-
12、按物质组成分类,下列物质属于碱的是A、CH3OH B、Cu2(OH)2CO3 C、LiOH D、HCOOH
-
13、已知:A(g)+2B(g)3C(g) ΔH<0,向一恒温恒容的密闭容器中充入1 mol A和2 mol B发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
 A、t2时改变的条件:向容器中加入A B、平衡时B的体积分数φ:φ(II)=φ(I) C、t2~ t3时反应向正方向移动 D、平衡时A(g)的物质的量浓度:c(I)>c(II)
A、t2时改变的条件:向容器中加入A B、平衡时B的体积分数φ:φ(II)=φ(I) C、t2~ t3时反应向正方向移动 D、平衡时A(g)的物质的量浓度:c(I)>c(II) -
14、四氧化三锰()是一种可用于生产锂离子电池正极材料的原料。以天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)为原料制备高纯的工艺流程如图所示。

25℃时,相关金属离子[]形成氢氧化物沉淀的pH范围如下表,当离子浓度小于时,则认为该离子沉淀完全了。
金属离子
开始沉淀的pH
8.1
6.3
1.5
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
10.9
8.2
8.9
回答下列问题:
(1)、“氧化”步骤的主要目的是。(2)、“调pH”时溶液的pH范围应调节为4.7~6.2之间,据此可以得知:的。(3)、“滤渣3”中主要有。(4)、写出“沉锰”时的离子方程式:。(5)、在“沉锰”时,可以额外添加适量氨水促进生成碳酸锰,请你从化学平衡移动的角度解释加入氨水的目的:。(6)、Mn和O可以组成多种氧化物,其中一种氧化物的晶胞如图所示。
①该晶体中Mn的配位数为。
②已知阿伏加德罗常数的值为 , 该晶体的密度(用含a、b的代数式表示)。
-
15、二氧化氯()是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:(1)、的制备:制备的常用方法有两种,分别为法、与反应法。
①法制备的原理为 , X的化学式为 , 将通入溶液中,有红褐色沉淀生成,溶液中的主要阴离子为、 , 若消耗 , 则被氧化的为。
②与反应法制备 , 生成物只有两种,参加反应的与物质的量之比为 , 与法相比,与反应法的优点是(填一条)。
(2)、的用途:除毒、除异味。①可以将剧毒的氰化物氧化成和 , 离子方程式为 , 属于(填“酸”“碱”或“两”)性氧化物,每转移 , 生成L(标准状况下)。
②能把水溶液中有异味的氧化成四价锰,使之形成不溶于水的 , 该反应的离子方程式为。
-
16、A、B、C、D、E为前20号的元素,原子序数逐渐增大。A元素的原子价层电子排布式为;A与C处于同一周期,其中C的第一电离能比同周期相邻元素的小;D、E元素的基态原子都只有一个未成对电子,其中D的电子有9种空间运动状态。下列说法正确的是A、简单氢化物键角: B、简单离子半径: C、同周期元素第一电离能小于C的有4种 D、A与D形成的化合物和C与E形成的化合物中不可能含有非极性共价键
-
17、下图是铜及部分含铜粒子的价荷图。下列推断不合理的是
 A、在酸性环境中,变成需要加氧化剂 B、转化成需要加碱 C、如果将高铜酸根离子()填入坐标,应该填在的位置 D、在酸性环境中,可以歧化成和
A、在酸性环境中,变成需要加氧化剂 B、转化成需要加碱 C、如果将高铜酸根离子()填入坐标,应该填在的位置 D、在酸性环境中,可以歧化成和 -
18、设为阿伏加德罗常数的值。下列说法不正确的是A、溶液与NaOH溶液等体积混合并加热,产生氨气的分子数为 B、标准状况下,和的混合气体总体积约为22.4L C、常温常压下,2.8gCO和的混合气体中含有的分子数为 D、与足量水完全反应,转移的电子数为
-
19、是制备有机合成的重要还原剂的反应物,氢化锂遇水蒸气剧烈反应。某小组设计如图装置制备。下列说法不正确的是
 A、装置中可通过控制盐酸的滴加速度来控制氢气的生成速率 B、装置B,C可依次盛装饱和食盐水、浓硫酸 C、装置E用于吸收尾气,避免污染环境 D、实验中,先通入 , 后点燃酒精灯
A、装置中可通过控制盐酸的滴加速度来控制氢气的生成速率 B、装置B,C可依次盛装饱和食盐水、浓硫酸 C、装置E用于吸收尾气,避免污染环境 D、实验中,先通入 , 后点燃酒精灯 -
20、马来酸(结构如图)常作食品饮料的添加剂、酸味剂。下列叙述错误的是

已知:马来酸的酸性比碳酸强。
A、马来酸有顺、反异构体 B、1mol马来酸含9molσ键 C、1mol马来酸最多能消耗 D、马来酸能使溴水、酸性溶液褪色