相关试卷
-
1、图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法正确的是
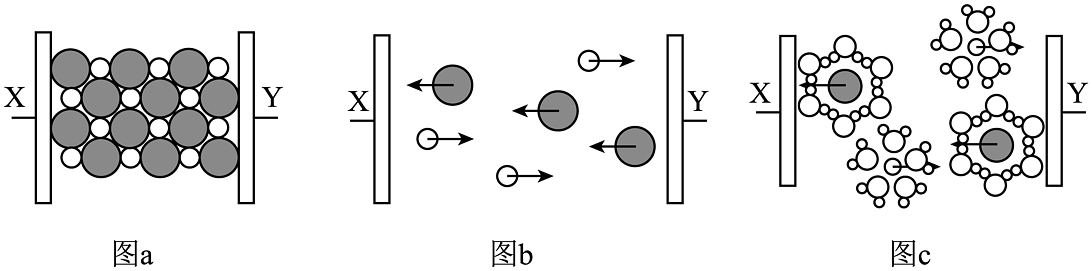 A、图示中
A、图示中 代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在如上图所示三种不同状态下均能导电
代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图b表示熔融状态下氯化钠的导电过程
D、氯化钠在如上图所示三种不同状态下均能导电
-
2、下列有关物质分类的说法正确的是A、CO属于非金属氧化物,同时也是酸性氧化物 B、因为在水中能电离产生 , 所以属于碱 C、因为在水中能电离产生 , 所以属于酸 D、化学式中虽然含4个氢原子,但其属于一元酸
-
3、对下列物质进行的分类正确的是A、在水溶液里或熔融状态下能导电的物质是电解质 B、属于电解质 C、盐类物质一定含有金属阳离子 D、离子方程式可表示石灰乳与稀盐酸的反应
-
4、朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳黑影.……”在这段美文中包含的化学知识正确的是A、荷塘上方的薄雾是灰尘 B、月光通过薄雾产生了丁达尔效应 C、薄雾中的微粒直径大约是2.5pm D、“大漠孤烟直”中的孤烟成分和这种薄雾的成分相同
-
5、传统钦州坭兴陶制备工艺主要包括以下几个步骤:制备坯料→坯体成型→修整坯体→坯体干燥→装饰坯体→烧制坯体→抛光打磨。下列制陶过程中,涉及化学变化的是A、坯体成型 B、坯体干燥 C、烧制坯体 D、抛光打磨
-
6、以甲苯为原料制备羧酸的流程如下:

请回答下列问题:
(1)、X的名称为。Ⅳ中所含官能团的名称为。(2)、Ⅰ的二氯代物有种,其中,在核磁共振氢谱上有3组峰的结构简式有(任写一种)。(3)、根据化合物 的结构特征,分析预测其可能具有的化学性质,完成下表。
的结构特征,分析预测其可能具有的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
, Cu/△
(4)、关于上述Ⅵ→Ⅶ的转化,下列说法正确的有(填标号)。A.有键的断裂与形成
B.有手性碳原子形成
C.C原子杂化方式发生改变
(5)、在一定条件下,利用原子利用率为100%的反应制备 , 则反应物分别为、(填名称)。 (6)、以
, 则反应物分别为、(填名称)。 (6)、以 和
和 为原料合成
为原料合成 , 基于你设计的合成路线回答下列问题。
, 基于你设计的合成路线回答下列问题。①第一步反应的化学方程式为。
②第二步反应的有机产物的结构简式为。
-
7、陈述Ⅰ和Ⅱ均正确但不具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
常温下用铁制容器盛放浓硝酸
铁与浓硝酸不反应
B
三氟乙酸的酸性比三氯乙酸的强
氟的电负性比氯的大
C
水的沸点比硫化氢的高
硫化氢的相对分子质量比水的大
D
碘在水中的溶解度比在中的小
水和四氯化碳的极性不同
A、A B、B C、C D、D -
8、设为阿伏加德罗常数的值。下列叙述正确的是A、含配位键数为 B、的硫酸溶液含氢离子数为 C、10.4gCr含未成对电子数为 D、11.2L(标准状况)HF含电子数为
-
9、“实践出真知”。下列对劳动实践的相关知识解读错误的是
选项
劳动实践
知识解读
A
用紫外线给碗筷消毒
紫外线可使蛋白质变性
B
用食盐水优选种子
利用了浮力原理
C
用碳酸钠溶液洗去油脂
油脂属于有机酸
D
用天然气灶烧开水
天然气燃烧释放能量
A、A B、B C、C D、D -
10、文物是人类智慧的结晶和历史进步的标志。下列广东省博物馆馆藏文物主要由金属材料制成的是
文物


选项
A.战国陶匏壶
B.宋金项饰
文物


选项
C.北宋“林景阳舍”木雕罗汉像
D.明永乐白釉暗花大盘
A、A B、B C、C D、D -
11、化学和生活、科技、社会发展息息相关,下列说法正确的是A、大量开发可燃冰作为新能源有利于实现碳达峰、碳中和 B、“天和”核心舱电推进系统中使用的氮化硼陶瓷基复合材料是新型无机非金属材料 C、华为新上市的mate60pro手机引发关注,其CPU基础材料是 D、光化学烟雾、臭氧层空洞、温室效应的形成都与氮氧化合物有关
-
12、发展绿色甲醇产业有助于减少温室气体排放和空气污染。“零碳甲醇燃料”燃烧[]的过程中焓变和熵变均正确的是A、 B、 C、 D、
-
13、下列叙述中,不正确的是A、胆矾和干冰属于化合物,铁矿石属于混合物 B、转化为的过程为化学变化 C、硫酸氢钠、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 D、通过化学反应,可由一步转化生成NaOH
-
14、用丙烯可将汽车尾气中的还原为除去。主要反应如下:
反应Ⅰ: kJ/mol
反应Ⅱ: kJ/mol
反应Ⅲ:
反应Ⅳ: kJ/mol
则为
A、kJ/mol B、kJ/mol C、kJ/mol D、kJ/mol -
15、某化学实验小组书写的化学式、俗名以及归类完全正确的是A、NaOH、苛性钠、碱 B、C2H5OH、酒精、无机物 C、CO2、干冰、有机物 D、Na2CO3、小苏打、盐
-
16、2023年诺贝尔化学奖颁发给发现和合成量子点的科学家,如图是一种TiO2复合氧化铁量子点,该量子点的粒径范围为40~60nm,可用于高效率降解有机污染物。有关上述材料的说法中错误的是
 A、该量子点属于混合物 B、该量子点中的氧化铁属于碱性氧化物 C、该量子点是一种具有特殊功能的金属材料 D、该量子点分散于水中所得的分散系具有丁达尔效应
A、该量子点属于混合物 B、该量子点中的氧化铁属于碱性氧化物 C、该量子点是一种具有特殊功能的金属材料 D、该量子点分散于水中所得的分散系具有丁达尔效应 -
17、物质的性质决定用途,下列两者对应关系错误的是A、碳酸氢钠受热分解会产生二氧化碳,从而可用作膨松剂 B、与反应均生成 , 可用作供氧剂 C、碱石灰有吸水性,可以用来干燥氧气、氢气等气体 D、溶液可以与NaOH溶液反应生成 , 故采用向饱和的溶液中加入NaOH溶液制备胶体
-
18、
I.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知中铬元素是价,则其中铁元素是价。是一种酸根离子,则属于(填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和溶液共同具备的性质是(填序号),
a.都不稳定,密封放置会产生沉淀 b.二者均有丁达尔效应
c.分散质粒子可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的(填序号)。
A.
 B.
B. C.
C.
(4)现有10mL明胶的水溶液与溶液混合装入半透膜,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明能够透过半透膜:。
Ⅱ.磷元素的含氧酸有(亚磷酸)、(次磷酸)等多种。其中已知:。回答下列问题:
(5)中磷元素的化合价是;上述反应(填“属于”或“不属于”)氧化还原反应。属于(选填“一”“二”或“三”)元酸。
-
19、在生产生活中有广泛的用途,根据以下有关的反应回答下列问题:(1)、在下列反应中,作还原剂的是(填序号,下同),作氧化剂的是。
① ②
③ ④
(2)、用双线桥法表示出反应①中电子转移的方向和数目。(3)、将反应①改写为离子方程式。(4)、下列变化中,涉及氧化还原反应的是(填序号)。①钢铁的锈蚀 ②食物的腐烂 ③澄清石灰水变浑浊
(5)、4种基本类型的反应中,一定是氧化还原反应的是 , 一定不是氧化还原反应的是。 -
20、
Ⅰ.写出下列反应的离子方程式:
(1)鸡蛋壳(主要成分为碳酸钙)溶解在醋酸中:。(2)溶液与溶液混合:。(3)AlCl3加入氨水产生白色沉淀:。Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其中可能含有中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2mL该溶液用溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(4)原溶液中一定存在的离子是 , 一定不存在的离子是。(5)按上述实验操作,(填“能”或“不能”)确定原溶液中有 , 若不能请说明原因:。