相关试卷
-
1、无放射性的同位素被称之为“稳定同位素”,在陆地生态系统研究中,2H、13C、15N、18O、34S等常作环境分析指示物。下列有关一些“稳定同位素”的说法正确的是A、34S原子核内中子数为16 B、2H、3H属于同种核素 C、16O与18O最外层电子数相同 D、13C和15N原子核内的质子数相差2
-
2、干冰升华过程中,其焓变和熵变正确的是A、 , B、 , C、 , D、 ,
-
3、某溶液中含有Na+、CO、HCO、Cl- , 在加入Na2O2后浓度不发生变化的是A、Na+、CO B、Cl- C、CO、Cl- D、HCO
-
4、实验室用和浓盐酸反应生成后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
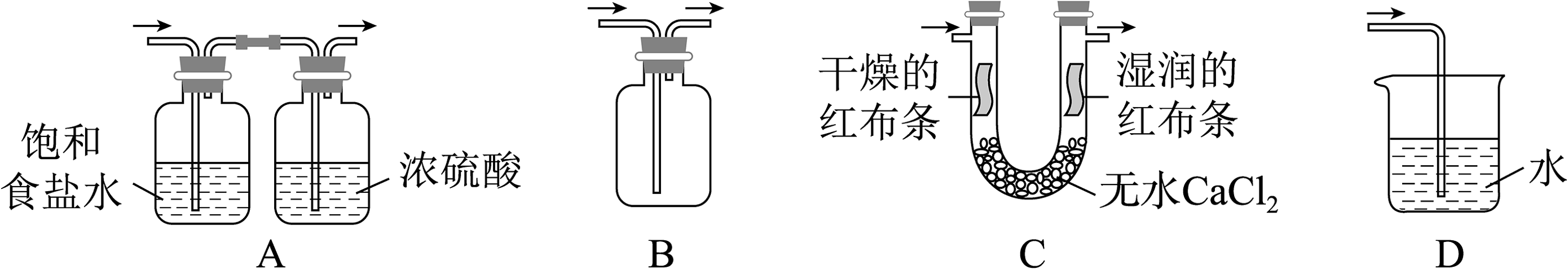 A、A B、B C、C D、D
A、A B、B C、C D、D -
5、下列关于化合物
 的说法正确的是 A、与苯互为同系物 B、可以发生取代、加成、加聚反应 C、分子中所有原子可能共平面 D、一氯代物有4种(不考虑立体异构)
的说法正确的是 A、与苯互为同系物 B、可以发生取代、加成、加聚反应 C、分子中所有原子可能共平面 D、一氯代物有4种(不考虑立体异构) -
6、部分含或含物质的分类与相应化合价关系如图所示。下列推断不合理的是
 A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键
A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键 -
7、常温下,将体积均为的HA溶液和BOH溶液分别加水稀释至V,溶液的pH随的变化如图所示。已知 , 下列说法正确的是
 A、电离常数: B、水的电离程度:b>d C、升温,a点溶液中增大 D、等浓度HA和BOH溶液等体积混合,溶液的pH<7
A、电离常数: B、水的电离程度:b>d C、升温,a点溶液中增大 D、等浓度HA和BOH溶液等体积混合,溶液的pH<7 -
8、氮氧化物、二氧化硫能引发酸雨、雾霾等。回答下列问题:(1)、汽车尾气催化转化器可将尾气中的CO、NO均转化为无害气体,该反应的化学方程式为。(2)、目前工业上烟气脱硫脱硝的工艺流程如下:

已知:烟气中含尘、、。
“催化氧化”的目的是;图中产品中含硫成分为(填化学式)。该物质中含有键(填化学键类型),写出该物质的一种用途。
(3)、为探究某种催化剂在有氧条件下用还原的最佳温度,将一定比例的、和混合,以一定的流速通过催化还原反应器[如图(a)],反应相同时间后测得的去除率随反应温度的变化曲线如图(b)所示。
①写出催化反应器中与反应的化学方程式:。
②当反应温度高于380℃时,的去除率迅速下降的原因可能是。
-
9、将NaCl固体溶于水后,溶液中存在多种微粒,如图所示的微粒是
 A、聚合水分子 B、水合钠离子 C、水合氯离子 D、水合氢离子
A、聚合水分子 B、水合钠离子 C、水合氯离子 D、水合氢离子 -
10、将下列各组物质按单质、酸性氧化物、酸、碱、盐分类顺序排列,其中正确的是A、液氮、七氧化二锰、硫酸、烧碱、小苏打 B、碘酒、冰、硫酸氢钠、烧碱、碳酸钙 C、氢气、一氧化碳、硝酸、纯碱、胆矾 D、铜、干冰、醋酸、石灰水、氯化铜
-
11、下列关于电化学装置的叙述中正确的是
 A、图1所示装置可实现将设计成原电池 B、图2所示电池放电过程中,负极的质量逐渐减少 C、图3所示装置可实现在铁表面镀铜 D、图4所示装置工作过程中,电解质溶液中浓度始终不变
A、图1所示装置可实现将设计成原电池 B、图2所示电池放电过程中,负极的质量逐渐减少 C、图3所示装置可实现在铁表面镀铜 D、图4所示装置工作过程中,电解质溶液中浓度始终不变 -
12、将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为A、0.02 mol/L B、0.03 mol/L C、0.05 mol/L D、0.3 mol/L
-
13、氢化钠可在野外用作生氢剂,其中氢元素为价.用作生氢剂时的化学反应原理为: . 下列有关该反应的说法中,正确的是A、该反应属于置换反应 B、该反应属于复分解反应 C、中的氢元素被还原 D、是氧化剂
-
14、短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是A、原子半径:Y>X,离子半径Z<W B、元素X、Z、W的最高价氧化物的水化物的酸性:X<Z<W C、元素Y和W能形成YW2型离子化合物 D、W的单质有毒,能使湿润的有色布条褪色
-
15、某学习小组需0.1000mol·L-1的碳酸钠溶液450mL。下列有关说法正确的是A、称量前应将Na2CO3·xH2O灼烧至恒重,冷却后称量 B、配制时需用托盘天平称取4.8g无水碳酸钠 C、配制前容量瓶必须干燥 D、配制定容时俯视容量瓶刻度线会使配制溶液的物质的量浓度偏高
-
16、下列离子的检验方法合理的是A、向某溶液中加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,则该溶液中一定有SO42- B、向某溶液中滴加氯水,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+ C、向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ D、向某溶液中加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-
-
17、下列反应的离子方程式书写不正确的是A、KI溶液久置空气中变黄色:4I-+O2+2H2O=2I2+4OH- B、氢氧化钠吸收少量二氧化碳:OH-+CO2= C、制印刷电路板常用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=2Fe2++Cu2+ D、氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++=CaCO3↓+H2O
-
18、下列各组离子,能大量共存的是A、Na+、、ClO-、H+ B、Al3+、H+、Fe2+、 C、Na+、、OH-、 D、K+、Fe3+、、I-
-
19、使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是

选项
A
B
C
D
试剂a
CuSO4
NH4HCO3
H2SO4
CH3COOH
试剂b
Ba(OH)2
Ca(OH)2
Ba(OH)2
NH3·H2O
A、A B、B C、C D、D -
20、已知:(HF)2(g)2HF(g) >0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
 A、温度:T1<T2 B、反应速率:v(b)<v(a) C、平衡常数:K(a)=K(b)<K(c) D、当时,
A、温度:T1<T2 B、反应速率:v(b)<v(a) C、平衡常数:K(a)=K(b)<K(c) D、当时,