相关试卷
-
1、利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应以1为原料合成V,催化机理如下。下列说法错误的是
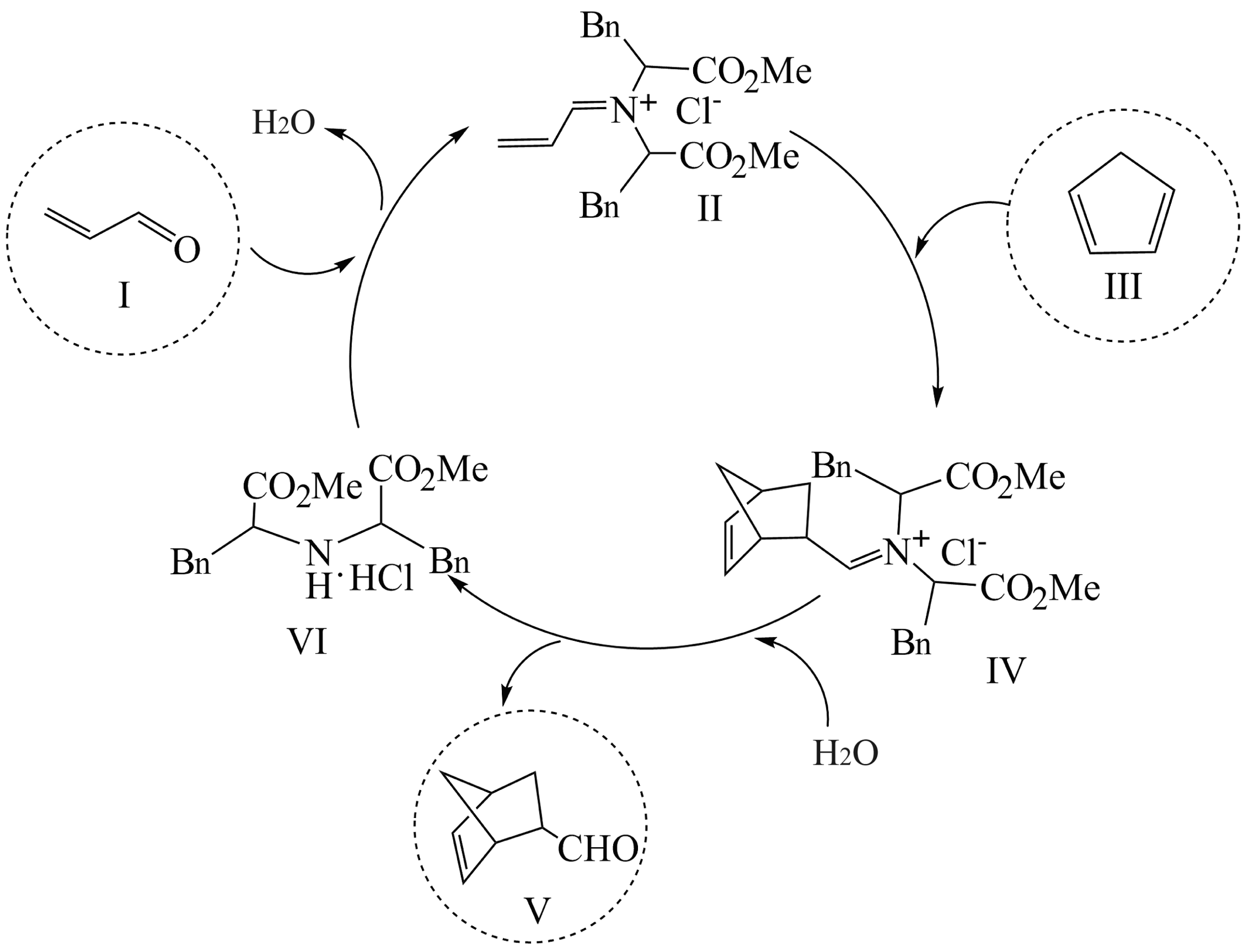 A、V的分子式为 B、总反应是:I+Ⅲ→V C、I和V互为同系物 D、Ⅵ是反应的催化剂
A、V的分子式为 B、总反应是:I+Ⅲ→V C、I和V互为同系物 D、Ⅵ是反应的催化剂 -
2、一种在航空航天、国防军工等领域具有应用前景的液晶聚芳酯G可由如下反应制备,下列说法错误的是
 A、 , 化合物X为乙酸 B、化合物E的核磁共振氢谱上共有4种H C、反应说明化合物F可发生缩聚反应 D、聚芳酯G可与NaOH溶液反应
A、 , 化合物X为乙酸 B、化合物E的核磁共振氢谱上共有4种H C、反应说明化合物F可发生缩聚反应 D、聚芳酯G可与NaOH溶液反应 -
3、下列关于实验操作与预期的现象及结论描述不合理的是
选项
实验操作
预期现象及结论
A
往盛有1mL溴乙烷的试管中滴入2滴溶液
产生浅黄色沉淀,说明溴乙烷在水中能电离出
B
向新制的中滴入少量葡萄糖溶液并加热
产生砖红色沉淀,说明葡萄糖含醛基
C
将少量乙酸乙酯加入NaOH溶液中,加热
出现分层,加热一段时间后酯层消失,说明乙酸乙酯可在碱性条件下水解
D
向盛有2mL鸡蛋清溶液的试管中加入5滴浓硝酸,加热
产生白色沉淀,加热后沉淀变黄色,说明鸡蛋清的蛋白质含有苯环
A、A B、B C、C D、D -
4、已知某多肽分子结构如图,下列说法正确的是
 A、该多肽可发生取代反应 B、该多肽含4个肽键,为四肽 C、该多肽水解后可得到5种氨基酸 D、1mol该多肽最多能与2molNaOH反应
A、该多肽可发生取代反应 B、该多肽含4个肽键,为四肽 C、该多肽水解后可得到5种氨基酸 D、1mol该多肽最多能与2molNaOH反应 -
5、连花清瘟胶囊的有效成分大黄素有很强的抗炎抗菌药理活性,其结构如图所示。关于大黄素的说法正确的是
 A、该物质属于芳香烃 B、该分子中含3种官能团 C、该物质不能发生取代反应 D、1mol该物质最多能与3mol氢氧化钠反应
A、该物质属于芳香烃 B、该分子中含3种官能团 C、该物质不能发生取代反应 D、1mol该物质最多能与3mol氢氧化钠反应 -
6、宏观辨识与微观探析是化学学科核心素养之一,下列物质实验对应的反应方程式书写正确的是
选项
实验操作
反应方程式
A
往苯酚溶液中加入饱和溴水
 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBrB
乙酸、乙醇、浓硫酸混合后加热
C
向苯酚钠溶液中通入二氧化碳气体
2
 +CO2+H2O→2
+CO2+H2O→2 +Na2CO3
+Na2CO3D
苯与浓硫酸混合,加热至在70~80℃
 +H2SO4(浓)
+H2SO4(浓) +H2OA、A B、B C、C D、D
+H2OA、A B、B C、C D、D -
7、乙苯、苯乙烯是重要的工业原料,可发生反应:
 。下列相关分析正确的是 A、I→Ⅱ属于取代反应 B、可以用溴水鉴别I和Ⅱ C、I和Ⅱ都属于苯的同系物 D、I和Ⅱ中所有碳原子都不可能共平面
。下列相关分析正确的是 A、I→Ⅱ属于取代反应 B、可以用溴水鉴别I和Ⅱ C、I和Ⅱ都属于苯的同系物 D、I和Ⅱ中所有碳原子都不可能共平面 -
8、将某电镀工艺中的阳极泥(主要含Se和)在空气中煅烧,得铜、硒的氧化物,用还原可得硒,已知S和Se同主族,晶胞结构如图所示,下列说法不正确的是
 A、X为 B、分子是直线形分子 C、晶胞中Se2—的配位数为8 D、煅烧时,可能发生反应:
A、X为 B、分子是直线形分子 C、晶胞中Se2—的配位数为8 D、煅烧时,可能发生反应: -
9、一种“Al-空气”电池在碱性电解质中的总反应为: , 其中的中心离子与配体形成的空间构型为正四面体,下列说法正确的是A、Al位于周期表中ds区 B、的空间构型是V形 C、1mol中含有9mol电子 D、中Al原子采取杂化
-
10、节日里燃放的烟花,一般用黑火药(主要成分为、C、S等)作起爆药剂,烟花颜色则是各种金属(如Na等)的焰色。下列说法不正确的是A、S原子的最高能层有4个电子 B、C的基态原子价层电子轨道表示式为:
 C、Na的基态原子的核外电子排布式为:
D、金属的焰色试验利用了原子核外电子跃迁释放能量的原理
C、Na的基态原子的核外电子排布式为:
D、金属的焰色试验利用了原子核外电子跃迁释放能量的原理
-
11、引入官能团是有机合成的重要环节。下列方法不能在碳链上引入羟基的是A、在酸性条件加热水解 B、与在催化剂作用下加热反应 C、与在一定条件下反应 D、在NaOH的水溶液中加热反应
-
12、我国科学家在青蒿素的研究中做出巨大贡献。下列说法不正确的是A、X射线衍射技术可用于青蒿素晶体结构的测定 B、通过元素分析和质谱法分析,可确定青蒿素的分子式 C、经红外光谱和核磁共振氢谱分析,可确定青蒿素分子的官能团 D、“青蒿一握,以水二升渍,绞取汁”,指的是用蒸馏法提取青蒿素
-
13、下列说法不正确的是A、橡胶硫化后可由线型结构转变为网状结构 B、蛋白质、淀粉、纤维素和油脂都能发生水解 C、氨基酸既能与盐酸反应,也能与NaOH溶液反应 D、通过煤的液化可获得液态烃等有机物,煤的液化过程为物理变化
-
14、近期我国科技工作者研发了一种“酸碱混合硝酸”锌电池,其工作原理如图所示。图中“双极膜”中间层中的解离为和 , 并在电场作用下分别向两极迁移。下列说法错误的是
 A、膜是阴离子交换膜,膜是阳离子交换膜 B、催化电极上的电势比锌电极上的高 C、负极区的反应式为 D、当正极区的变化为时,锌电极质量会减少
A、膜是阴离子交换膜,膜是阳离子交换膜 B、催化电极上的电势比锌电极上的高 C、负极区的反应式为 D、当正极区的变化为时,锌电极质量会减少 -
15、已知为阿伏加德罗常数,下列关于说法正确的是A、标准状况下22.4L HF含有分子的个数为 B、1mol液态冰醋酸中含s-p键的数目为4 C、往溶液中通入氯气,若有1mol生成时,转移电子的数目可能为4 D、常温下已知 , 则该温度下饱和溶液中含有个
-
16、乙醇燃料电池广泛应用于微型电源、能源汽车、家用电源、国防等领域,工作原理如图所示,电池总反应为: , 下列说法错误的是
 A、和通入的一极为负极 B、正极反应式为 C、负极反应式为 D、从正极经传导质子的固体膜移向负极
A、和通入的一极为负极 B、正极反应式为 C、负极反应式为 D、从正极经传导质子的固体膜移向负极 -
17、近来有报道,碘代化合物F与化合物Ⅰ在Cr-Ni化下可以发生偶联反应,合成一种多官能团的化合物J,其合成路线如下:
 (1)、指出D中的含氧官能团,分析预测其可能的化学性质,完成下表:
(1)、指出D中的含氧官能团,分析预测其可能的化学性质,完成下表:官能团名称
可反应试剂
反应类型
(2)、物质G的名称。(3)、E→F的反应方程式。(4)、J的分子式。(5)、下列说法错误的是_______。A、一定条件下G能与新制Cu(OH)2反应产生砖红色沉淀 B、1mol H最多能与5mol H2发生加成反应 C、试剂D与足量乙醇充分反应,转化率可以达到100% D、物质J不能使酸性 KMnO4溶液褪色(6)、满足下列条件H的同分异构体有种,写出其中一种的结构简式。①遇FeCl3 发生显色反应;②苯环上有三个取代基。
(7)、结合所学知识,仿照G合成I路线,以乙醇为原料制备1-丁醛。 -
18、利用光催化技术可将太阳能转化为化学能。(1)、光催化可实现的净化
①比较N、O元素第一电离能:NO(填“>”或“小于”)。
②光催化还原可得到 , 从结构角度分析性质稳定的原因。
③光催化氧化最终产物为硝酸盐,的空间结构是形。
(2)、光催化和合成甲醇是转化利用最有前景的途径之一。比较甲醇分子中H-C-H与C-O-H的键角大小并解释原因。(3)、光催化可降解苯酚()。在紫外光的作用下催化剂表面有(羟基自由基)生成,可将苯酚氧化为和 , 该反应的方程式为。(4)、某含钛的复合型物质可作光催化剂,晶胞结构如图所示,边长均为。
①基态钛原子的价层电子轨道表示式为。
②晶体中每个钛原子周围与其距离最近且相等的氧原子的个数是。
③表示阿伏加德罗常数的值,则该晶体的密度为。
-
19、铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的氧化物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在;最高价钒酸根在酸性介质中以存在,在碱性介质中以存在。回答下列问题:
(1)、铬的基态价电子轨道表示式为。(2)、“煅烧”步骤钒和铬被氧化为相应的最高价含氧酸盐,其化学式分别为、。(3)、水浸渣中主要成分为 , “沉淀”步骤调pH到弱碱性,所得滤渣Ⅰ为 。(4)、“除硅磷”步骤所得滤渣Ⅱ成分为MgSiO3、MgNH4PO4 , 该步骤需控制溶液pH≈9以达到最好的除杂效果,原因是。(5)、“分离钒”步骤调pH 到弱酸性,若酸性太强,V2O5可溶于稀硫酸,反应的化学方程式为。(6)、“还原”步骤中加入 Na2S2O5溶液还原 , 反应的离子方程式为。已知 25℃时,Cr(OH)3的 , 为了使 Cr3+沉淀完全,溶液的 pH 应调至。 -
20、苯甲酸广泛应用于制药和化工行业,实验室可通过甲苯氧化制苯甲酸。
反应原理:

制备装置及相关信息:

苯甲酸
相对分子质量
122
熔点
122.4℃
水中溶解度
25℃:0.3g
95℃:6.9g
实验方法:将甲苯和KMnO4溶液加热回流一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
 (1)、制备装置中仪器a的名称为 , 主要作用是。(2)、操作Ⅰ为 , 操作Ⅱ为 , 无水Na2SO4的作用是 , 无色液体A是。(3)、测定白色固体B 的熔点,发现其在 115℃开始熔化,达到 130℃时仍有少量不熔。推测白色固体B是苯甲酸与的混合物,进一步提纯苯甲酸的方法为。(4)、提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作是。(5)、将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 Cu(OH)2搅拌,过滤,滤液静置一段时间,可获得有机合成常用的催化剂苯甲酸铜,混合溶剂中乙醇的作用是 。(6)、称取1.220g产品,配成100mL 甲醇溶液,每次移取 25.00mL 溶液。用 0.1000mol/L 的 KOH 标准溶液滴定,三次滴定平均消耗23.45mL的KOH标准溶液。产品中苯甲酸质量分数为(保留三位有效数字)。
(1)、制备装置中仪器a的名称为 , 主要作用是。(2)、操作Ⅰ为 , 操作Ⅱ为 , 无水Na2SO4的作用是 , 无色液体A是。(3)、测定白色固体B 的熔点,发现其在 115℃开始熔化,达到 130℃时仍有少量不熔。推测白色固体B是苯甲酸与的混合物,进一步提纯苯甲酸的方法为。(4)、提纯时,往往要洗涤苯甲酸,检验苯甲酸是否洗涤干净的操作是。(5)、将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 Cu(OH)2搅拌,过滤,滤液静置一段时间,可获得有机合成常用的催化剂苯甲酸铜,混合溶剂中乙醇的作用是 。(6)、称取1.220g产品,配成100mL 甲醇溶液,每次移取 25.00mL 溶液。用 0.1000mol/L 的 KOH 标准溶液滴定,三次滴定平均消耗23.45mL的KOH标准溶液。产品中苯甲酸质量分数为(保留三位有效数字)。