相关试卷
-
1、柠檬酸(用表示)是一种有机三元弱酸,广泛存在于水果中。25℃时,用NaOH调节溶液的pH,溶液中各种微粒的分布系数与pH的关系如图所示[比如的分布系]。下列叙述错误的是
 A、溶液显酸性,溶液显碱性 B、曲线Ⅰ代表 , 曲线Ⅳ代表 C、溶液中: D、反应的
A、溶液显酸性,溶液显碱性 B、曲线Ⅰ代表 , 曲线Ⅳ代表 C、溶液中: D、反应的 -
2、氨催化氧化时会发生如下反应:
反应Ⅰ:
反应Ⅱ:
现将、充入1L恒容密闭容器中,在合金催化剂作用下反应模拟“氮催化氧化法”生产NO,相同时间内有关含氮生成物(假设只有两种)物质的量随温度变化曲线如图所示。已知:。

下列说法错误的是
A、由图可知,氨催化氧化生成NO的最佳温度为840℃ B、520℃时,的有效转化率约为33.3% C、对反应Ⅱ,当时,说明反应达到平衡状态 D、840℃后,NO物质的量下降的原因可能是催化剂活性降低 -
3、钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。钛酸钡的晶胞结构如图所示。下列说法错误的是
 A、Ti元素位于元素周期表的d区 B、该物质的化学式为 C、晶体中每个钛离子周围等距且最近的氧离子数目为6 D、若位于晶胞的体心,位于晶胞的顶点,则处于立方体的位置是棱心
A、Ti元素位于元素周期表的d区 B、该物质的化学式为 C、晶体中每个钛离子周围等距且最近的氧离子数目为6 D、若位于晶胞的体心,位于晶胞的顶点,则处于立方体的位置是棱心 -
4、化学学习中,离子反应能帮助我们理解化学反应机理,揭示化学反应规律。下列实验事实与对应的离子方程式不相符的是A、向溶液中通入足量: B、用溶液除去水垢中的: C、海水提溴过程中,用氯气氧化苦卤得到溴单质: D、向溶液中逐滴滴加溶液至刚好沉淀完全:
-
5、我国科技工作者设计了如图所示的可充电电池,以为电解质,电解液中加入1,3-丙二胺(PDA)以捕获。该设计克服了导电性差和释放能力差的不足,同时改善了的溶剂化环境。下列说法错误的是
 A、放电时,Mg电极上的电极反应式为 B、充电时,多孔碳纳米管电极与电源正极连接 C、充电时,从多孔碳纳米管电极迁移至Mg电极 D、放电时,每转移2mol电子,理论上可转化
A、放电时,Mg电极上的电极反应式为 B、充电时,多孔碳纳米管电极与电源正极连接 C、充电时,从多孔碳纳米管电极迁移至Mg电极 D、放电时,每转移2mol电子,理论上可转化 -
6、合理用药能提升人们的健康水平。下列关于常见药物的实验方法或操作不能达到实验目的的是
选项
实验目的
实验方法或操作
A
检验补血剂片是否变质
将补血剂片去糖衣,研细,加稀硫酸配成溶液,滴入几滴新制氯水,再滴加KSCN溶液,观察溶液变成血红色
B
除去苯甲酸中混有的氯化钠杂质
重结晶
C
检验葡萄糖中含有醛基
在试管中加入新制的 , 振荡后加入0.5mL葡萄糖溶液,加热,产生砖红色沉淀
D
检验阿司匹林片(主要成分为
 )中的酯基
)中的酯基在阿司匹林清液中滴入2滴稀硫酸,加热后滴入几滴溶液,振荡;再向其中滴入几滴溶液,振荡,观察溶液变成紫色
A、A B、B C、C D、D -
7、硫酸是重要化工原料,工业生产制取硫酸的原理如图。下列说法正确的是
 A、流程中涉及的反应均为氧化还原反应 B、Ⅱ中的反应条件都是为了提高的平衡转化率 C、将黄铁矿换成硫黄可以减少废渣的产生 D、上述生产过程中无需进行尾气处理
A、流程中涉及的反应均为氧化还原反应 B、Ⅱ中的反应条件都是为了提高的平衡转化率 C、将黄铁矿换成硫黄可以减少废渣的产生 D、上述生产过程中无需进行尾气处理 -
8、已知:
 。设为阿伏加德罗常数的值,下列说法正确的是 A、中含有的中子数为 B、溶液中含有的数为 C、1mol
。设为阿伏加德罗常数的值,下列说法正确的是 A、中含有的中子数为 B、溶液中含有的数为 C、1mol 分子中含有的键数为
D、1molNa与足量
分子中含有的键数为
D、1molNa与足量 反应,转移电子数为
反应,转移电子数为
-
9、儿茶酸具有抗菌、抗氧化作用,常用于治疗烧伤、小儿肺炎等疾病,可采用如图所示路线合成。下列说法正确的是
 A、X分子中所有原子不可能共平面 B、Y的分子式为 C、不可用浓溴水鉴别X和Z D、1molZ可与发生加成反应
A、X分子中所有原子不可能共平面 B、Y的分子式为 C、不可用浓溴水鉴别X和Z D、1molZ可与发生加成反应 -
10、短周期主族元素X、Y、Z、W的原子序数依次增大;X是地壳中含量最高的元素;Y的氧化物X是光导纤维的主要成分;基态W原子的电子总数是其最高能级电子数的4倍。下列说法错误的是A、第一电离能:Z>W>Y B、简单离子还原性:Z>W>X C、原子半径:Y>W>X D、最高价含氧酸的酸性:Y>Z>W
-
11、某学习小组用醋酸钠固体和浓硫酸共热快速制备醋酸,配制高纯度醋酸溶液,并测定中和热。下列实验操作正确的是


A.醋酸钠固体和浓硫酸共热制醋酸
B.配制一定物质的量浓度的醋酸溶液


C.用NaOH标准溶液滴定未知浓度的醋酸溶液
D.测定醋酸与NaOH反应的中和热
A、A B、B C、C D、D -
12、物质结构决定其性质。下列有关物质结构和性质的描述中,错误的是A、水结成冰密度减小与水分子之间能形成氢键有关 B、利用冠醚识别碱金属离子的特性分离、传递特定离子 C、杂化轨道中s轨道所占百分率: D、氟的电负性大于氯的电负性,使三氟乙酸的酸性小于三氯乙酸的酸性
-
13、实验室制备少量氮气的反应为。下列与该反应有关的化学用语表述错误的是A、基态N原子的价层电子的轨道表示式为
 B、的电子式为
B、的电子式为 C、NaCl的形成过程可表示为
C、NaCl的形成过程可表示为 D、的VSEPR模型为
D、的VSEPR模型为
-
14、碳元素在生产生活及新物质的制备中均具有非常重要的作用。下列关于碳及其化合物的叙述错误的是A、酿制米酒需要添加酒曲作催化剂 B、推广使用新能源汽车可有效减少碳排放 C、我国自主研发的某飞机机身材料使用的碳纤维和环氧树脂属于无机非金属材料 D、横州出土的“鸟纹变形羽人纹铜鼓”表面的铜绿主要成分是碱式碳酸铜
-
15、对于A2+3B2
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( ) A、v(B2)=0.8mol/(L·s) B、v(A2)=0.4mol/(L·s) C、v(C)=0.6mol/(L·s) D、v(B2)=4.2mol/(L·min)
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( ) A、v(B2)=0.8mol/(L·s) B、v(A2)=0.4mol/(L·s) C、v(C)=0.6mol/(L·s) D、v(B2)=4.2mol/(L·min) -
16、一定条件下的密闭容器中: , 平衡时测得A的浓度为0.50 mol/L。保持温度不变,将容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30 mol/L。下列说法正确的是A、 B、平衡向正反应方向移动 C、B的浓度增大 D、C的体积分数减小
-
17、化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是A、将肉类食品进行低温冷藏,能使其永远不会腐败变质 B、在化学工业中,选用催化剂一定能提高反应物的转化率 C、夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 D、茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
-
18、化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:(1)、煤气化过程如下:
反应1:
反应2:
反应3:
①。
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为;使用催化剂,(填“能”或“不能”)改变a的值。
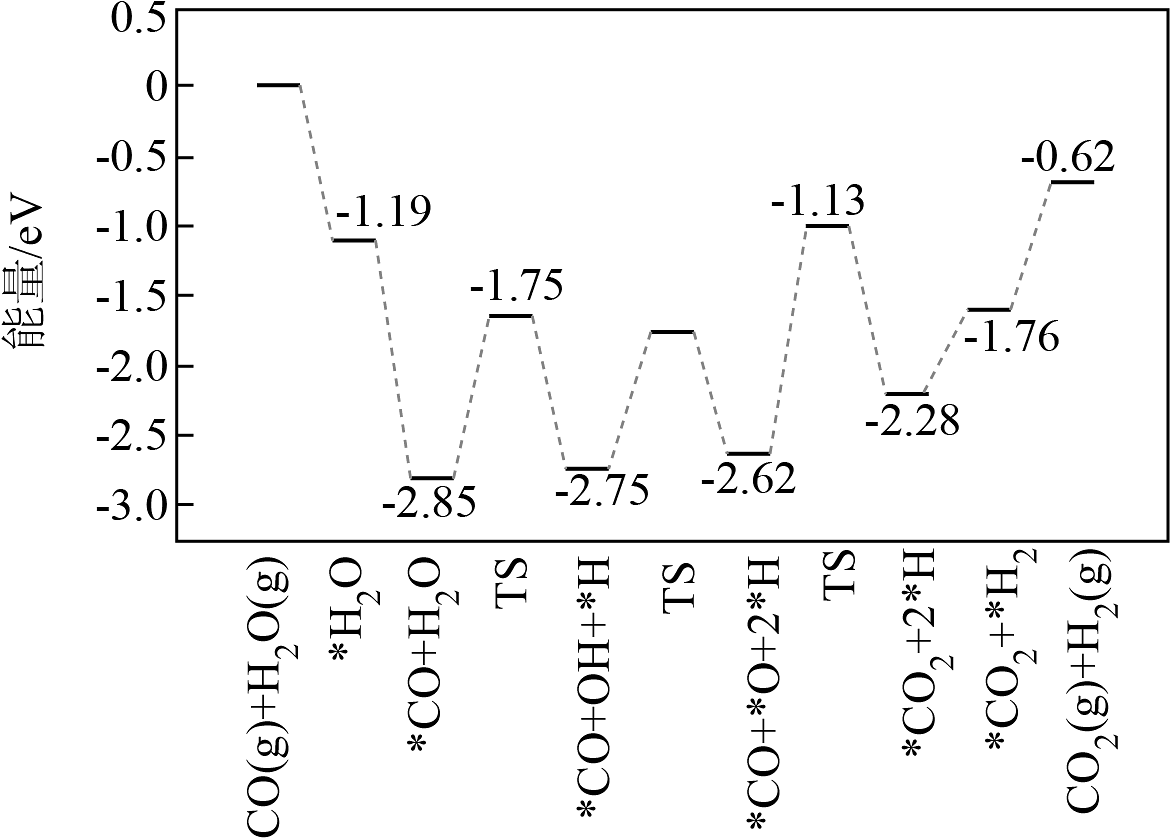 (2)、在一定温度下,向某恒容容器中充入和 , 仅发生反应: 。
(2)、在一定温度下,向某恒容容器中充入和 , 仅发生反应: 。下列情况表明反应已达到平衡状态的是___________(填标号)。
A、的体积分数保持不变 B、混合气体的平均摩尔质量保持不变 C、的转化率保持不变 D、与的物质的量之比不再改变(3)、向2L的恒容密闭容器中充入 , 发生反应: 。其他条件不变时,的平衡转化率随着温度(T)的变化如图所示。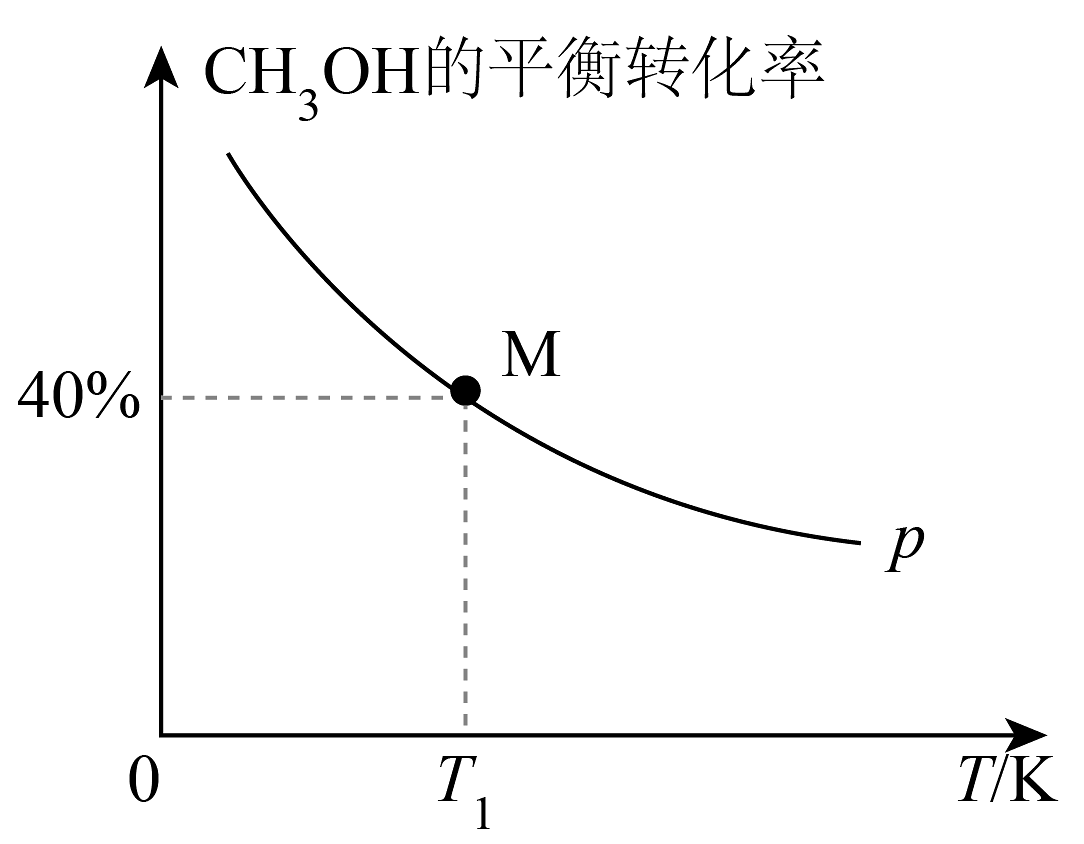
①欲提高的平衡转化率且加快反应速率,下列措施可能有效的是(填标号)。
a.降低温度并及时分离出产物 b.加入合适的催化剂并分离出产物
c.再向容器中充入 d.适当降低温度并加入合适的催化剂
②时,初始压强 , 反应经过20min达到平衡,用表示该段时间内的平均速率为 , 该温度下的平衡常数(用精确到小数点后两位);该温度下,改变投料,某时刻容器内、、 , 则此时(填“>”、“<”或“=”)。
-
19、过量与以下的溶液反应,下列总反应方程式错误的是
溶液
现象
化学方程式
A
产生淡黄色沉淀
B
溶液由棕黄色变浅绿色
C
溶液褪色,产生白色沉淀
D
(含酚酞)
溶液由红色变无色
A、A B、B C、C D、D -
20、已知反应过程a、b如下图所示,下列说法正确的是
 A、E1表示反应过程a的活化能 B、 C、加入催化剂的反应过程为a D、反应过程b的有效碰撞次数小于a
A、E1表示反应过程a的活化能 B、 C、加入催化剂的反应过程为a D、反应过程b的有效碰撞次数小于a