相关试卷
-
1、下列各组物质在溶液中反应,无论少量过量均不可用同一离子方程式表示的是A、Cu(OH)2和硫酸;Cu(OH)2和CH3COOH B、BaCl2和Na2SO4;Ba(OH)2和K2SO4 C、NaHCO3和NaHSO4;NaHCO3和HCl D、NaHSO4和Ba(OH)2;硫酸和Ba(OH)2
-
2、硫酸盐(含、)气溶胶是PM2.5的成分之一、近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
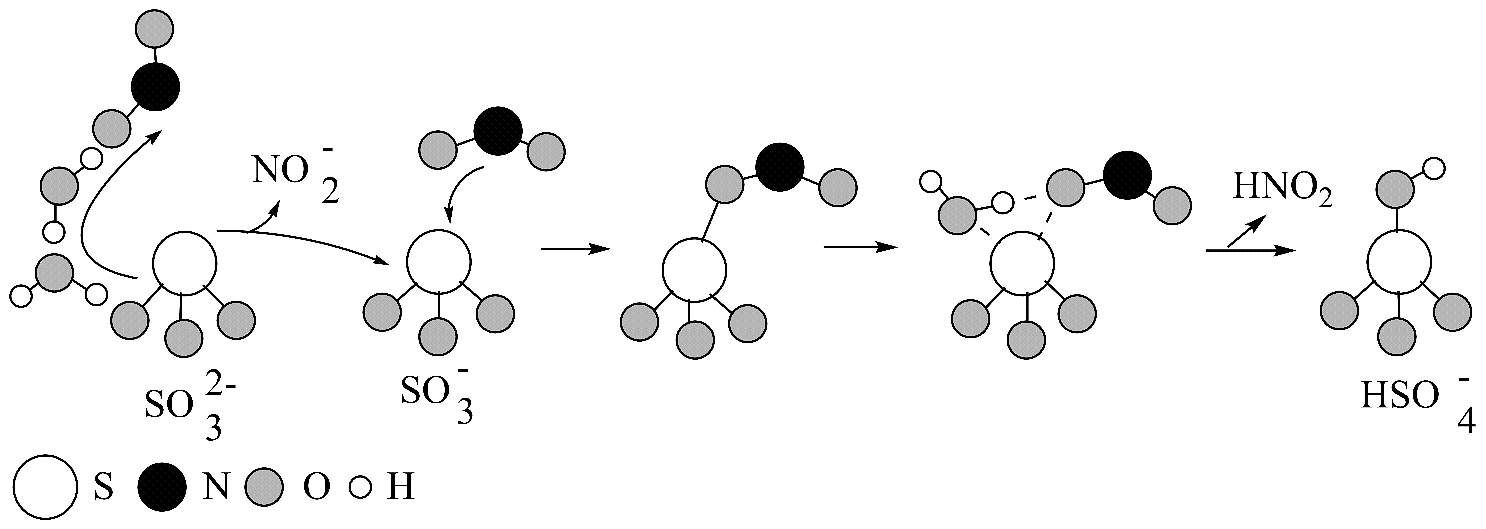
下列说法不正确的是
A、该过程有参与 B、是生成硫酸盐的氧化剂 C、硫酸盐气溶胶呈中性 D、过程中硫元素化合价升高 -
3、下列氧化还原反应中,电子转移的方向和数目均正确的是A、
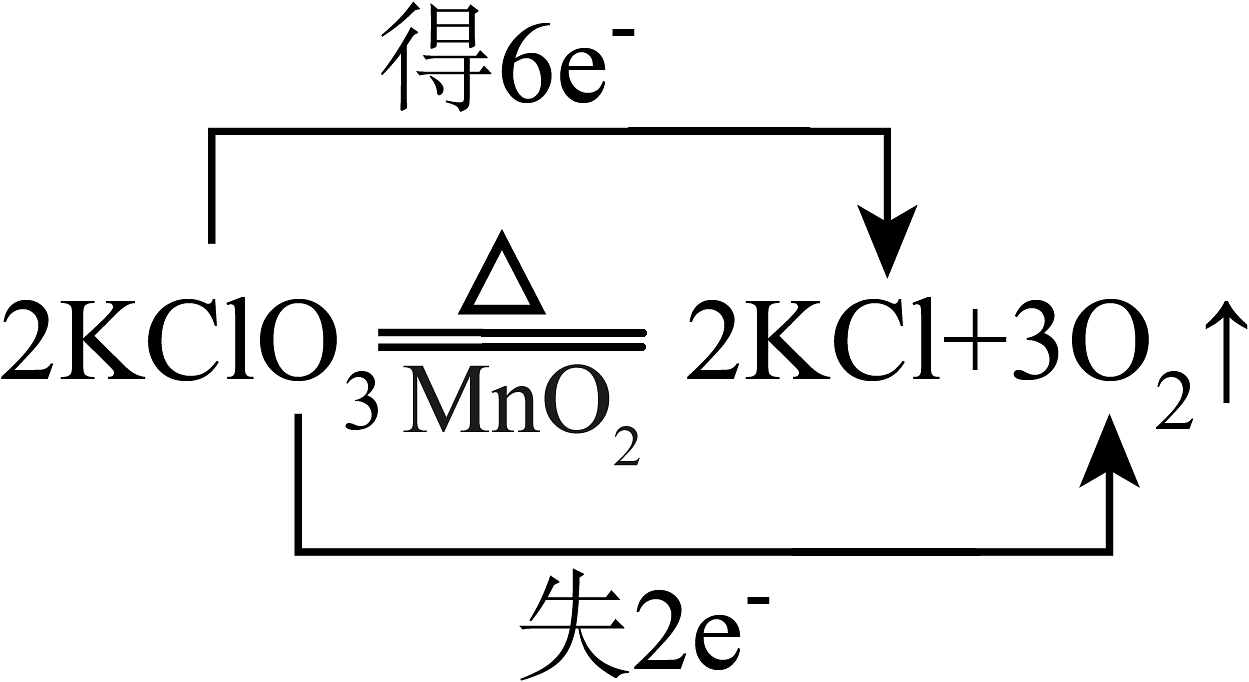 B、
B、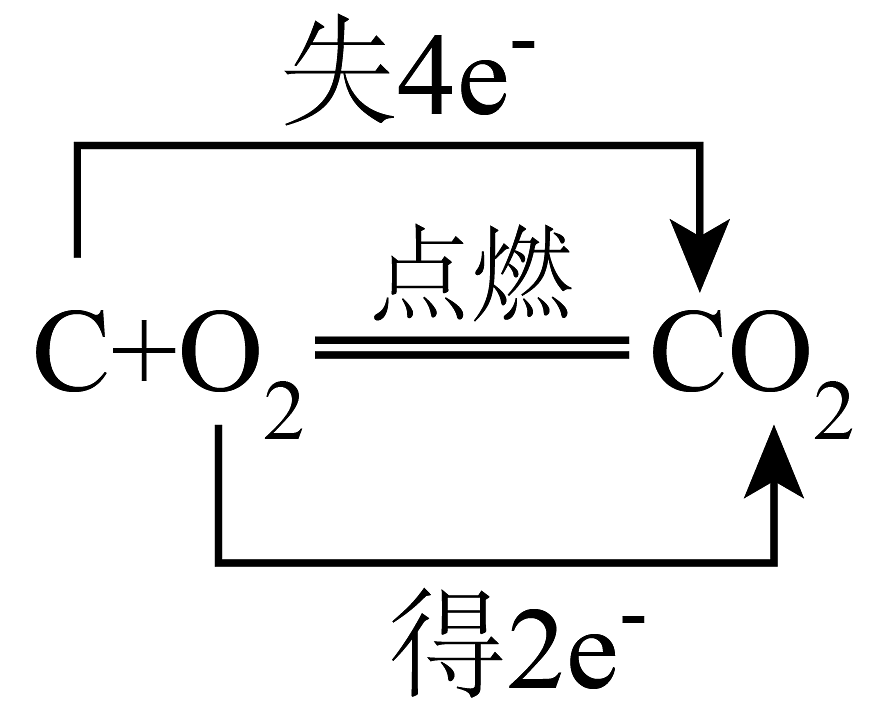 C、
C、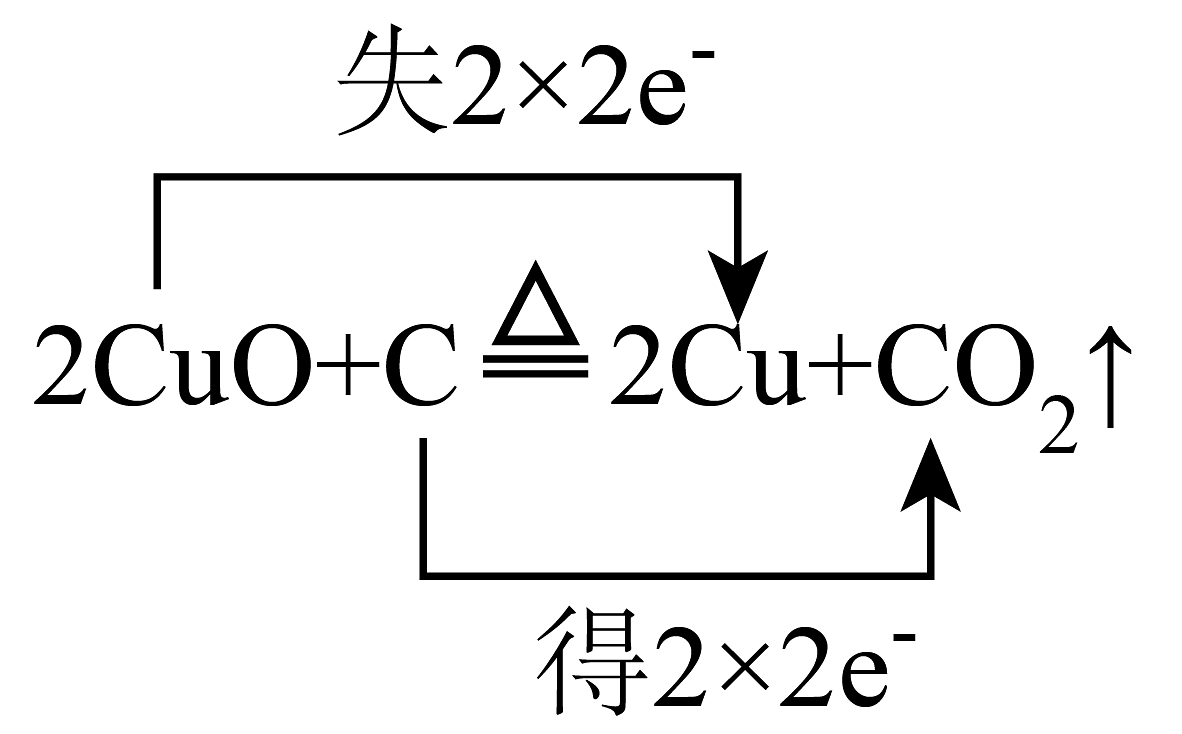 D、
D、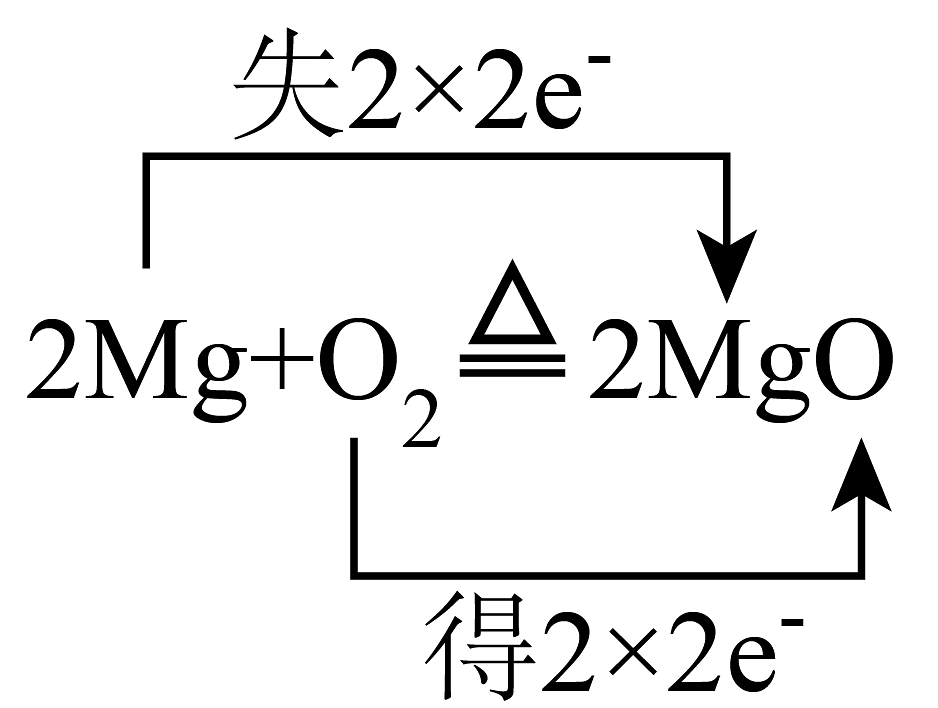
-
4、下列物质的分类正确的是
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
HCl
MgO
CO2
B
NaOH
H2SO4
NaCl
Na2O
CO2
C
KOH
HClO
CaCO3
CaO
CO
D
NH3·H2O
CH3COOH
CaCl2
Na2O2
SO2
A、A B、B C、C D、D -
5、下列溶液里离子检验的结论正确的是A、加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能含CO32- B、加BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液一定含有SO42- C、加AgNO3溶液有白色沉淀产生,原溶液一定含有Cl- D、加Na2CO3溶液有白色沉淀产生,再加盐酸,沉淀消失,原溶液中一定含有Ba2+
-
6、化学基本概念是学习化学的基础,下列有关化学概念的理解正确的是A、电解质:能导电的物质 B、有机物:含有碳元素的物质 C、酸:能电离出的物质 D、摩尔质量:单位物质的量的物质所具有的质量
-
7、空气中资源的利用具有重要意义。某小组通过电解吸收了CO2的KOH溶液(含碳微粒主要为KHCO3)的实验,得到相应的有机产物的法拉第效率[法拉第效率]随电解电压的变化如图所示。下列说法错误的是
 A、当电解电压为时,阴极主要的还原产物为H2 B、阴极生成的电极反应式为: C、当电解电压为时,电解生成的C2H4和的物质的量之比为3∶1 D、用铅蓄电池作电源电解,当只生成标况下2.24L的CH4时,理论上电源的负极增重38.4g
A、当电解电压为时,阴极主要的还原产物为H2 B、阴极生成的电极反应式为: C、当电解电压为时,电解生成的C2H4和的物质的量之比为3∶1 D、用铅蓄电池作电源电解,当只生成标况下2.24L的CH4时,理论上电源的负极增重38.4g -
8、某同学设计如下图所示实验,探究反应中的能量变化。下列判断正确的是
 A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 C、实验(c)中为了使反应进行完全,可以向盐酸中分几次加入氢氧化钠溶液 D、若用NaOH固体测定中和反应的反应热,则测定结果数值偏高
A、由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应 B、将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加 C、实验(c)中为了使反应进行完全,可以向盐酸中分几次加入氢氧化钠溶液 D、若用NaOH固体测定中和反应的反应热,则测定结果数值偏高 -
9、若能发生如下反应:①;②;③。根据上述反应,判断下列结论中错误的是A、Cl2在反应①③中均作氧化剂 B、Cl2在反应②中既是氧化产物又是还原产物 C、氧化性强弱的顺序为: D、反应③中消耗1个Cl2 , 转移2个电子
-
10、高温下甲醇(CH3OH)分解生成燃料气(CO、H2),反应原理为CH3OH(g)=CO(g)+2H2(g)。表示该反应速率最快的是A、v(CH3OH)=1mol·L-1·s-1 B、v(CO)=1.5mol·L-1·s-1 C、v(H2)=2mol·L-1·s-1 D、v(CO)=1.5mol·L-1·min-1
-
11、下列家务劳动中涉及到的物质所属分类正确的是A、用CH3COOH去除水垢:CH3COOH是强酸 B、用Na2CO3清洗厨房油污:Na2CO3属于碱 C、用NaClO漂白衣物:NaClO属于盐 D、用C2H5OH擦拭物体表面消毒:C2H5OH是电解质
-
12、如图所示,“——”表示相连的物质间在一定条件可以反应,“→”表示在一定条件下丁可以转化为乙;下面四组选项中符合如图要求的是( )

甲
乙
丙
丁
A
H2SO4
Na2SO4
NaOH
NaCl
B
KCl
K2CO3
KOH
HCl
C
O2
CO
C
CuO
D
Fe
CuCl2
Zn
HCl
A、A B、B C、C D、D -
13、钒系催化剂催化脱硝部分机理如图所示。有关该过程的叙述错误的是
 A、反应过程中既有极性键又有非极性键的断裂和形成 B、反应过程中被氧化 C、脱硝反应为 D、是反应中间体
A、反应过程中既有极性键又有非极性键的断裂和形成 B、反应过程中被氧化 C、脱硝反应为 D、是反应中间体 -
14、下列实验装置不能达到实验目的的是
 A、验证Na和水反应是放热反应 B、验证Na2O2能与H2O反应放出O2 C、检验溶液中是否有钠离子 D、比较Na2CO3、NaHCO3的稳定性
A、验证Na和水反应是放热反应 B、验证Na2O2能与H2O反应放出O2 C、检验溶液中是否有钠离子 D、比较Na2CO3、NaHCO3的稳定性 -
15、一定条件下,硝酸铵受热分解的化学方程式(未配平),该反应中,被氧化与被还原的氮原子个数之比为A、5∶3 B、5∶4 C、1∶1 D、3∶5
-
16、
I、已知下列反应:
①Cl2+2NaBr=2NaCl+Br2;②2KI+Br2=2KBr+I2;③Na2S+I2=2NaI+S↓。
(1)Cl-、Br-、I-、S2-四种离子的还原性由强到弱的顺序是________。(2)判断Cl2与Na2S能否反应?________(填“否”或书写离子反应方程式)。(3)判断I2与NaBr能否反应?________(填“否”或书写离子反应方程式)。(4)已知实验室制取氯气反应为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O ,由此分析:MnO2在反应中________电子,发生________反应。(5)在硫酸溶液中,NaClO3和Na2SO3能按粒子个数比1:2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4 , 则X为_______。A. Cl2O7 B. ClO2 C. Cl2O D. Cl2 II.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知单质X。
(6)已知KBrO3在反应中得到电子,则该反应的还原剂是________。(7)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为________。(8)根据上述反应可推知_______。A. 氧化性:KBrO3>H3AsO4 B. 氧化性:H3AsO4>KBrO3 C. 还原性:AsH3>X D. 还原性:X>AsH3 -
17、
Ⅰ.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:

(1)步骤③的实验操作为(填操作名称),此过程使用玻璃棒,玻璃棒的作用是。
(2)步骤④反应的离子方程式为。该离子反应的氧化剂是 , 还原剂是。
(3)向步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现色,说明有碘单质产生。
Ⅱ.碘被称为“智力元素”。以前食盐中常加入KI作为加碘剂,但空气中氧气的作用容易引起碘的损失,被氧气氧化成碘单质 , 同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:。
Ⅲ.现在的食盐里改添加性质稳定的 , 以满足人们需要。几种粒子之间有如下所示关系:

(5)四个途径中属于氧化还原反应的是(填序号)。
-
18、现有一份Na2CO3和NaHCO3固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中NaHCO3的质量分数。

实验步骤如下:
①组装好实验装置,并_______;
②加药品,称取m g样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;
③打开活塞K1、K2 , 关闭K3 , 缓缓鼓入空气数分钟;
④关闭活塞K1、K2 , 打开K3 , 点燃酒精灯加热至不再产生气体;
⑤打开活塞K1 , 缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)、补充实验步骤①的操作为。(2)、装置E中实验仪器的名称为。(3)、装置B中发生反应的化学方程式为。(4)、实验步骤⑤中“缓缓鼓入空气数分钟”的目的是。(5)、若缺少实验步骤③会导致测定结果(填“偏大”“偏小”或“无影响”)。(6)、样品中NaHCO3的质量分数为×100%(用含m、m1、m2的式子表示)。(7)、若将该固体混合物溶于水,向溶液中加入盐酸,所加盐酸的体积与产生CO2的体积关系如图所示,则线段)∣OA∣∣AB∣(填“>”“<”或“=”):OA段发生反应的离子方程式为。
-
19、学习小组利用如下流程制备过氧化钠,并设计实验验证其相关性质。

回答下列问题:
(1)、流程中由Na2O生成淡黄色固体的化学方程式为。(2)、小组同学取一定量淡黄色固体溶于冷水中。待固体全部反应后,仍可缓慢释放氧气,为探究固体溶解后溶液成分,设计如下实验方案进行验证:
①甲中产生较多气泡,证明固体溶解后溶液中有(填化学式),写出甲中发生反应的化学方程式。
②向乙中滴入酚酞,溶液变红的原因是(用物质的电离方程式回答)。
(3)、小组同学将金属钠加热至熔化后,误通入了干燥的CO2进行反应,将反应后固体产物溶于稀盐酸,产生气泡,观察到难溶于水的黑色固体。①产物中与盐酸反应的物质可能为(填化学式)。
②经检验,黑色固体为单质碳。写出CO2与Na反应的化学方程式。
-
20、下列鉴别与固体的实验不能达到实验目的的是( )
选项
操作
结论
A
分别取少许两种固体于试管中加热
能产生使澄清石灰水变浑浊的气体的为
B
分别取少许两种固体于试管中,加水溶解后,滴加少量极稀的溶液
能产生白色沉淀的为
C
分别取少许两种固体于试管中,加水溶解后,滴加少量溶液
产生白色沉淀的为
D
分别取少许两种固体于试管中,逐滴加入同浓度的稀盐酸
立即产生气泡的为
A、A B、B C、C D、D