相关试卷
-
1、我国科学家构建直接异质结和间接异质结构系统,实现还原和氧化。有关该过程的叙述正确的是
 A、只涉及太阳能转化为化学能 B、金属Pt表面的反应为: C、作为氧化还原协同电对,可以换成 D、总反应为:
A、只涉及太阳能转化为化学能 B、金属Pt表面的反应为: C、作为氧化还原协同电对,可以换成 D、总反应为: -
2、用下图所示装置探究某浓度浓硝酸与铁的反应。装置①中Fe表面产生红棕色气泡,过一会儿停止;装置②插入铜连接导线一段时间后,Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……,如此往复多次;Cu表面始终有红棕色气泡。下列说法正确的是

 A、①中现象说明该浓硝酸具有强氧化性,能将Fe钝化为Fe2O3 B、②中连接导线后,体系形成了原电池,Cu始终为负极 C、②中Fe表面产生红棕色气泡时,Fe为负极 D、Cu表面发生的反应只有:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、NO+2H++e-=NO2↑+H2O
A、①中现象说明该浓硝酸具有强氧化性,能将Fe钝化为Fe2O3 B、②中连接导线后,体系形成了原电池,Cu始终为负极 C、②中Fe表面产生红棕色气泡时,Fe为负极 D、Cu表面发生的反应只有:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、NO+2H++e-=NO2↑+H2O -
3、某有机物的结构简式如图所示,下列说法错误的是
 A、该有机物属于烃的衍生物 B、该有机物含3种官能团 C、该有机物能发生消去反应 D、0.1mol该有机物与足量的Na反应,能得到标准状况下的气体1.12L
A、该有机物属于烃的衍生物 B、该有机物含3种官能团 C、该有机物能发生消去反应 D、0.1mol该有机物与足量的Na反应,能得到标准状况下的气体1.12L -
4、设NA为阿伏加德罗常数的值,下列说法不正确的是A、10 g质量分数为46%的乙醇水溶液中所含氢原子数为0.6NA B、常温常压下,11.2 L乙烯所含分子数目小于0.5NA C、常温常压下,4.4 g N2O与CO2的混合气体中含的原子数目为0.3NA D、常温下,1 mol C5H12中含有共价键数为16NA
-
5、硼砂阴离子的球棍模型如图所示,下列说法正确的是
 A、B原子的杂化方式均为 B、该阴离子中所存在的化学键类型有配位键、极性共价键、氢键 C、硼砂阴离子呈链状结构,则阴离子间以氢键结合 D、1、3原子之间的化学键为配位键
A、B原子的杂化方式均为 B、该阴离子中所存在的化学键类型有配位键、极性共价键、氢键 C、硼砂阴离子呈链状结构,则阴离子间以氢键结合 D、1、3原子之间的化学键为配位键 -
6、金属元素的单质和化合物在日常生产和生活中有广泛的应用,其中涉及的化学知识正确的是A、加入稀硝酸酸化的KSCN溶液检验蔬菜中的铁元素 B、火灾现场存放大量的钠,应立即用泡沫灭火器灭火 C、用覆铜板制作印刷电路板可以用溶液作为“腐蚀液” D、厨房中使用的小苏打易吸水结块,不可用作清洁剂
-
7、下列说法不正确的是A、新型农用薄膜能够选择性地透过种植某种植物所需要的特定波长的光,它的降解是化学变化 B、向煤中加入适量石灰石,使煤燃烧产生的最终生成 , 可减少对大气的污染 C、大力推广使用乙醇汽油、新型能源来缓解能源危机,乙醇汽油中的成分都是不可再生资源 D、碳纳米管是一种由石墨烯卷曲成的纳米材料,与富勒烯中的有些C原子成键方式相似
-
8、配合物X(只有一种配体)由五种元素组成,某实验小组按如下流程进行相关实验:

其中:固体单质A的焰色反应是绿色;混合气体由4种气体组成(不考虑气体之间相互反应);气体E为空气中含量最高的非极性气体;配合物X中氮元素质量为3.36g。
请回答:
(1)、组成配合物X的五种元素是H、O、N、、 , 其配位原子是。(2)、刺激性气体C的空间构型是。(3)、①写出混合气体经浓硫酸干燥后通入酸性溶液的离子方程式:。②写出配合物X在高温条件下隔绝空气分解反应的化学方程式:。
(4)、设计实验证明配合物X的中心离子与配体形成的配位键的能力强于其中心离子与形成的配位键的能力:。 -
9、填空。(1)、基态碳原子核外电子的空间运动状态有种,基态硒原子核外价电子排布式为。(2)、吡啶(
 )分子中也含有与苯类似的大键,则吡啶中N原子的孤电子对占据的轨道为轨道,吡啶在水中的溶解度苯(填“大于”或“小于”)。 (3)、已知CH3NH2的碱性比NH2OH强,原因是。(4)、NH4HF2中存在的化学键类型是_______(填选项字母)。A、配位键 B、氢键 C、离子键 D、共价键(5)、如图表示的SiO2的晶胞结构,试回答下列问题。
)分子中也含有与苯类似的大键,则吡啶中N原子的孤电子对占据的轨道为轨道,吡啶在水中的溶解度苯(填“大于”或“小于”)。 (3)、已知CH3NH2的碱性比NH2OH强,原因是。(4)、NH4HF2中存在的化学键类型是_______(填选项字母)。A、配位键 B、氢键 C、离子键 D、共价键(5)、如图表示的SiO2的晶胞结构,试回答下列问题。
①1个SiO2晶胞中含有个Si-O键。
②若SiO2正立方体形状晶体的密度为ρ g/cm3 , SiO2晶体中最近的两个硅原子之间的距离表达式为cm。(NA表示阿伏加德罗常数)
-
10、普鲁卡因是一种常见药物,其结构如图所示,有关该化合物的说法不正确的是
 A、分子中最多有11个碳原子共平面 B、具有还原性,能使酸性高锰酸钾溶液褪色 C、能与盐酸反应,最多消耗2mol盐酸 D、一定条件下,能发生水解,其中一种水解产物既可与盐酸反应又可与NaOH溶液反应
A、分子中最多有11个碳原子共平面 B、具有还原性,能使酸性高锰酸钾溶液褪色 C、能与盐酸反应,最多消耗2mol盐酸 D、一定条件下,能发生水解,其中一种水解产物既可与盐酸反应又可与NaOH溶液反应 -
11、对于反应 , 在温度一定时,平衡体系中的体积分数随压强的变化情况如图所示。下列说法中,正确的是
 A、A、D两点对应状态的正反应速率大小关系:v(A)>v(D) B、A、B、C、D、E各点对应状态中,v(正)<v(逆)的是E C、维持不变,E→A所需时间为 , 维持不变,D→C所需时间为 , 则 D、欲使C状态沿平衡曲线到达A状态,从理论上,可由无限缓慢降压至达成
A、A、D两点对应状态的正反应速率大小关系:v(A)>v(D) B、A、B、C、D、E各点对应状态中,v(正)<v(逆)的是E C、维持不变,E→A所需时间为 , 维持不变,D→C所需时间为 , 则 D、欲使C状态沿平衡曲线到达A状态,从理论上,可由无限缓慢降压至达成 -
12、三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,下列有关该反应的说法不正确的是A、当0.5molH2O被氧化时,生成0.1mol氧气 B、氧化剂与还原剂的物质的量之比为2∶3 C、当转移电子6mol时,生成的还原产物为1mol D、当生成2.7molHF时,被BrF3还原的BrF3为0.2mol
-
13、下列关于
 的说法,不正确的是 A、该物质至少10个碳原子共平面 B、该物质既能与NaOH反应也能与HCl反应 C、该物质能与溶液作用显紫色 D、该物质能与1,3—丁二烯制得三个六元环的产物
的说法,不正确的是 A、该物质至少10个碳原子共平面 B、该物质既能与NaOH反应也能与HCl反应 C、该物质能与溶液作用显紫色 D、该物质能与1,3—丁二烯制得三个六元环的产物 -
14、下列说法正确的是A、硫在纯氧中燃烧可生成三氧化硫 B、亚硝酸钠是一种食品添加剂,用作食品防腐剂和肉类食品的发色剂 C、浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输 D、将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有酸性和漂白性
-
15、下列说法不正确的是A、氮气、二氧化碳均可用作镁燃烧的灭火剂 B、熟石灰、氨水均可用于吸收工业废气中的二氧化硫 C、氯化钠可用于生产纯碱、烧碱 D、氧化镁、氧化铝均可用于制作耐火材料
-
16、下列玻璃仪器上有标明“0”刻度的是A、
 B、
B、 C、
C、 D、
D、
-
17、下列物质不属于电解质的是A、氨基酸 B、锌单质 C、硫酸钡 D、氯化铝
-
18、下列关于物质的分类不正确的是A、尿素—有机物 B、云—气溶胶 C、纤维素—纯净物 D、硝酸—共价化合物
-
19、丙醛是一种重要的工业原料。在铑催化剂作用下,乙烯羰基合成丙醛的反应如下:
反应Ⅰ:C2H4(g)+H2(g)+CO(g)CH3CH2CHO(g) △H1
反应Ⅱ:C2H4(g)+H2(g)C2H6(g) △H2
回答下列问题:
(1)、T℃时,向恒压容器中充入1.0 mol C2H4、1.0 mol H2和1.0 mol CO,若在该条件下只发生反应Ⅰ,达平衡时,反应放出77.4 kJ的能量:若相同条件下向该容器中充入1.0 mol CH3CH2CHO,达平衡时,反应吸收51.6 kJ的能量,则反应Ⅰ的△H1= kJ/mol。(2)、在恒压条件下,按照投料n(C2H4):n(H2):n(CO)=1:1:1,匀速通入装有催化剂的反应器中发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下C2H4的转化率()如图曲线中n所示。预测化学反应速率v(B)v(D) (填“>”、“=”或“<" ),产生这一结果的原因可能是。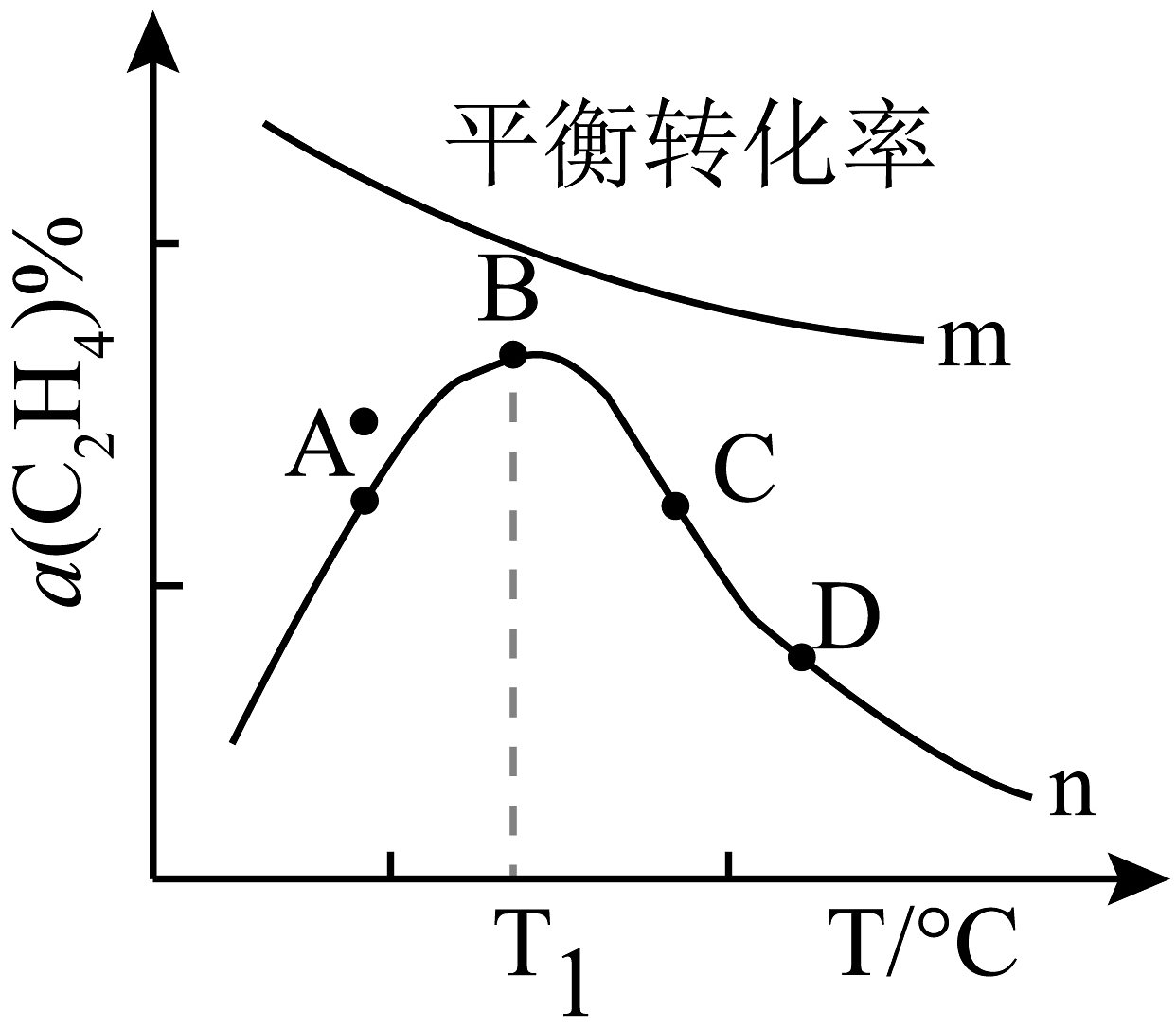 (3)、在恒压密闭容器中,通入1 mol C2H4、1 mol CO和n(H2),在一定温度和铑催化剂作用下,发生上述反应,测得C2H4的转化率()和丙醛选择性(x=)随变化关系如图所示。则曲线b表示 , 当1.08 <<1.1时,曲线a随的增大而降低的原因是。
(3)、在恒压密闭容器中,通入1 mol C2H4、1 mol CO和n(H2),在一定温度和铑催化剂作用下,发生上述反应,测得C2H4的转化率()和丙醛选择性(x=)随变化关系如图所示。则曲线b表示 , 当1.08 <<1.1时,曲线a随的增大而降低的原因是。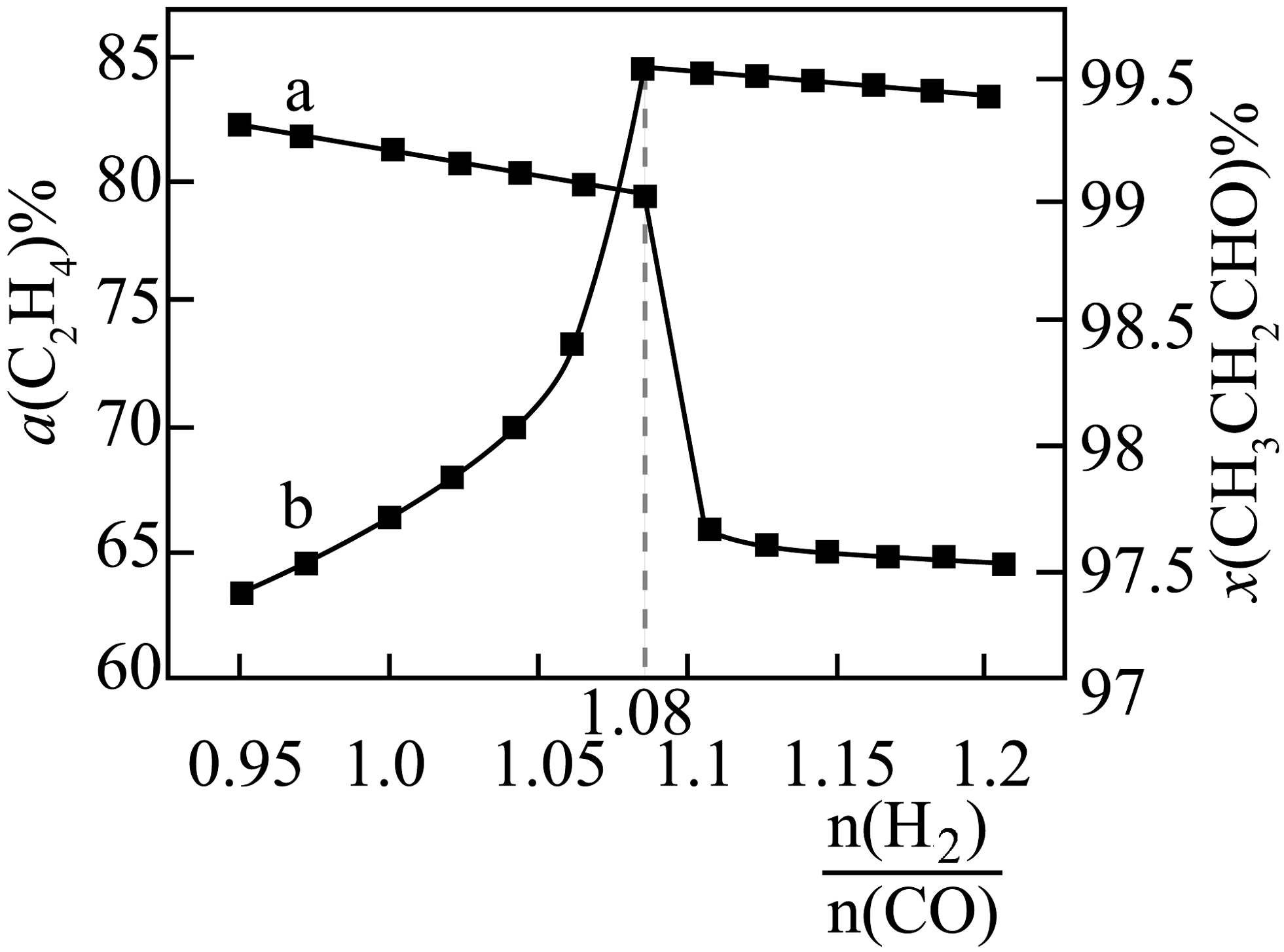 (4)、保持温度不变,在恒容反应器中,按照投料n(C2H4):n(H2):n(CO)=1:1:1,初始总压为3p kPa,发生反应Ⅰ和Ⅱ,达到平衡时C2H4的转化率为80%,C2H6的选择性为25%,则H2的转化率为 , 反应Ⅱ的Kp=kPa-1 (用含p的代数式表示)。
(4)、保持温度不变,在恒容反应器中,按照投料n(C2H4):n(H2):n(CO)=1:1:1,初始总压为3p kPa,发生反应Ⅰ和Ⅱ,达到平衡时C2H4的转化率为80%,C2H6的选择性为25%,则H2的转化率为 , 反应Ⅱ的Kp=kPa-1 (用含p的代数式表示)。 -
20、硝苯甲乙砒啶临床适用于高血压、充血性心衰竭,其合成路线如下:

已知:①

②

③
 (以上反应中、、、表示烃基)
(以上反应中、、、表示烃基)回答下列问题:
(1)、A的名称是。(2)、B中官能团的名称是 , 写出由B→D的化学反应方程式。(3)、连有4个不同的原子或基团的碳原子称为手性碳,则E中含有个手性碳。(4)、是加成反应,则C的结构简式为。(5)、B的同分异构体中,同时满足以下条件的共有种(不考虑立体异构);其中,核磁共振氢谱有四组峰的化合物的结构简式为(写出一种即可)。a.能发生水解反应; b.1mol该化合物发生银镜反应,可得4molAg
(6)、设计由B和溴乙烷为原料,制备2-戊酮( )的合成路线(其他无机试剂任选)。
)的合成路线(其他无机试剂任选)。