相关试卷
-
1、
Ⅰ.有一种“地康法”制取氯气的反应原理如图所示:

(1)“地康法”制取氯气总反应的化学方程式为。
(2)若上述反应Ⅱ中,标况下,3.36L O2参与反应,则转移电子数约为。
Ⅱ. ClO2在常温下为黄色气体,熔点为−59.5℃,沸点为11℃,易溶于水,其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应:4ClO2 + 4OH− = 3+ ClO− + 2H2O。ClO2的制备方法有多种。请回答下列问题:
(3)实验室可用图示中装置制备、收集ClO2 (夹持装置略)。

①装置A中发生反应的化学方程式为。
②为了使装置B能收集到更多的ClO2 , 可采取的措施为(填一条)。
(4)ClO2的稳定性较差,易分解,常用H2O2溶液和NaOH溶液将其转化为NaClO2进行保存。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目。若加入过量NaOH溶液,可能导致的后果是。
-
2、
新型冠状病毒肺炎疫情在全球爆发,研究表明“84”消毒液可以有效地消灭病毒。
Ⅰ.“84”消毒液的配制
已知某“84”消毒液部分标签如下所示,回答下列问题:
净含量: 密度:
主要成分:20%(质量分数)
摩尔质量:
注意事项:密封保存,易吸收空气中的变质
(1)某同学参阅该“84”消毒液的配方,欲用固体配制的消毒液,需要用托盘天平称量固体的质量g。
(2)写出NaClO在水溶液中的电离方程式:。
(3)在配制该“84”消毒液的过程中,除烧杯、胶头滴管等仪器外,还必需的玻璃仪器有玻璃棒、。
(4)下列操作可能使配制的溶液浓度偏低的是 (填字母)。
A.移液时,未洗涤烧杯内壁和玻璃棒 B.溶解后未经冷却就移液
C.移液时,有少量液体溅出 D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
Ⅱ.“84”消毒液性能探究
同学们探究84消毒液在不同pH下使红纸褪色的情况,做了如下实验。
步骤1:将5mL市售84消毒液稀释100倍,测得稀释后溶液的;
步骤2:将稀释后溶液各20mL分别加入a、b、c三个洁净的烧杯中;
步骤3:用溶液将a、b、c三个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下。
烧杯
溶液的pH
现 象
a
10
10min后,红纸基本不褪色;4h后红纸褪色
b
7
10min后,红纸颜色变浅;4h后红纸褪色
c
4
10min后,红纸颜色比b烧杯中10min后的浅;4h后红纸褪色
已知溶液中、HClO、和的物质的量分数(α)随溶液pH变化的关系如图所示:

(5)由实验现象可获得结论:溶液的pH在4~10范围内,pH越大,红纸褪色(填“越快”或“越慢”)。
(6)结合图象进行分析,b、c两烧杯中实验现象出现差异的原因是。
(7)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用的浓硫酸配制物质的量浓度为的稀硫酸用于增强“84消毒液”的消毒能力,需要用量筒取mL上述浓硫酸进行配制。
-
3、回答下列问题。(1)、现有:①固体KOH ②稀硫酸 ③氨气 ④熔融NaCl ⑤蔗糖 ⑥铜;其中能导电的是(填序号,下同);属于电解质的是。(2)、标准状况下,质量为66 g的CO2的分子数约为个。(3)、19g某二价金属的氯化物ACl2中含有离子,ACl2的摩尔质量是。(4)、标准状况下,17g与标准状况下L含有相同数目的氢原子。(5)、若阿伏加德罗常数数值用NA表示,单位mol-1 , 则1个12C的质量为g。
-
4、如图所示是模拟制备氯水并检验Cl2性质的装置(夹持装置略去,挥发的HCl较少)。下列说法正确的是
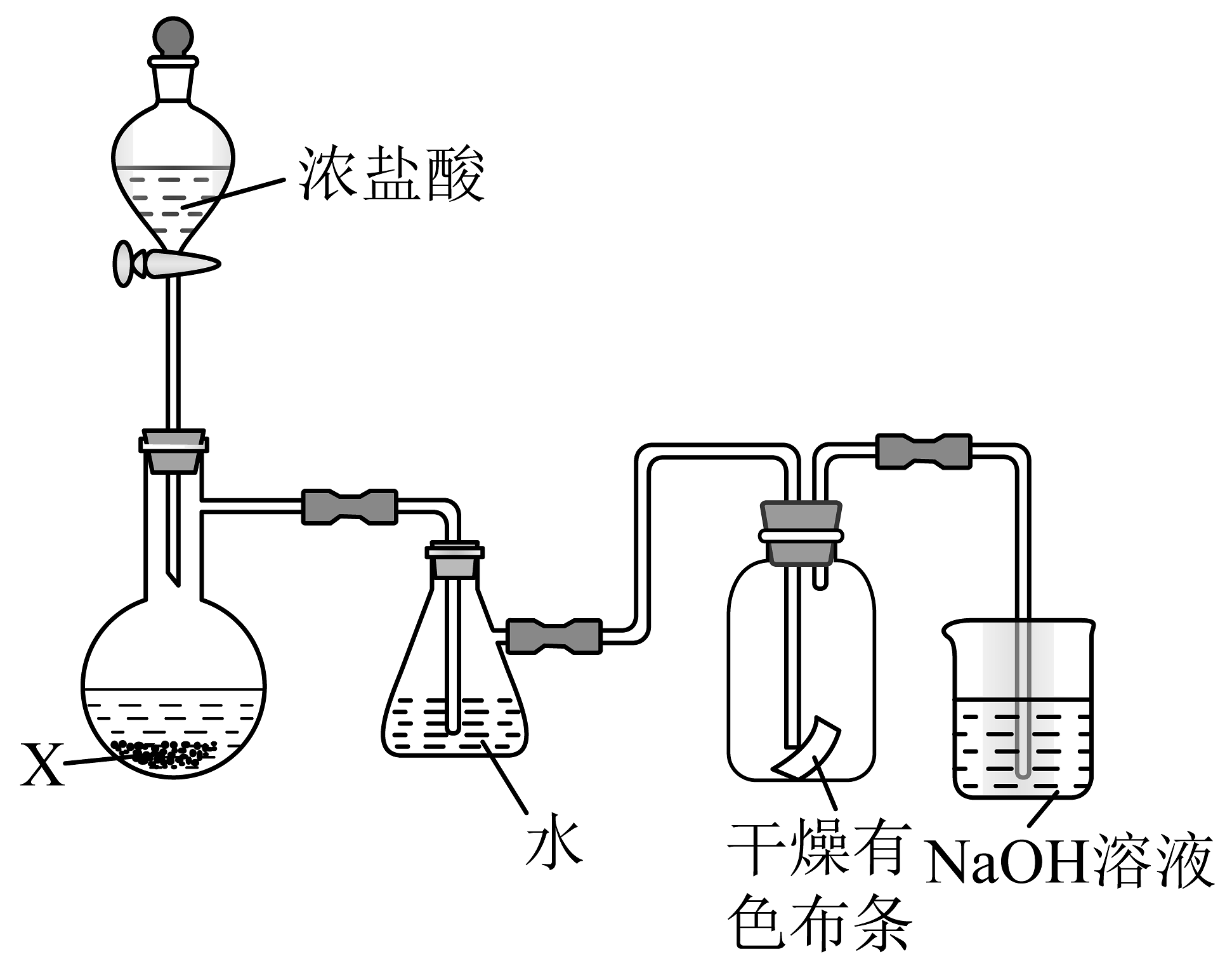 A、烧瓶中固体试剂X应是MnO2 B、水浴加热抽滤瓶能加快Cl2与水反应速率,增大氯水中HClO的浓度 C、干燥有色布条褪色,说明Cl2分子有漂白性 D、装有NaOH溶液的烧杯可吸收尾气,防止污染
A、烧瓶中固体试剂X应是MnO2 B、水浴加热抽滤瓶能加快Cl2与水反应速率,增大氯水中HClO的浓度 C、干燥有色布条褪色,说明Cl2分子有漂白性 D、装有NaOH溶液的烧杯可吸收尾气,防止污染 -
5、下列装置、操作和实验目的不正确的是
 A、图1装置可检验纯碱中是否含有钾元素 B、观察图2中澄清石灰水是否变浑浊可鉴别碳酸钠和碳酸氢钠 C、图3滴水生火可证明过氧化钠与水反应放热 D、图4装置若蘸有溴化钠溶液的棉球变成橙色,蘸有淀粉KI溶液的棉球变成蓝色,可验证氧化性:
A、图1装置可检验纯碱中是否含有钾元素 B、观察图2中澄清石灰水是否变浑浊可鉴别碳酸钠和碳酸氢钠 C、图3滴水生火可证明过氧化钠与水反应放热 D、图4装置若蘸有溴化钠溶液的棉球变成橙色,蘸有淀粉KI溶液的棉球变成蓝色,可验证氧化性: -
6、为除去括号内的杂质,所选用的试剂或方法不正确的是A、Na2CO3固体(NaHCO3),加热至不再产生气体 B、CO2气体(HCl),通入饱和NaHCO3溶液洗气 C、Na2O2粉末(Na2O),将混合物在氧气中加热 D、NaOH溶液(Na2CO3),滴加适量CaCl2溶液并过滤
-
7、下列有关反应的离子方程式正确的是A、碳酸钙和盐酸反应:+2H+=CO2↑+ H2O B、Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ C、氯气溶于水:Cl2+H2OH++Cl-+HClO D、氢氧化钡溶液与稀硫酸反应:
-
8、在给定条件下,下列选项所示的物质间转化均能实现的是A、 B、 C、 D、
-
9、下列关于物质性质的描述,不正确的是A、氢气在氯气中燃烧产生苍白色火焰,在瓶口出现白雾 B、氯气具有强氧化性,能将大多数金属氧化,生成金属氯化物 C、钠块投入水中,迅速熔成银白色小球 D、钠燃烧时发出黄色的火焰,生成氧化钠
-
10、下列变化需要加入氧化剂才能实现的是A、S2-→HS- B、Na2SO3→SO2 C、SO2→S D、H2S→S
-
11、下列溶液中,Cl-物质的量浓度最大的是A、200mL 0.5 mol·L-1NaCl 溶液 B、100mL 0.8mol·L-1 NaClO 溶液 C、800mL 0.3mol·L-1NaCl 溶液 D、1000mL 0.6 mol·L-1NaClO3 溶液
-
12、下列透明溶液中能大量共存的离子组是A、K+、Cu2+、、 B、H+、Na+、OH-、 C、K+、Na+、、OH- D、Na+、Ba2+、OH-、
-
13、下列有关钠及其化合物的性质与用途具有对应关系的是A、钠单质熔点较低,可用于冶炼金属钛 B、次氯酸钠具有强氧化性,可用作杀菌消毒 C、过氧化钠呈淡黄色,可用作呼吸面具供氧剂 D、碳酸氢钠受热易分解,可用于治疗胃酸过多
-
14、下列说法正确的是A、0.1molNa2O2固体中含有的阴阳离子数目之比为1:1 B、标准状况下,4.48LH2O的分子数约为1.204×1023 C、0.1mol•L-1Na2SO4溶液中含有 D、在标准状况下,等体积的NH3和O2中所含分子数之比为1∶1
-
15、向含有FeCl3和FeCl2的混合溶液中滴加NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物(Fe3O4)。下列有关说法正确的是A、形成该黑色分散系时发生的反应为物理变化 B、可用过滤的方法分离出黑色分散系中的金属氧化物 C、向沸水中逐滴滴加饱和FeCl3溶液也可得到该黑色分散系 D、用激光笔照射该分散系,从垂直于光线的方向观察,可观察到一条光亮的通路
-
16、布洛芬(C13H18O2)是家庭常备药品,可用于缓解轻至中度疼痛如头痛、牙痛等,也用于普通感冒或流行性感冒引起的发热。下列有关说法正确的是A、布洛芬中含有金属元素和非金属元素 B、1个布洛芬分子中含有32个原子 C、布洛芬中氢、氧元素的质量比为9:16 D、布洛芬属于氧化物
-
17、铜和在工农业生产中用途广泛,用黄铜矿(主要成分为 , 其中Cu为+2价、Fe为+2价)制取铜和的工艺流程如图所示。

已知:
(1)、高温焙烧时发生的反应是 , 该反应中,氧化剂是;参加反应时,反应中转移电子mol。(2)、具有较强的氧化性,具有较强的还原性,写出向滤液A中通入氯气的离子方程式。(3)、向溶液B中通入后发生反应的离子方程式为。(4)、工业上用生物法处理的原理为(硫杆菌作催化剂):
由图甲和图乙判断使用硫杆菌的最佳条件为;若反应温度过高,反应速率下降,其原因是。
-
18、
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。
I.实验室中利用下图装置(部分装置省略)制备和。

已知:在较高温度下,氯气与碱反映生成和;易溶于水;KCl和的溶解度曲线如图所示。

回答下列问题:
(1)a中盛放浓盐酸的仪器名称是。
(2)d中化学反应的离子方程式是。
(3)装置e的作用是。
(4)结合KCl和的溶解度曲线,补充完整获取晶体的实验方案:反应结束后,将装置c试管内溶液转移至 , 干燥,得到晶体。[实验中必须使用的试剂:稀溶液,冰水]
II.用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)、温度的变化如图(a)、(b)所示。已知:次氯酸盐溶解在水中有三种不同的存在形式,分别是、和HClO,其含量与pH的关系如图(c)所示。HClO的氧化性大于。

(5)在酸性NaClO溶液中,HClO氧化NO生成和的离子方程式为。
(6)NaClO溶液的初始pH控制在6左右,其原因是。
(7)温度高于25℃,NO去除率下降的原因可能是。
-
19、
氯化钡常用作分析试剂、脱水剂,制钡盐原料以及用于电子、仪表、冶金等工业。某实验小组欲通过重量分析法测定中钡元素的含量。
I.沉淀剂的配制
用重量法测定时,一般用稀硫酸作沉淀剂。实验中需用质量分数为、密度为的浓硫酸配制溶液。

(1)以上仪器在配制溶液中肯定不需要的是(填序号);配制上述溶液时还需用到的玻璃仪器是 , 该仪器在使用前必须进行的一步操作是。
(2)在配制溶液时,用量筒量取浓硫酸的体积为mL(结果保留一位小数)。
II.测定试样中钡元素的含量
步骤1:称取试样,置于250mL烧杯中,加入约100mL水、溶液,搅拌溶解,加热至近沸。另取4mL1溶液于100mL烧杯中,加30mL水,加热至近沸,趁热将溶液分别逐滴加入到钡盐溶液中,直至溶液加完为止。
步骤2:待沉淀下沉后,向上层清液中加入滴溶液,仔细观察沉淀是否完全。沉淀完全后,盖上表面皿,放置过夜陈化。
步骤3:沉淀用倾泻法过滤;用稀硫酸洗涤沉淀次。
步骤4:沉淀的灼烧和恒重。将沉淀置于已恒重的瓷坩埚中烘干、炭化、灰化后,在(的马弗炉中灼烧至恒重,重复实验次。
(3)溶解试样时加入稀盐酸的目的是。
(4)若最终产生沉淀的平均质量为0.932g,则中钡元素的含量为(写出计算过程)。
-
20、
我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。
Ⅰ.联合制碱法的主要流程如下(部分物质已略去):

已知:极易溶于水,1体积水可溶解700体积。
(1)①~③所涉及的操作方法中,包含过滤的是(填序号)。(2)该工艺中通常是把氯化钠与气体1配成溶液,再通入过量的气体2,那么气体2是。(3)煅烧固体的化学方程式是。(4)下列关于联合制碱法流程说法正确的是(填字母)。a.可以循环使用 b.副产物可用作肥料 c.溶液B中只含有
Ⅱ.某小组对和的性质进行如下实验探究。
向溶液和溶液、溶液和溶液中各滴加溶液,观察现象:
序号
实验
实验现象
实验Ⅰ
溶液
有白色沉淀生成
实验Ⅱ
溶液
无明显现象
实验Ⅲ
溶液
有白色沉淀生成
实验Ⅳ
溶液
有白色浑浊出现,少量气泡冒出
(5)实验Ⅳ中浑浊经检验为 , 反应的离子方程式是。(6)基于实验Ⅰ~Ⅳ,能得出的合理结论是(写出1条即可)。