相关试卷
-
1、利用草酸(H2C2O4)及草酸盐的性质可测定人体血液中钙离子的浓度。已知:25℃,H2C2O4的电离常数;草酸钙的 , 碳酸钙的。25℃时,下列叙述错误的是A、在Na2C2O4溶液中:c(Na+)=2c(C2O)+2c(HC2O)+ 2c(H2C2O) B、在0.1mol/L的H2C2O4溶液中:c(H+)>c(H2C2O) C、将等浓度的H2C2O4溶液与NaOH溶液等体积混合,所得混合溶液的pH<7 D、向20mL碳酸钙的饱和溶液中逐滴加入的草酸钠溶液20mL,会产生草酸钙的沉淀
-
2、资料表明,烷烃的卤代反应为自由基反应,自由基是分子在光、热等外界条件下共价键发生均裂(指共价键断裂时均等的将共用电子对分配给成键的两个原子)而形成的原子或原子团,在水中不易形成。下图是氯气与甲烷发生取代反应的能量变化图。下列说法不正确的是
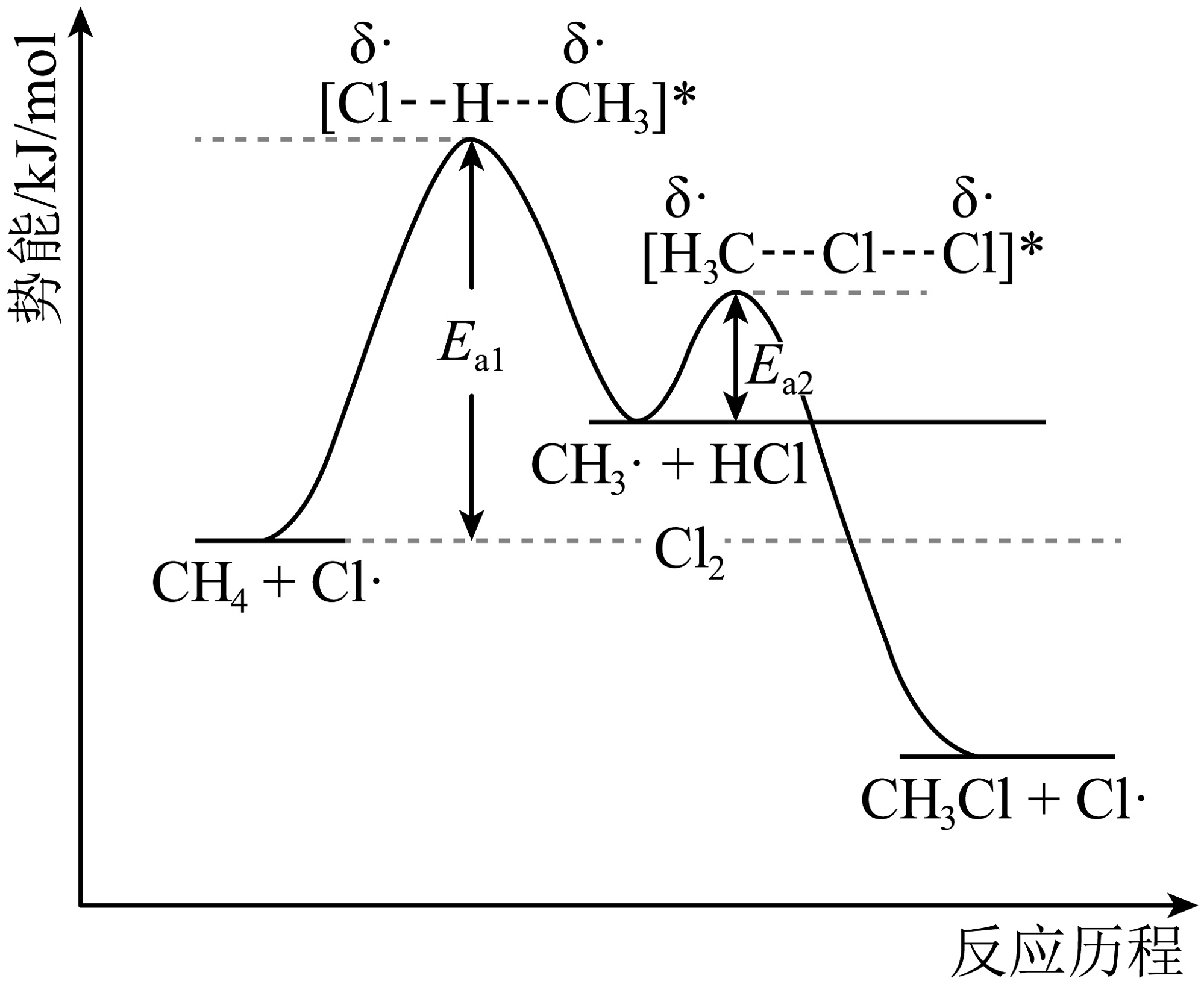 A、烷烃可与卤素气态单质发生卤代反应 B、烷烃可与溴水发生取代反应 C、烷烃可在光照或高温下发生卤代反应 D、产物中可能含有乙烷
A、烷烃可与卤素气态单质发生卤代反应 B、烷烃可与溴水发生取代反应 C、烷烃可在光照或高温下发生卤代反应 D、产物中可能含有乙烷 -
3、[Co(NH3)6]Cl3(三氯六氨合钴)是合成其它含钴配合物的重要原料,其晶体制备流程如下,下列说法错误的是
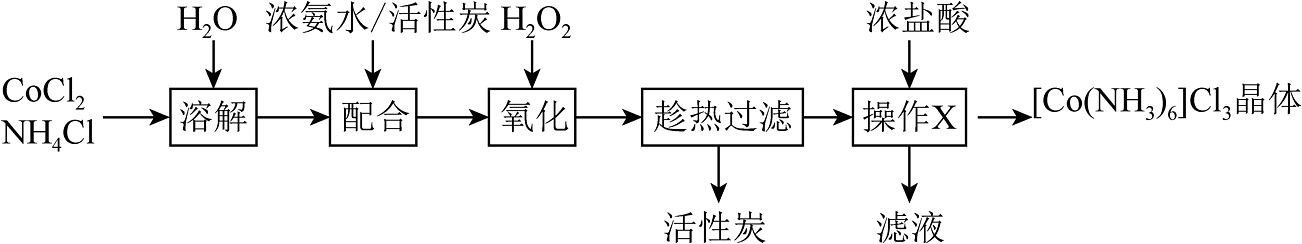 A、活性炭的作用是催化剂 B、已知氧化步骤需控温在60℃进行,故H2O2溶液应缓慢滴加 C、操作X中加入盐酸的目的是提供酸性环境 D、[Co(NH3)6]3+是以Co3+为中心的正八面体结构,则[Co(NH3)4Cl2]+的空间结构可能有2种
A、活性炭的作用是催化剂 B、已知氧化步骤需控温在60℃进行,故H2O2溶液应缓慢滴加 C、操作X中加入盐酸的目的是提供酸性环境 D、[Co(NH3)6]3+是以Co3+为中心的正八面体结构,则[Co(NH3)4Cl2]+的空间结构可能有2种 -
4、乙醇电催化氧化制备乙醛的原理如下图所示,下列说法正确的是
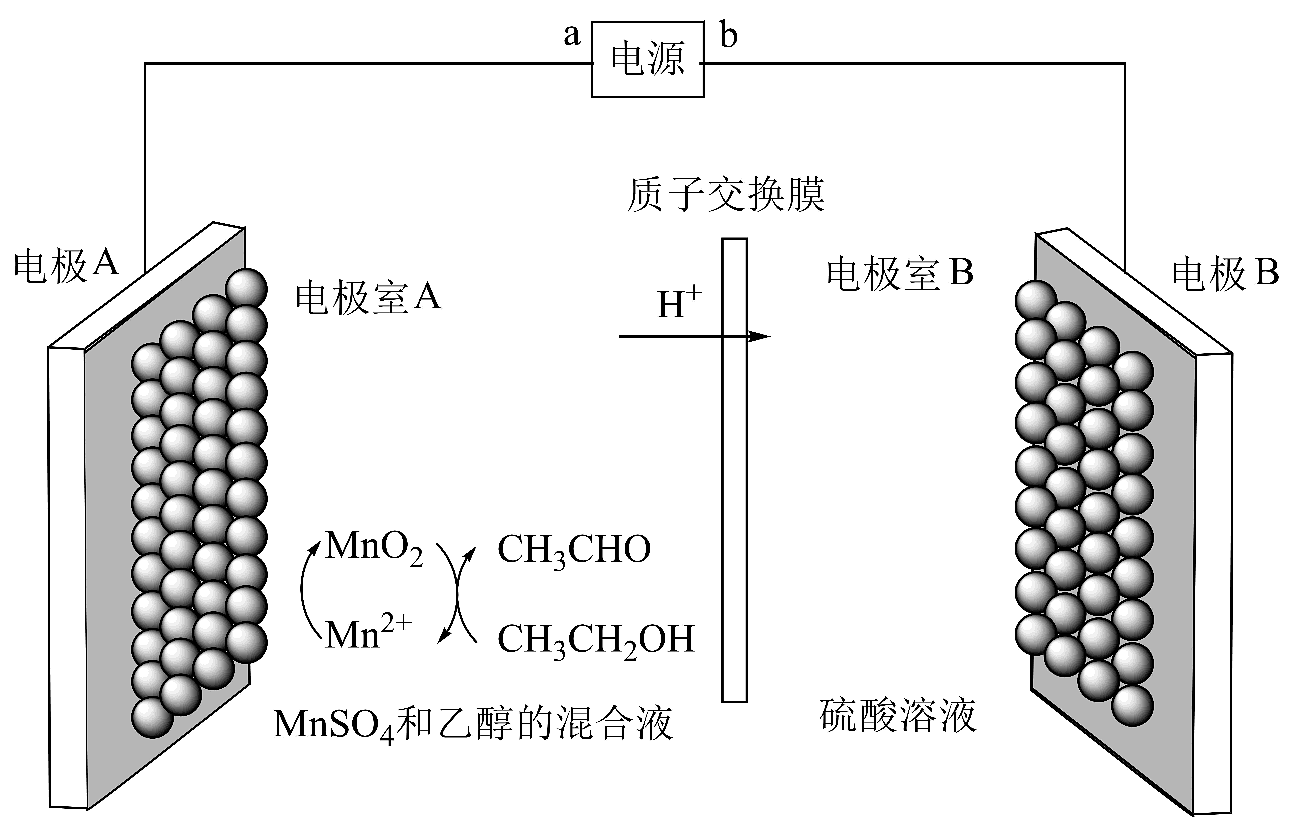 A、a为电源正极 B、电解过程中,电极室A的pH值不变,电极室B的pH值减小 C、电极B的电极反应为2H2O+2e-=H2↑+2OH- D、当生成n molCH3CHO时,理论上A、B两室溶液质量变化之和为n g
A、a为电源正极 B、电解过程中,电极室A的pH值不变,电极室B的pH值减小 C、电极B的电极反应为2H2O+2e-=H2↑+2OH- D、当生成n molCH3CHO时,理论上A、B两室溶液质量变化之和为n g -
5、某化合物的晶胞如图所示,下列说法不正确的是
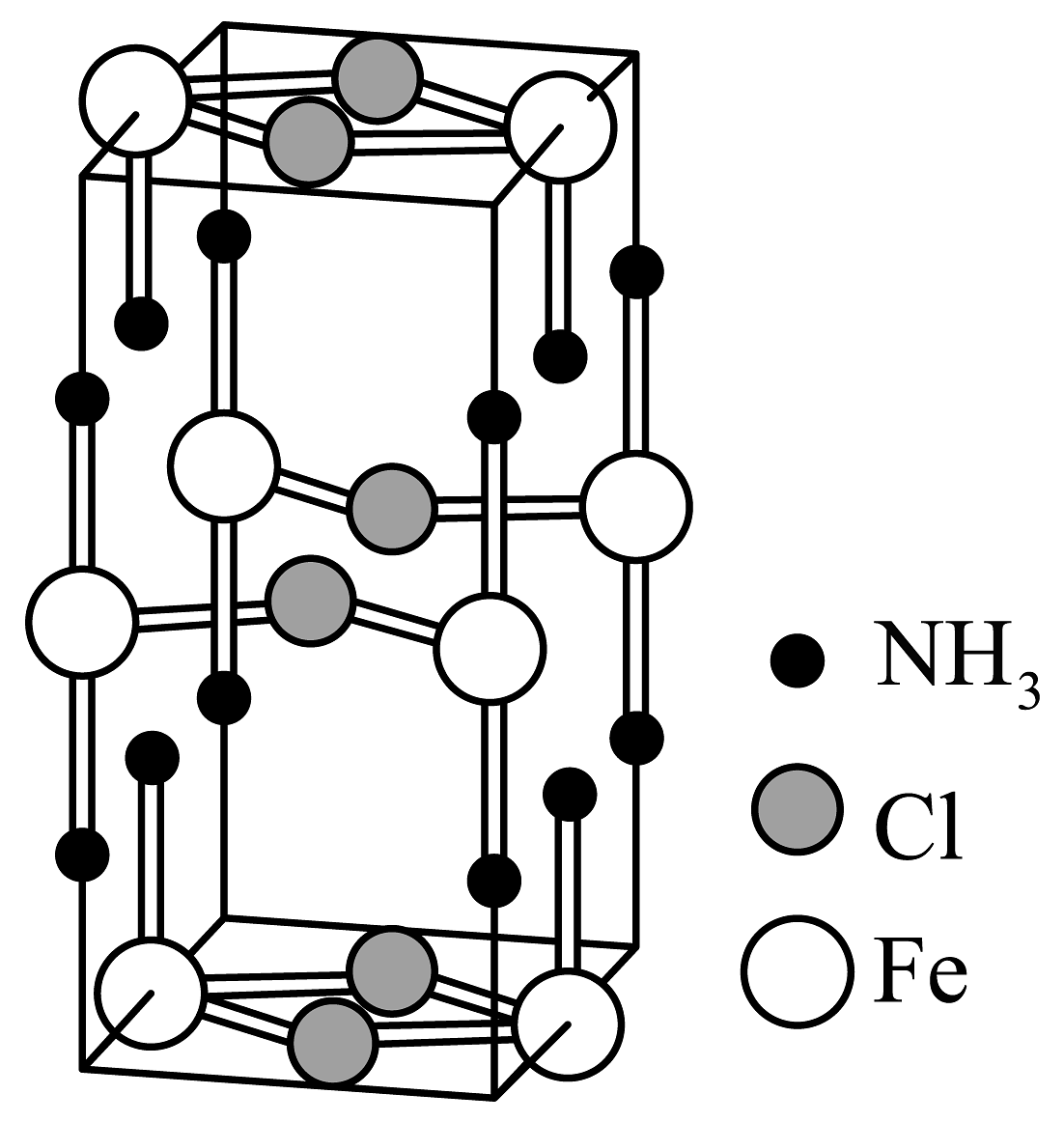 A、该物质化学式为Fe(NH3)2Cl2 B、该物质的熔点高于FeCl2 C、该晶体中含离子键、配位键 D、若该晶胞体积为a cm3 , 则晶胞的密度为g/cm3
A、该物质化学式为Fe(NH3)2Cl2 B、该物质的熔点高于FeCl2 C、该晶体中含离子键、配位键 D、若该晶胞体积为a cm3 , 则晶胞的密度为g/cm3 -
6、聚合物固态电解质(SPE)替代传统有机液态电解液,有望从根本上解决电池安全性问题,是电动汽车和规模化储能理想的化学电源。某SPE的基体材料结构如图所示,已知X、Y、Z为原子序数依次增大的短周期元素,Z的电负性为4.0,则下列说法错误的是
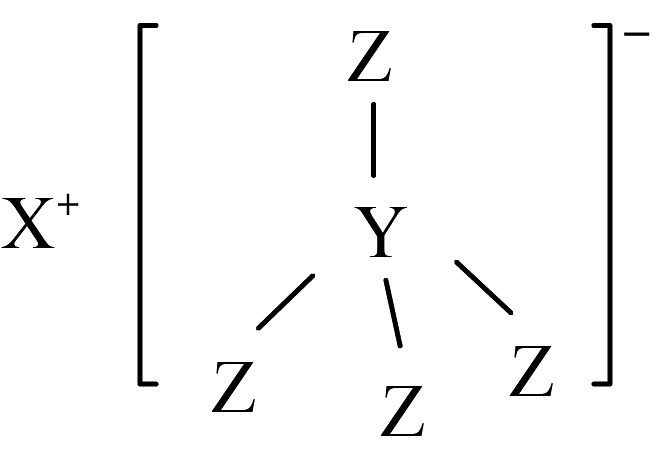 A、X的单质在空气中燃烧只生成一种氧化物 B、该物质的阴离子中含有配位键 C、Z是所在周期第一电离能最大的元素 D、Y的最高价氧化物对应的水化物是一元弱酸
A、X的单质在空气中燃烧只生成一种氧化物 B、该物质的阴离子中含有配位键 C、Z是所在周期第一电离能最大的元素 D、Y的最高价氧化物对应的水化物是一元弱酸 -
7、制备芯片需要大量使用光刻胶。光刻胶又称光致抗蚀剂,是指通过紫外光、电子束、离子束、X射线等的照射或辐射,其溶解度发生变化的耐蚀剂刻薄膜材料。如图是某种光刻胶的光交联反应。下列有关说法正确的是
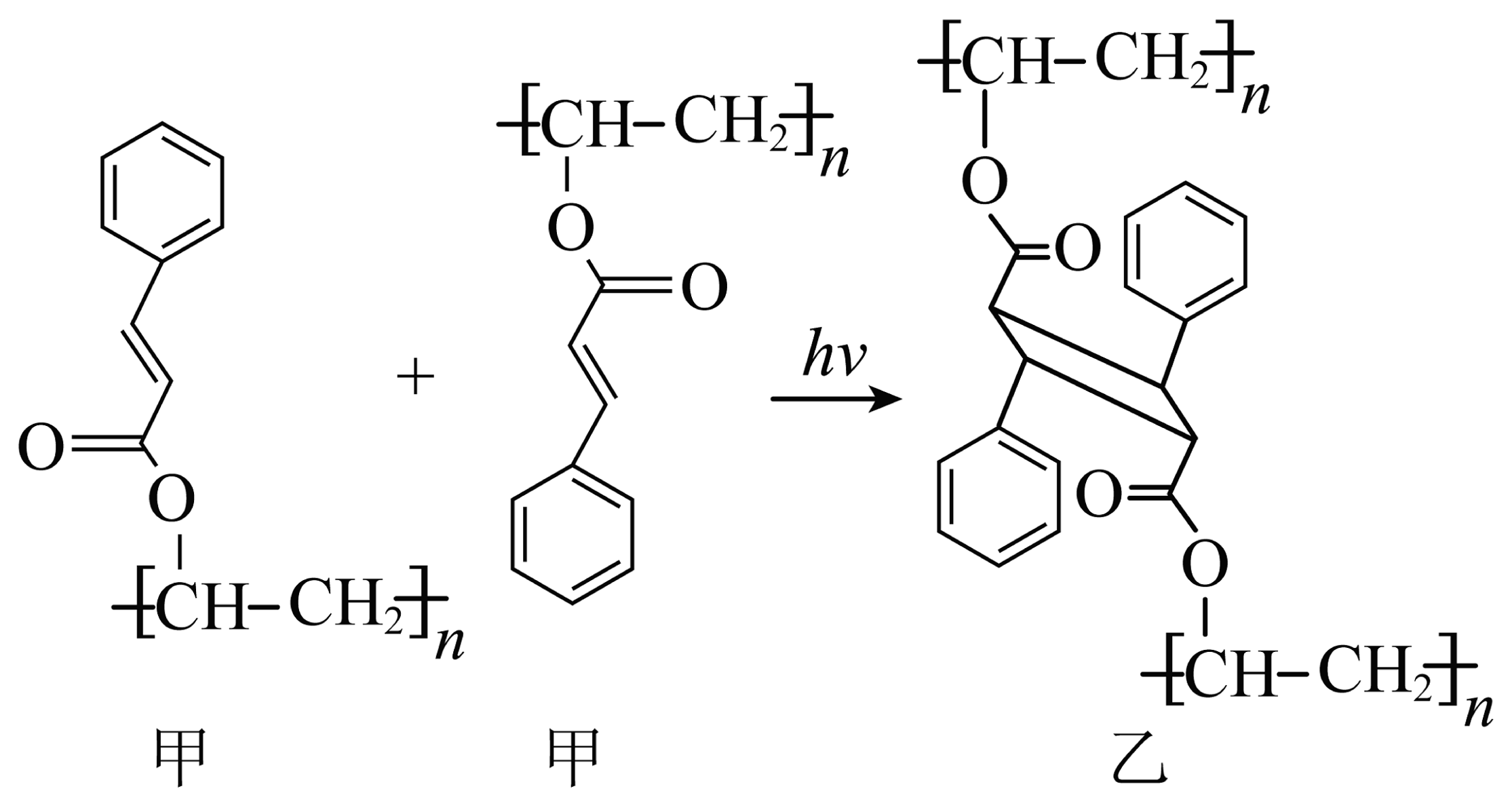 A、物质甲的单体的分子式为C11H8O2 B、1mol物质甲与足量H2加成时最多消耗3molH2 C、可利用红外光谱测量有机物的键长、键角 D、该光交联反应属于加成反应
A、物质甲的单体的分子式为C11H8O2 B、1mol物质甲与足量H2加成时最多消耗3molH2 C、可利用红外光谱测量有机物的键长、键角 D、该光交联反应属于加成反应 -
8、下列微观结构或现象不能解释其性质的是
选项
性质
结构因素
A
细胞膜的双分子膜层头向外,尾向内排列
细胞膜由大量两性分子(一端有极性,另一端无极性)组装而成
B
HCOOH的酸性强于CH3COOH
烷基是拉电子基团
C
原子光谱是不连续的线状谱线
原子核外电子的能量是量子化的
D
椅式环己烷(C6H12)比船式环己烷稳定
分子空间结构不同,椅式的空间位阻小
A、A B、B C、C D、D -
9、为达到实验目的,下列实验设计及现象都合理的是
选项
实验设计
实验目的
A
已知CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl−[CuCl4]2-(黄色)+4H2O,加热某浓度的CuCl2溶液,溶液由蓝色变为黄绿色
证明该平衡反应的正反应是吸热反应
B
加热使I2(s)升华
除去Fe粉中的I2
C
向丙烯醛溶液中滴加溴水,溴水褪色
验证丙烯醛中含碳碳双键
D
将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,溶液恢复红色
验证SO2的不稳定性
A、A B、B C、C D、D -
10、下列有关方程式书写不正确的是A、用处理含的废液,其离子方程式为: B、电解精炼铜的阴极反应:Cu2++2e−=Cu C、将SO2通入酸性KMnO4溶液中: D、证明NH3对Cu2+的配位能力强于H2O:
-
11、下列有关实验操作规范,说法不正确的是A、使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管 B、将结块的硝酸铵置于研钵中用研杵敲碎,研细 C、磨口玻璃瓶塞洗净、晾干后应在瓶塞处垫一张纸条以免瓶塞与瓶口粘连 D、制取氧气后,剩余的高锰酸钾固体需要配成溶液或转化为其它物质后排放
-
12、下列化学用语或图示表示正确的是A、晶态和非晶态SiO2粉末的X射线衍射图谱对比:
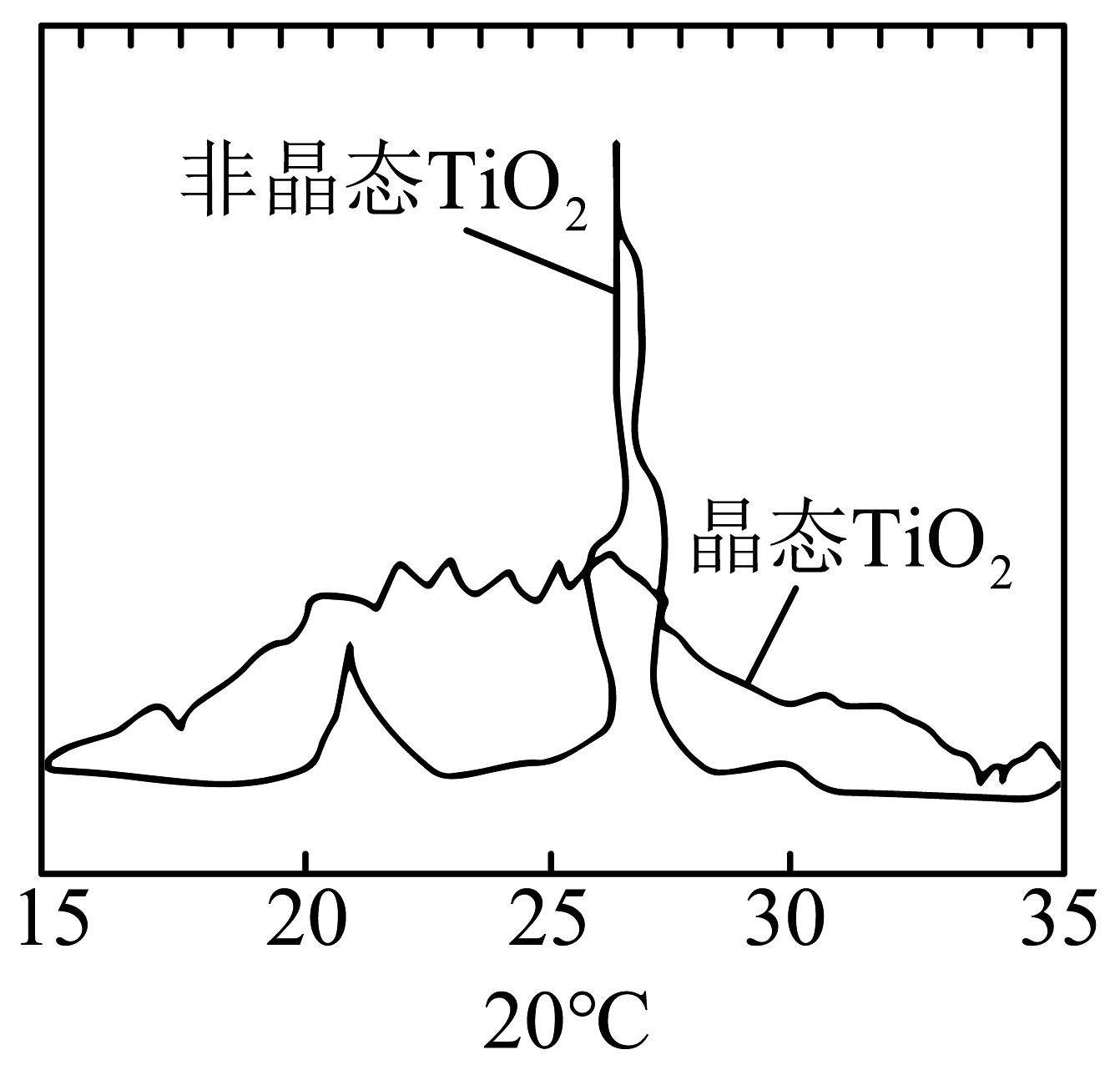 B、基态29Cu原子的价层电子轨道表示式:
B、基态29Cu原子的价层电子轨道表示式: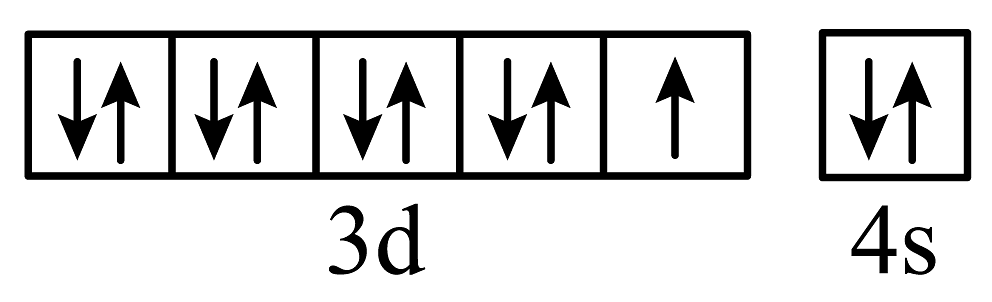 C、中子数为20的Ca原子:Ca
D、SO的VSEPR模型为:
C、中子数为20的Ca原子:Ca
D、SO的VSEPR模型为: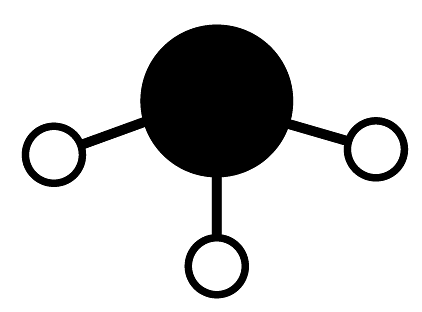
-
13、2025年央视春晚精彩纷呈,硬科技霸屏。下列有关说法正确的是A、机器人使用二氧化硅制造出的芯片,完美呈现舞蹈效果 B、歌曲《山鹰和兰花花》传达了对生态环境的关注,二氧化碳能引起温室效应,是常见的空气污染物 C、春晚展示的非物质文化遗产“打铁花”,利用了铁元素的焰色 D、《山水霓裳》中李子柒的服装采用丝绸制成,丝绸的主要成分是蛋白质
-
14、某研究小组按下列路线可以合成药物氯氮平的中间体H。

已知:①
 ;②
;② 。
。请回答下列问题:
(1)、化合物D的官能团名称是。(2)、化合物B的结构简式是。(3)、下列说法不正确的是___________。A、硝化反应的试剂可用浓硝酸和浓硫酸 B、中间H的分子式为C18H19ClN4O C、化合物B具有两性 D、从C→E的反应推测,化合物D中硝基间位氯原子比邻位的活泼(4)、写出E→G的化学方程式。(5)、写出同时符合下列条件的化合物C的同分异构体的结构简式。①属于芳香族化合物;
②能在NaOH溶液中发生水解;
③1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子。
(6)、设计以CH2=CH2和CH3NH2为原料合成F( )的路线(用流程图表示,无机试剂任选)。
)的路线(用流程图表示,无机试剂任选)。 -
15、
环己烯是重要的化工原料。其实验室制备流程如下:

请回答下列问题:
I.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为 , 现象为。
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为。
②浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
(3)操作2用到的玻璃仪器是。
(4)将操作3(蒸馏)的步骤补齐:。(填写序号)
___________→___________→___________→___________→___________→弃去前馏分,收集83℃的馏分
①检验装置的气密性 ②点燃酒精灯,加热 ③加入待蒸馏的物质和沸石 ④接通冷凝水 ⑤安装蒸馏装置
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入b mol Br2(过量),与环己烯充分反应后,剩余的Br2与足量KI作用生成I2 , I2与Na2S2O3标准溶液反应,最终消耗c mol·L-1Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+

②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(5)样品中环己烯的质量分数为(用字母表示)。
-
16、锰氧化物具有较大应用价值,请回答下列问题:(1)、基态Mn原子的简化电子排布式:;同周期中,基态原子未成对电子数比Mn多的元素是(填元素符号)。(2)、Mn的某种氧化物MnOx的四方晶胞及其在xy平面的投影如图1所示,该氧化物化学式为;锰离子的配位数(紧邻的阴离子数)为。
 (3)、[BMIM]+BF(见图2)是MnOx晶型转变的诱导剂。BF的空间构型为;[BMIM]+中咪唑环存在大π键,则N原子采取的轨道杂化方式为。
(3)、[BMIM]+BF(见图2)是MnOx晶型转变的诱导剂。BF的空间构型为;[BMIM]+中咪唑环存在大π键,则N原子采取的轨道杂化方式为。 (4)、MnOx可作HMF转化为FDCA的催化剂(见下图3)。FDCA的熔点远大于HMF,其主要原因是。
(4)、MnOx可作HMF转化为FDCA的催化剂(见下图3)。FDCA的熔点远大于HMF,其主要原因是。 (5)、锰的部分含氧酸结构如下图4,酸性:HMnO4H2MnO4(填“>”或“<”),理由是。
(5)、锰的部分含氧酸结构如下图4,酸性:HMnO4H2MnO4(填“>”或“<”),理由是。
-
17、前四周期元素A、B、C、D、E、F的原子序数依次增大,其相关性质如表所示:
A
原子核外有6种运动状态不同的电子
B
元素原子的核外p电子数比s电子数少1个
C
地壳中含量最多的非金属元素
D
基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
E
E3+第三周期中半径最小的简单离子
F
基态F+各能级电子全充满
请回答下列问题:
(1)、F是区的元素;写出D2C2化合物的电子式:。(2)、A、B、C元素中,电负性最大的是;第一电离能最大的是。(填元素符号)(3)、B单质分子中σ键和π键的个数比 , C的简单氢化物在同族元素的简单氢化物中沸点出现反常,其原因是。(4)、写出E元素的最高价氧化物与D的最高价氧化物对应水化物反应的离子方程式。(5)、实验室合成一种由A和B两种元素形成的化合物,该化合物具有三维骨架结构。其中每个A原子与4个B原子形成共价键,每个B原子与3个A原子形成共价键,其化学式为。 -
18、以淀粉为基本原料可制备许多物质,如:

请回答下列问题:
(1)、上述①-⑤反应中,属于消去反应的是;属于氧化反应的是。(填写序号)(2)、若乙醇中的O原子用18O标记(乙酸中的O不需标记),写出乙醇与乙酸反应生成乙酸乙酯的化学方程式:。(3)、下列有关说法不正确的是___________。A、可用碘水检验淀粉是否水解完全 B、淀粉是生物大分子物质,反应①的反应条件是:稀硫酸,加热 C、乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性KMnO4溶液氧化 D、可利用红外光谱或核磁共振氢谱来区别葡萄糖和乙醛(4)、将3.00 g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:吸水剂
CO2吸收剂
实验前质量/g
20.00
26.48
实验后质量/g
21.08
30.00
①燃烧产物中水的物质的量为mol。
②该有机物的分子式为。
-
19、下列方案设计、现象和结论正确的是
选项
目的
方案设计
现象和结论
A
探究用“相似相溶”规律理解I2的溶解性
将一小粒碘晶体溶于约5mL蒸馏水中,观察碘在水中的溶解性。加入约1mL乙醇,振荡试管,观察溶液颜色变化
溶液分层,观察到紫红色的碘的乙醇溶液,说明碘易溶于有机溶剂
B
检验乙醇与浓硫酸在170℃下反应的气体产物
将乙醇与浓硫酸在170℃下反应的气体通入溴水中
溴水褪色,说明乙醇发生消去反应生成乙烯
C
探究苯环与烷基的相互作用
分别向盛有2mL苯和2mL甲苯的试管中加入几滴酸性KMnO4溶液,振荡
甲苯中KMnO4溶液褪色,苯中KMnO4溶液不褪色,说明甲基活化了苯环
D
检验有机物中是否含有卤素原子
取2mL样品于试管中,加入5mL20%
NaOH水溶液混合后加热,反应完全后,待反应液冷却,加入足量稀硝酸,再滴加AgNO3溶液
无沉淀生成,说明有机物中不含卤素原子
A、A B、B C、C D、D -
20、Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为a nm。下列叙述正确的是
 A、基态Mg核外电子有3种不同的空间运动状态 B、每个硅原子周围有4个镁原子 C、Mg与Si之间的最近距离为nm D、Mg2Si的密度计算式为
A、基态Mg核外电子有3种不同的空间运动状态 B、每个硅原子周围有4个镁原子 C、Mg与Si之间的最近距离为nm D、Mg2Si的密度计算式为