相关试卷
-
1、是工业制备的一种重要原料,很多物质的制备都需要用到氯气,比如工业上用制备 , 反应原理为: , 。已知:、的部分性质如下:
熔点/℃
沸点/℃
相对分子质量
其它
-112
75.5
137.5
遇水生成和HCl
2
105.3
153.5
遇水生成和HCl
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置已略去):
 (1)、仪器a的名称为 , 粗产品中空间构型为 , b中盛放的药品的作用。(2)、装置E中用软锰矿制备气体的离子方程式为。(3)、装置C中反应温度控制在60~65℃,原因是。(4)、通过测定三氯氧磷粗产品中氯元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:
(1)、仪器a的名称为 , 粗产品中空间构型为 , b中盛放的药品的作用。(2)、装置E中用软锰矿制备气体的离子方程式为。(3)、装置C中反应温度控制在60~65℃,原因是。(4)、通过测定三氯氧磷粗产品中氯元素含量,可进一步计算产品三氯氧磷的纯度,实验步骤如下:①取a g产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入 mol/L的溶液 mL,使完全沉淀,然后选择作指示剂,用 mo/L 溶液滴定过量至终点(),记下所用体积为 mL。滴定终点的现象:。
(5)、产品中氯元素的质量分数为。(6)、资料表明,与性质相近,乙醇在过量无水的作用下制备溴乙烷的反应机理如下图所示,请写出该条件下制备溴乙烷总反应方程式。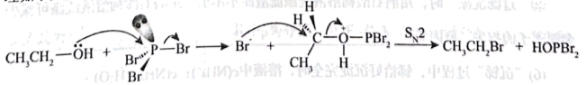
-
2、回收利用废旧锂离子电池正极材料钴酸锂粗品来制备产品,可实现资源的循环利用。其工艺流程如下。

已知:①氯化胆碱[]是铵盐,熔点较低,熔点较高;
②在溶液中常以(蓝色)和(粉红色)形式存在;
③常温下,;
下列说法错误的是( )
A、将废旧电池拆解并将其浸入NaCl溶液中,其目的是进行放电处理,使得锂离子从负极脱出,经过电解质溶液进入正极材料 B、“微波共熔”中氯化胆碱的作用是作为反应物提供做助熔剂,降低熔融所需的温度 C、“沉钴”过程发生反应的离子方程式为 D、“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为 -
3、电解苯酚的乙腈()水溶液可在电极上直接合成扑热息痛(
 ),电极材料均为石墨,电极c的电极反应式为
),电极材料均为石墨,电极c的电极反应式为
 。下列说法错误的是( )
。下列说法错误的是( ) A、硫酸根离子向甲室移动 B、电极d的电极反应类型是还原反应 C、电极b的电极反应式为: D、合成1mol扑热息痛,理论上甲室质量增重96g
A、硫酸根离子向甲室移动 B、电极d的电极反应类型是还原反应 C、电极b的电极反应式为: D、合成1mol扑热息痛,理论上甲室质量增重96g -
4、新型贮氢材料[]的晶胞结构如图所示。下列说法错误的是( )
 A、该晶体属于离子晶体 B、具有很强的还原性 C、与A点距离最近的的个数为4 D、表示阿伏加德罗常数的值,则该物质的密度为
A、该晶体属于离子晶体 B、具有很强的还原性 C、与A点距离最近的的个数为4 D、表示阿伏加德罗常数的值,则该物质的密度为 -
5、实验室由环己醇(
 )制备环己酮(
)制备环己酮( )的过程如下:
)的过程如下:
已知:①主反应为
 , 该反应为放热反应;
, 该反应为放热反应;②环己酮可被强氧化剂氧化;
③环己酮的沸点为155.6℃,能与水形成沸点为95℃的共沸混合物;
④NaCl水溶液的密度比水的大,无水易吸收水分。
下列说法错误的是( )
A、分批次加入溶液,可防止副产物增多 B、反应后加入少量草酸溶液的目的是调节pH C、操作1为蒸馏,收集150~156℃的馏分 D、实验过程中获取③的操作为过滤 -
6、为完成相应实验目的,下列方案设计、现象和结论均正确的是( )
选项
实验目的
方案设计
现象
结论
A
探究温度对化学平衡的影响
把装有和混合气体的烧瓶浸泡在热水中
烧瓶中气体颜色加深
转化为的反应为放热反应
B
探究浓硝酸与炭在加热条件下能否反应
将红热的木炭投入浓硝酸中
产生红棕色气体
炭与浓硝酸在加热条件下反应生成
C
探究淀粉的水解
在试管中加入0.5g淀粉和4mL 2mol/L 溶液,加热,待溶液冷却后,再加入少量新制的氢氧化铜,加热
无沉淀生成
说明淀粉没有发生水解
D
探究、的溶解度的大小
向2mL 1mol/L NaOH溶液中依次滴加0.1mol/L的和溶液各1mL
先产生白色沉淀,后产生红褐色沉淀
溶解度:大于
A、A B、B C、C D、D -
7、W、X、Z、Y、N为原子序数依次增大的短周期主族元素,W与Y原子的最外层电子数之和等于X原子的最外层电子数,五种元素能组成如图所示的物质。下列说法错误的是( )
 A、最高价氧化物对应水化物的酸性:N>Y B、简单氢化物的沸点:X>N>Y C、元素的第一电离能:N>Y>Z D、简单离子半径:N>Y>X>Z
A、最高价氧化物对应水化物的酸性:N>Y B、简单氢化物的沸点:X>N>Y C、元素的第一电离能:N>Y>Z D、简单离子半径:N>Y>X>Z -
8、常温下,在10mL 0.1MOH溶液中滴加pH=1的盐酸,溶液中AG()与盐酸体积(V)之间的关系如图所示,下列说法不正确的是( )
 A、P点→Q点:水的电离程度变小 B、G点: C、 D、F点溶液中:
A、P点→Q点:水的电离程度变小 B、G点: C、 D、F点溶液中: -
9、苯与Cl2的反应机理如下图一所示,其反应过程中的能量变化如图二所示。下列说法正确的是( )

 A、苯和Cl2反应的速率由过程Ⅱ的速率决定 B、FeCl3的参与改变了反应历程,降低了总反应的焓变 C、反应过程中有极性键和非极性的断裂和生成 D、升温既能提高反应速率,又能提高苯的平衡转化率
A、苯和Cl2反应的速率由过程Ⅱ的速率决定 B、FeCl3的参与改变了反应历程,降低了总反应的焓变 C、反应过程中有极性键和非极性的断裂和生成 D、升温既能提高反应速率,又能提高苯的平衡转化率 -
10、含的稀硫酸溶解铜可得到溶液,向制备得到的溶液中逐滴加入氨水,产生蓝色沉淀,继续滴加氨水并振荡试管得到深蓝色透明溶液,再加入95%乙醇,析出蓝色晶体。已知为阿伏加德罗常数的值,下列有关说法不正确的是( )A、在水中的溶解度大于其在乙醇中的溶解度 B、分子中小于中的 C、中Cu的杂化方式为 D、1mol 含有σ键数20
-
11、有机物M(
 )是合成某种水稻除草剂的中间体。下列说法正确的是( ) A、有机物M分子存在对映异构 B、有机物M中的所有碳原子有可能共平面 C、有机物M的一氯代物有5种 D、1mol有机物M最多能和3mol 发生加成反应
)是合成某种水稻除草剂的中间体。下列说法正确的是( ) A、有机物M分子存在对映异构 B、有机物M中的所有碳原子有可能共平面 C、有机物M的一氯代物有5种 D、1mol有机物M最多能和3mol 发生加成反应 -
12、下列离子方程式正确的是( )A、将碘单质溶于碘化钾溶液中: B、用浓氨水吸收烟气中的: C、以铜为电极电解饱和氯化钠溶液阳极电极反应式: D、与足量氢氧化钠溶液共热:
-
13、实验室由硫铁矿烧渣(含FeO、、等)制取无水氯化铁的实验原理和装置不能达到实验目的的是( )
 A、用装置甲溶解硫铁矿烧渣 B、用装置乙过滤得到含、混合溶液 C、用装置丙氧化得到溶液 D、用装置丁蒸干溶液获得无水
A、用装置甲溶解硫铁矿烧渣 B、用装置乙过滤得到含、混合溶液 C、用装置丙氧化得到溶液 D、用装置丁蒸干溶液获得无水 -
14、常用于微电子工业,可由反应制备。下列说法正确的是( )A、的VSEPR模型
 B、中子数为2的H原子可表示为
C、F原子的结构示意图为
B、中子数为2的H原子可表示为
C、F原子的结构示意图为 D、的电子式为
D、的电子式为
-
15、化学和生活、科技、社会发展息息相关,下列说法错误的是( )A、神舟系列飞船返回舱使用氮化硅耐高温材料,属于共价晶体 B、三星堆黄金面具出土时光亮且薄如纸,说明金不活泼和有良好的延展性 C、利用合成了高级脂肪酸,实现了无机小分子向有机高分子的转变 D、高铁酸钾()对饮用水有杀菌消毒和净化的作用
-
16、有机物I是某精神类药物的重要中间体,其合成路径如下:

已知:
①

②

请回答:
(1)、有机物F中的官能团名称为。(2)、有机物B的结构简式为。(3)、下列说法正确的是____。A、有机物A在水中的溶解度比 大
B、a、b在酸性条件下水解生成的酸的酸性:a>b
C、A→D的三步反应均为取代反应
D、H→I在适当的酸性条件下,可以提高有机物I的平衡产率
(4)、写出E+G→H的化学方程式。(5)、重要的络合剂EDTA的结构为
大
B、a、b在酸性条件下水解生成的酸的酸性:a>b
C、A→D的三步反应均为取代反应
D、H→I在适当的酸性条件下,可以提高有机物I的平衡产率
(4)、写出E+G→H的化学方程式。(5)、重要的络合剂EDTA的结构为 , 请以乙烯为原料,设计合成EDTA的路线(用流程图表示,无机试剂任选,最终产物可用EDTA表示)。 (6)、写出3种同时满足下列条件的化合物C的同分异构体的结构简式。
, 请以乙烯为原料,设计合成EDTA的路线(用流程图表示,无机试剂任选,最终产物可用EDTA表示)。 (6)、写出3种同时满足下列条件的化合物C的同分异构体的结构简式。①谱表明分子中只有3种不同化学环境的氢原子;
②分子中存在苯环,且是苯环的邻位二取代物。
-
17、二氧化硫脲[]()为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:

部分实验装置如图所示:

已知:
①滤液b主要成分为硫脲[](),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[]。
请回答:
(1)、仪器Y的名称是。(2)、下列说法正确的是____。A、装置B中装的X溶液为饱和溶液 B、装置E中的与发生氧化还原反应,起到尾气处理的作用 C、装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 D、步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀(3)、装置A的气密性检查操作为。(4)、请写出溶液b生成二氧化硫脲的化学方程式。(5)、步骤5中将溶液温度下降到5℃的目的是。(6)、为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000 溶液进行滴定,测得消耗溶液体积为10.00mL。
涉及到的反应有:
②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000% 溶液,静置2分钟。改用0.1000 溶液进行滴定,测得消耗溶液为16.00mL。
涉及到的反应有:
该产品中二氧化硫脲的质量分数为。
-
18、二氯乙烷为原料制备氯乙烯是合成氯乙烯的一种重要的方法。请回答:(1)、热裂解反应为:
已知相关物质的标准熵数值如下表:
化学式
(l)
HCl(g)
(g)
标准熵:S/()
305.90
186.90
264.00
①该反应的标准熵变;
②已知 , 该反应在下列哪些温度下能自发进行?(填标号);
A.0.39K B.0.49K C.500K D.525K
(2)、密闭恒容容器中充满1.0mol/L CH2Cl-CH2Cl(g),保持温度773K,只发生以下反应。反应Ⅰ:
反应Ⅱ:
研究发现,反应Ⅰ活化能远小于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。未加入催化剂下进行反应,各物质的浓度与反应时间的变化关系如图所示,t时刻测得CH2=CHCl、H2的浓度分别为0.80 mol/L、0.10 mol/L。

①反应Ⅰ的平衡常数为mol/L。
②其他条件不变,若反应温度高于773K且保持不变,则图示点a、b中,CH2=CHCl的浓度峰值点可能是(填标号)。
③相同条件下,若反应起始时加入足量的氮掺杂活性炭催化剂(该催化剂仅对反应Ⅰ有加速作用),则图示点a、b、c、d中,CH2=CHCl的浓度峰值点可能是(填标号),解释原因。
(3)、现投入CH≡CH与CH2Cl-CH2Cl于密闭恒容中,可能发生的反应如下:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
若用氮掺杂活性炭作催化剂,只发生反应Ⅰ和Ⅱ;若用和作催化剂,只发生反应Ⅲ。不考虑催化剂活性降低或丧失,下列说法不正确的是____。
A、温度升高,反应Ⅲ的平衡常数K增大 B、其他条件不变,氮掺杂活性炭作催化剂,HCl平衡浓度随温度升高而增大 C、其他条件不变,和作催化剂,减少容器体积对平衡产率不影响 D、其他条件不变,CH2Cl-CH2Cl的平衡转化率大小比较:氮掺杂活性炭作催化剂>和作催化剂 -
19、某固体混合物A由FeSO4、ZnCl2和Cu(NO3)2组成,3种物质的物质的量之比为1∶1∶1。进行如下实验:

已知:①Zn2+的化学性质与Al3+相似,但会形成[Zn(NH3)4]2+。
②一些阳离子的开始沉淀至完全沉淀的范围:Fe2+(6.3~8.3)、Fe3+(1.5~2.8)、Zn2+(5.4~8.0)、Cu2+(4.7~6.2)。
③Ag2SO4微溶于硝酸。
请回答:
(1)、气体B的主要成分为 , 2mol气体B与1mol Cl2化合生成2mol C,C的空间构型为。(2)、溶液F中除OH-、Cl-外的阴离子还有。(3)、下列说法正确的是____。A、根据实验中的转化关系可得: B、调pH范围应控制在2.8~5.4 C、X可以使用氨水或NaOH D、气体B是形成光化学烟雾的罪魁祸首之一(4)、请设计实验检验A中的氯离子。(5)、新制蓝色沉淀的悬浊液中通入SO2 , 产生紫红色固体,写出该反应离子方程式:。 -
20、P可形成许多结构和性质特殊的化合物。请回答下列问题:(1)、P元素位于周期表的第15列。
①基态P原子的价电子轨道表示式为。
②下列说法不正确的是。
A.非金属性:As<P<N
B.第二电离能()大小:(Si)<(P)<(S)<(Na)
C.电负性:P<As<O
D.O-H键的键能:
(2)、常温下,五氯化磷为白色固体,熔融状态下能导电,气态时以PCl5分子存在。①气态PCl5分子结构如图所示,O位于等边三角形ABC的中心,DOE垂直于ABC的平面,黑球为P,白球为Cl,比较键长大小:键长ODOA(填“>”“<”或“=”)。

②五氯化磷熔融时,电离出的离子分别含sp3和sp3d2杂化态,写出阴离子化学式。
③PCl5不能与金属Ni反应,而PCl3能与金属Ni反应,解释PCl3能与金属Ni反应的原因。
(3)、Ga与P形成的某化合物晶体的结构如图。该化合物的化学式为 , P的配位数为。