相关试卷
-
1、某化合物A(由三种元素构成),为了探究其组成,进行如下实验

已知:气体D在标准状况下的密度为1.25g/L。试回答:
(1)、黑色固体E的化学式。(2)、写出溶液F中通入过量的离子方程式。(3)、写出化合物A隔绝空气加热的化学方程式。(4)、写出检验黄色溶液G中金属阳离子的方法:。(5)、红褐色固体K受热完全分解生成红棕色固体,某同学取该红棕色固体与一定量的反应后的固体,溶于足量稀盐酸中,再往其中滴加硫氰化钾溶液,溶液未变红。该同学得出结论:红棕色固体已反应完。你认为该同学的结论是否正确?(填“是”或“否”),请结合离子方程式说明原因。 -
2、在光照条件下,加氢制的一种催化机理如图所示,下列说法正确的是
 A、没有的介入,和就不能转化为和 B、反应过程中释放出带负电荷的 C、该反应的化学方程式为 D、是反应的催化剂
A、没有的介入,和就不能转化为和 B、反应过程中释放出带负电荷的 C、该反应的化学方程式为 D、是反应的催化剂 -
3、是强氧化剂,也是航天航空、水下作业的供氧剂。近几年科学家研制出较锂电池稳定性更高、电压损失更小的“钠—空气电池”。其反应原理是: , 装置如图,其中电解液为 , 可传导。电池放电时,下列说法不正确的是
 A、A电极为负极,发生氧化反应 B、向电极移动 C、外电路电流方向为 D、当转移电子时,消耗(标准状况)
A、A电极为负极,发生氧化反应 B、向电极移动 C、外电路电流方向为 D、当转移电子时,消耗(标准状况) -
4、以下属于放热反应的是A、盐酸与碳酸氢钠反应 B、氢氧化钠与盐酸反应 C、氯化铵晶体与晶体反应 D、灼热的碳与二氧化碳反应
-
5、某溶液中含有较大量的Cl-、、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A、①②④②③ B、④②①②③. C、①②③②④ D、④②③②① -
6、《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”据此推测,“青矾”的主要成分为A、 B、 C、 D、
-
7、氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是A、HI和HCl B、HCl和HIO C、HClO3和HIO D、HClO和HIO
-
8、由下列实验操作及现象能得出相应结论的是
实验操作
现象
结论
A
将溴丁烷与氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
可证明产生的气体中有烯烃
B
在物质X柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡
石蜡熔化呈椭圆形
说明物质X为非晶体
C
碳与二氧化硅在高温下反应
有单质生成
非金属性:
D
向盛有固体的试管中加入溶液
白色固体溶解
促进的沉淀溶解平衡向溶解方向移动
A、A B、B C、C D、D -
9、利用离子液体可电沉积还原金属Ge,其中的结构如图所示。下列有关说法错误的是
 A、该离子液体能导电 B、的空间构型为正四面体形 C、该物质中碳原子的杂化类型为 D、电解沉积金属时,金属在阴极析出
A、该离子液体能导电 B、的空间构型为正四面体形 C、该物质中碳原子的杂化类型为 D、电解沉积金属时,金属在阴极析出 -
10、缓释布洛芬具有解热、镇痛、抗炎等功效,一种合成缓释布洛芬的路线如下:

回答下列问题:
(1)、化合物Ⅰ的分子式为 , 缓释布洛芬的结构简式为。(2)、化合物Ⅱ易溶于水的原因是 , 化合物Ⅳ+Ⅴ→Ⅵ的反应类型是。(3)、根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。序号
结构特征
可反应的试剂
反应形成的新结构
反应类型
①
、Ni

还原反应
②
Na
取代反应
(4)、写出Ⅲ→Ⅳ的化学方程式:。(5)、同时满足下列条件的化合物Ⅴ的同分异构体共有种(不考虑立体异构),其中核磁共振氢谱中峰面积比为6∶3∶2∶2∶1的结构简式为。①属于芳香族化合物;②苯环上含有两个取代基。
-
11、室温下,在P和Q浓度相等的混合溶液中,同时发生反应①P+Q=X+Z和反应②P+Q=Y+Z,反应①和②的速率方程分别是v1=k1c2(P)、v2=k2c2(P)(k1、k2为速率常数)。反应过程中,Q、X的浓度随时间变化情况如图所示。下列说法错误的是
 A、反应开始后,体系中X和Y的浓度之比保持不变 B、45min时Z的浓度为0.4mol·L-1 C、反应①的活化能比反应②的活化能大 D、如果反应能进行到底,反应结束时,有40%的P转化为Y
A、反应开始后,体系中X和Y的浓度之比保持不变 B、45min时Z的浓度为0.4mol·L-1 C、反应①的活化能比反应②的活化能大 D、如果反应能进行到底,反应结束时,有40%的P转化为Y -
12、溴酸钠和氯化钠的溶解度(S)曲线如图所示。下列各组物质分离提纯方法错误的是

选项
待分离提纯的物质
分离提纯方法
A
分离苯和水
分液
B
除去溴酸钠中的少量氯化钠
重结晶
C
除去乙炔中的少量气体
用溶液洗气
D
除去苯中的少量苯酚
过滤
A、A B、B C、C D、D -
13、常用于微电子工业,可由反应制备。下列说法正确的是A、的VSEPR模型
 B、中子数为2的H原子可表示为
C、F原子的结构示意图为
B、中子数为2的H原子可表示为
C、F原子的结构示意图为 D、的电子式为
D、的电子式为
-
14、油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶7 -
15、是一种液体燃料。利用和合成的主要反应为
反应Ⅰ
反应Ⅱ
在密闭容器中, , 时,平衡转化率、在催化剂作用下反应tmin所测得的实际转化率及的选择性随温度的变化如图所示。的选择性可表示为。
下列说法不正确的是
 A、0~tmin内,240℃下反应Ⅰ的速率比在280℃下大 B、从220℃~280℃,的平衡产率先增大后缓慢减小 C、280℃时增大压强,的转化率可能大于40% D、需研发低温下转化率高和选择性高的催化剂
A、0~tmin内,240℃下反应Ⅰ的速率比在280℃下大 B、从220℃~280℃,的平衡产率先增大后缓慢减小 C、280℃时增大压强,的转化率可能大于40% D、需研发低温下转化率高和选择性高的催化剂 -
16、已知室温下, , , 。用含少量的酸性溶液制备NiOOH的过程如下。下列说法正确的是
 A、溶液中: B、的NaClO溶液中: C、“调pH”得到的上层清液中: D、“氧化”时主要发生反应:
A、溶液中: B、的NaClO溶液中: C、“调pH”得到的上层清液中: D、“氧化”时主要发生反应: -
17、丙烯腈(
 )是合成橡胶及合成树脂等工业中的重要原料,以
)是合成橡胶及合成树脂等工业中的重要原料,以 为原料合成丙烯腈的反应过程如下:
为原料合成丙烯腈的反应过程如下:反应Ⅰ:

反应Ⅱ:

科学家通过计算得出反应Ⅱ的历程包含p、q两步,其中p步反应的化学方程式为:
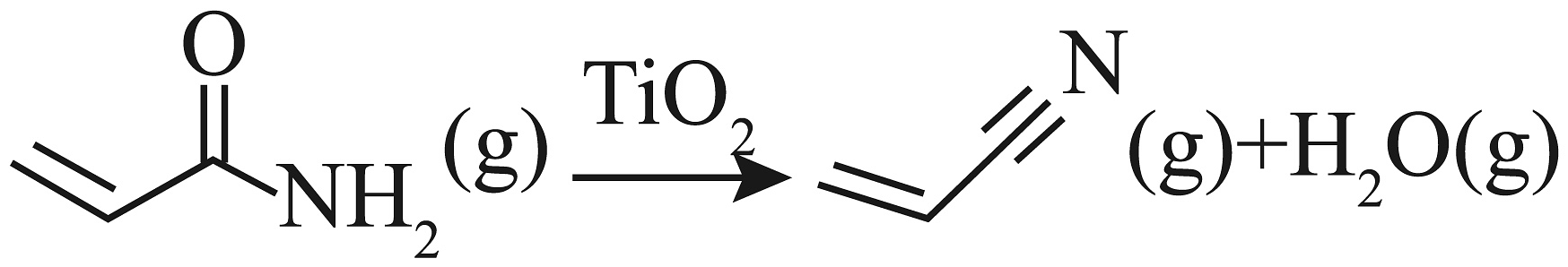
已知:部分化学键键能如下表所示:
化学键
键能(kJ·mol-1)
413
463
389
348
305
615
351
745
891
(1)、q步反应的热化学方程式为。(2)、在盛有催化剂、压强为的恒压密闭容器中按体积比充入 和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。
和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。
①0(填“>”“<”)。
②含碳物质检测过程中,未检测出
 , 反应活化能相对大小应为pq(填“>”或“<”)。
, 反应活化能相对大小应为pq(填“>”或“<”)。③M点时,体系中的体积分数(保留三位有效数字)。
④N点时,反应Ⅱ的压强平衡常数(保留三位有效数字);范围内,物质的量分数表示的平衡常数的相对大小:反应Ⅰ反应Ⅱ(填“>”“<”或“=”)。
⑤上述条件下丙烯腈的平衡产率不高,实际生产中会向反应器中再充入一定量(不参与反应),请解释该操作的目的并说明理由。
-
18、某研究小组通过下列路线合成药物西地那非。

已知:Mc为甲基(—CH3),Et为乙基(—CH2CH3),Pr为正丙基(—CH2CH2CH3);化合物I中不存在一个氮原子与两个羰基直接相连的结构。
请回答:
(1)、化合物A的含氧官能团的名称是。(2)、试剂Y的结构简式是。(3)、下列说法正确的是___________。A、D→E的反应条件X为浓硝酸、浓硫酸并适当加热 B、化合物I→J的反应主要经历了加成和消去的过程 C、保持其它条件不变,若将B→C中的CH3I改为CH3Cl,则该反应速率将变快 D、可通过测定K的质谱图来确定J→K中ClSO3H参与反应的是Cl原子还是OH基团(4)、写出F与过量NH3反应生成G的化学方程式。(5)、有机玻璃是一种重要的塑料( ),可通过化合物W(
),可通过化合物W( ),聚合得到。设计以丙酮和甲醇为原料合成W的路线(用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。
),聚合得到。设计以丙酮和甲醇为原料合成W的路线(用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。①分子中含有苯环;
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,有氮氧键,无氧氢键和氧氧键;
③分子中没有两个甲基连在同一个碳原子上。
-
19、一种燃煤烟气中CO2的捕集和资源再利用技术可通过图转化过程实现。
 (1)、以过渡金属作催化剂,利用图所示装置可实现“转化”。写出阴极表面的电极反应方程式。
(1)、以过渡金属作催化剂,利用图所示装置可实现“转化”。写出阴极表面的电极反应方程式。 (2)、CO2可以被NaOH溶液捕获。若所得溶液 , 则溶液中含碳微粒(①H2CO3、②、③)的浓度由大到小的顺序为(填序号)。(室温下,的;)(3)、在催化剂下,CO2氧化C2H6可获得C2H4.其主要化学反应为:
(2)、CO2可以被NaOH溶液捕获。若所得溶液 , 则溶液中含碳微粒(①H2CO3、②、③)的浓度由大到小的顺序为(填序号)。(室温下,的;)(3)、在催化剂下,CO2氧化C2H6可获得C2H4.其主要化学反应为:反应I.
反应Ⅱ.
反应Ⅲ.
将4 mol C2H6和6 mol CO2的混合气体置于1.0L恒容密闭容器中反应,乙烷的平衡转化率、乙烯的选择性与温度关系如图所示(C2H4的选择性。

①=。
②M点反应I的平衡常数为(保留两位有效数字)。
③C2H4选择性随温度升高而下降的原因可能是。
(4)、用Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯,所得产物含C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后可改变反应的选择性。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表所示:
助剂
CO2转化率/%
各产物在所有产物中的占比/%
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
下列说法正确的是。
A.催化剂助剂主要在第Ⅰ步起作用
B.在Fe3(CO)12/ZSM-5中添加K助剂时,合成乙烯的效果最好
C.添加助剂不同,CO2加氢合成乙烯的平衡常数不同
D.Fe3(CO)12为簇状超分子,可活化CO
-
20、光盘金属层含有Ag(其它金属微量忽略不计),可以进行资源回收利用,下图为从光盘中提取Ag的工业流程:

已知:①气体A、气体D是空气的主要组成气体。
②配离子的形成是分步进行的: 。
③AgCl的 , 。
请回答:
(1)、已知Ag位于周期表的第五周期IB族,Ag的原子序数为;气体A的化学式为 , 写出溶液C中所有的阳离子。(2)、反应Ⅲ的离子方程式为。(3)、是一个可逆反应。①结合相关数据说明上述反应是可逆反应;
②设计实验验证上述反应是可逆反应。