相关试卷
-
1、下列关于有机化合物的说法不正确的是
A
B
C
D



木糖醇()是一种天然甜味剂,属于糖类化合物
聚乙烯由线型结构转变为网状结构能够增加材料的强度
DNA分子复制过程中存在氢键的断裂和形成
烷基磺酸钠(表面活性剂)在水中聚集形成的胶束属于超分子
A、A B、B C、C D、D -
2、下列实验操作对应的现象预测正确或能达到有关实验目的的是
 A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体
A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体 -
3、为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 , 铁电极的电极反应式为。因此,验证了Fe2+氧化性小于 , 还原性小于。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。
-
4、下列关于物质的结构或性质及解释都正确的是
选项
物质的结构或性质
解释
A
金属活动性:Mg>Al
第一电离能:Mg>Al
B
熔点:SiO2>CO2
相对分子质量:SiO2大于CO2
C
酸性:HCOOH>CH3COOH
O-H的极性:HCOOH强于CH3COOH
D
熔点:Cl2<Br2<I2
键能:Cl-Cl>Br-Br>I-I
A、A B、B C、C D、D -
5、钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点的为 , 晶胞边长为anm,下列说法中不正确的是
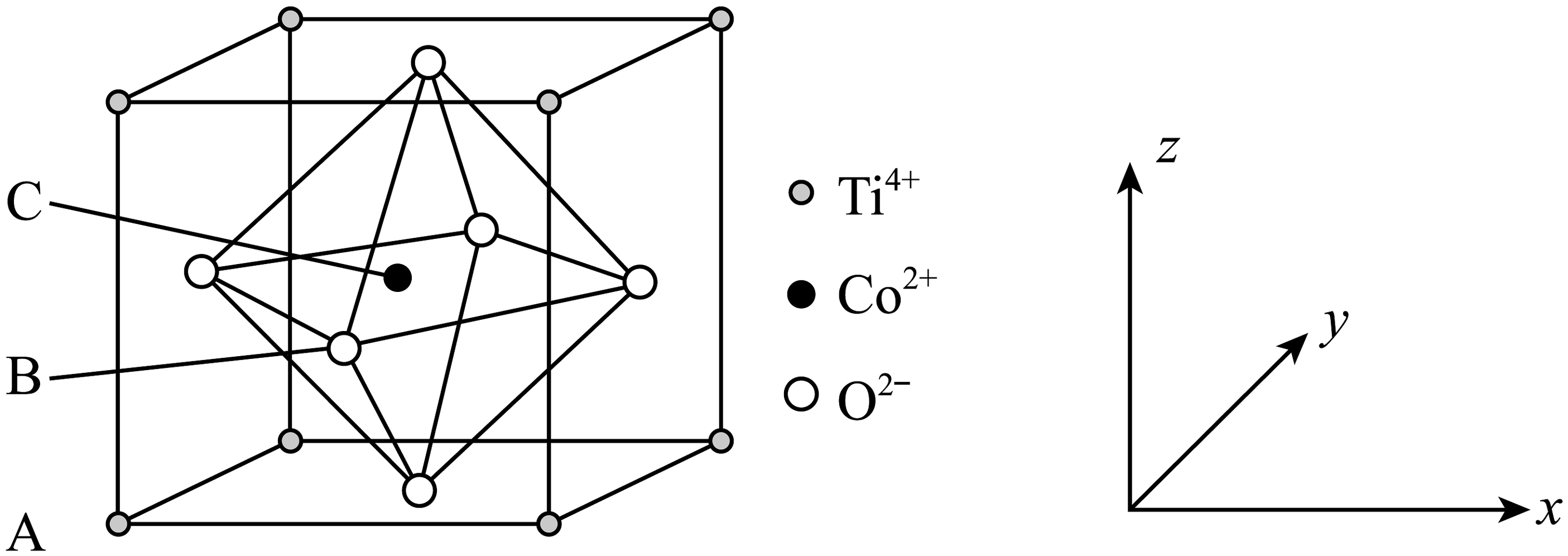 A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为
A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为 -
6、由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
 A、X分子中所有碳原子可处于同一平面 B、X、Z分子中均含有2个手性碳原子 C、1molZ最多只能与2molBr2发生反应 D、X、Y、Z均可与NaOH稀溶液发生反应
A、X分子中所有碳原子可处于同一平面 B、X、Z分子中均含有2个手性碳原子 C、1molZ最多只能与2molBr2发生反应 D、X、Y、Z均可与NaOH稀溶液发生反应 -
7、下列陈述Ⅰ和陈述Ⅱ均正确且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
的非金属性比Si强
溶液中滴加盐酸产生白色浑浊
B
的孤电子对数多于
的键角小于
C
共价键键能小于
晶体沸点高于
D
分子稳定性高于分子
分子间有氢键
A、A B、B C、C D、D -
8、2024年4月28日,神舟十七号、神舟十八号航天员乘组顺利完成交接仪式。航天员的宇航服需要用到多种材料,下列有关叙述错误的是A、制纯棉内衣用到的棉花的主要成分是纤维素 B、保暖层所用的鹅绒属于天然高分子材料 C、水冷层所用的聚氯乙烯属于饱和烃 D、防护层所用的聚酰胺纤维属于合成纤维
-
9、Ni可活化制得 , 其反应历程如图所示:

下列关于活化历程的说法正确的是
A、总反应的 B、总反应的速率由“中间体2→中间体3”决定 C、该反应过程中有碳氢键、碳碳键的断裂和形成 D、使用更高效的催化剂可降低反应所需的活化能和焓变 -
10、有一份含镁、铝的合金粉末样品,将其分为两等份,向第一份样品中加入过量的氢氧化钠溶液,得到336mLH2(标准状况),向第二份样品中加入100mL1mol/L的盐酸,完全反应后,得到672mLH2(标准状况)。试计算:(1)、原样品中铝的物质的量为。(2)、该合金中镁、铝的物质的量之比为。(3)、为将第二份样品反应后的溶液中的镁、铝元素完全分开,至少需加入1mol/L的NaOH溶液mL。
-
11、氨的催化氧化:是工业生产硝酸的重要步骤。某化学活动小组设计了如下装置模拟该实验过程,并检验产物性质(部分固定装置略去)。

请回答:
(1)、装置A发生的反应有浓氨水的分解,还有(用化学方程式表示)。(2)、装置B的名称为 , B中的药品X为(填选项)。A.浓硫酸 B.胆矾 C.碱石灰 D.碳酸钙
(3)、反应后,装置E中除存在较多的、外,还可能存在的一种阳离子是 , 试设计实验证明这种离子的存在。(4)、E中产生的离子反应方程式是。 -
12、硫酸渣是黄铁矿制备硫酸过程中得到的焙烧渣,主要含、等,工业上可用硫酸渣生产四氧化三铁。

已知:“还原”时,发生反应;与不反应。
请回答:
(1)、滤渣的主要成分是。(2)、溶于足量盐酸的离子方程式为。(3)、下列有关说法不正确的是___________。A、“酸溶”时适当提高硫酸浓度可加快反应速率 B、滤液经结晶过滤可得副产品芒硝 C、可由或铁粉替代 D、“还原”时氧化产物与还原产物的物质的量之比为(4)、“氧化”的条件为高温,写出该反应的化学方程式。 -
13、土豆丝放入水中浸泡,水变浑浊并产生白色沉淀,其主要成分是有机物A,A遇碘会变蓝。以A为原料获得有机物E的转化关系如下图,已知E是有香味的无色油状液体。F含有甲基,且与乙酸、乙醇均能发生酯化反应。

请回答:
(1)、B所含官能团的名称为。(2)、写出F的结构简式。(3)、下列说法正确的是___________。A、检验反应是否进行完全,可取样加入溶液碱化后,再加入新制氢氧化铜悬浊液并加热,看是否产生砖红色沉淀 B、用碳酸钠溶液可以鉴别C、D和E C、有机物C、D、F都能与金属钠反应 D、两分子F可发生酯化反应生成环状的酯(4)、G是F的同分异构体,与乙酸、乙醇也均能发生酯化反应。写出G与乙酸发生酯化反应的方程式。 -
14、请回答:(1)、蔗糖的分子式是;的电子式是。(2)、向溶液中滴加溶液,可观察到 , 最终变成红褐色沉淀。(3)、浓硫酸与木炭加热时的化学反应方程式是。
-
15、根据实验操作和现象得出的结论正确的是
选项
实验操作和现象
结论
A
向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体
说明该盐一定是碳酸盐或碳酸氢盐
B
向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含
C
向某溶液中滴加少量NaOH溶液,没有产生能使湿润红色石蕊试纸变蓝的刺激性气体
该溶液中不含
D
向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解
铝有一定的非金属性
A、A B、B C、C D、D -
16、、、三种固体溶于水得溶液M,部分离子的物质的量浓度如图甲所示。取200mL混合溶液加水稀释,测得随溶液体积的变化如图乙所示。下列说法正确的是
 A、Y离子可能是 B、 C、溶液M中物质的量浓度为0.10mol/L D、固体溶解时,与物质的量之比为1:1
A、Y离子可能是 B、 C、溶液M中物质的量浓度为0.10mol/L D、固体溶解时,与物质的量之比为1:1 -
17、溶液可用于脱除烟气中的有害气体 , 其原理如图所示。下列说法不正确的是
 A、“反应Ⅱ”中还原剂为 B、“反应Ⅰ”的离子方程式为: C、反应一段时间后,溶液中不变 D、反应每脱除消耗的体积为5.6L(体积均为标准状况)
A、“反应Ⅱ”中还原剂为 B、“反应Ⅰ”的离子方程式为: C、反应一段时间后,溶液中不变 D、反应每脱除消耗的体积为5.6L(体积均为标准状况) -
18、某小组以石膏()为主要原料制备的流程如下:

下列说法不正确的是
A、气体A是 , 气体B是 B、甲乙的过程中应通入过量气体B C、操作I用的主要玻璃仪器为烧杯、玻璃棒、普通漏斗 D、整个过程的总反应方程式为 -
19、下列说法不正确的是A、工业生产活泼金属可采用电解的方式,如电解氯化镁溶液生产镁单质 B、加工面包和饼干时,可加入一些膨松剂,如碳酸氢钠、碳酸氢铵等 C、化学反应
 的原子利用率为100%
D、包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
的原子利用率为100%
D、包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
-
20、一定温度下,在2 L容积不变的密闭容器中发生反应:。反应过程中的部分数据如下表所示,下列说法不正确的是
物质的量/mol
时间/min
n(CO2)
n(H2)
n(CH3OH)
n(H2O)
0
2
8
0
0
3
1
1
6
0.5
1.5
9
3.5
A、0~3内,H2的平均反应速率为0.5 mol/(L·min) B、保持恒容,若通入He使容器内压强增大,反应速率保持不变 C、6~9 min内, D、若容器内的压强不再发生变化,说明反应已达平衡