相关试卷
-
1、在恒温恒压密闭容器M(如图I)和恒温恒容密闭容器N(如图II)中,两容器中均加入2molA和2molB,起始时两容器体积均为1L,发生如下反应并达到化学平衡状态: , 平衡时M中的物质的量之比为1:3:4,下列判断正确的是
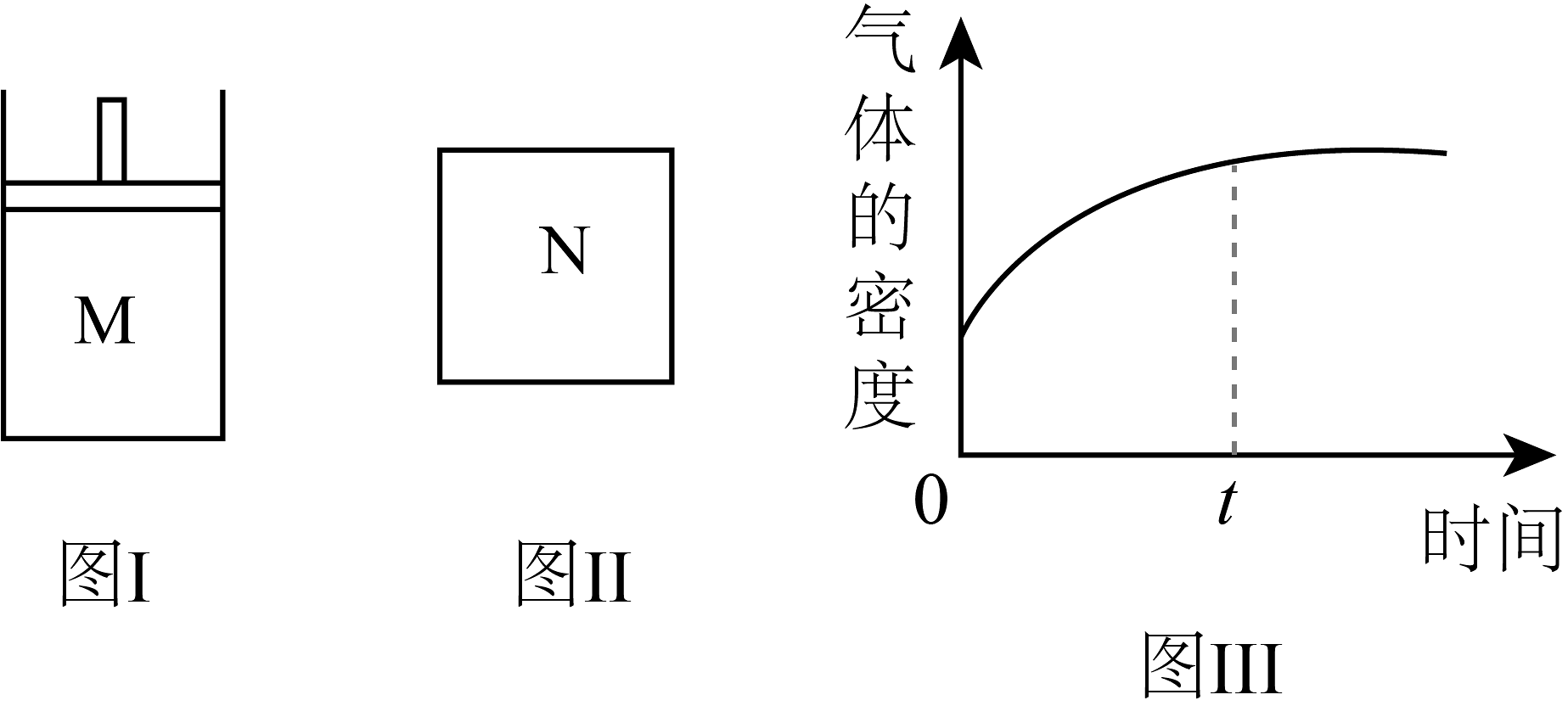 A、 B、若N中气体的密度如图III所示,则只有一种是气态 C、若A为气体,B为非气体,则平衡时M、N中C的物质的量不相等 D、若均为气体,平衡时M中A的转化率小于N中A的转化率
A、 B、若N中气体的密度如图III所示,则只有一种是气态 C、若A为气体,B为非气体,则平衡时M、N中C的物质的量不相等 D、若均为气体,平衡时M中A的转化率小于N中A的转化率 -
2、对于可逆反应 , 下列四个图像及其描述正确的是
 A、图1表示压强对的影响,且a的压强大 B、图2表示温度对该反应速率的影响 C、图3表示压强/温度对的影响,温度高 D、图4表示压强对该反应速率的影响
A、图1表示压强对的影响,且a的压强大 B、图2表示温度对该反应速率的影响 C、图3表示压强/温度对的影响,温度高 D、图4表示压强对该反应速率的影响 -
3、一定量混合气体在密闭容器中发生如下反应: , 平衡时测得A的浓度为 , 保持温度不变,将容器的容积缩小到原来的一半,再次达到平衡时,A的浓度为 , 下列有关判断错误的是A、 B、平衡向正反应方向移动 C、物质A的转化率增大 D、物质C的体积分数增大
-
4、已知的反应机理和反应过程中能量变化图如下,下列说法正确的是

反应I:
反应II:
A、是该反应的催化剂 B、加入更高效的催化剂可使该反应的减小 C、总反应速率由反应决定 D、反应的能量变化取决于与的差 -
5、一定温度下,在2L的恒容密闭容器中发生反应。反应过程中的部分数据如下表所示:
0
2.0
2.0
0
5
0.9
10
1.0
15
1.5
下列说法正确的是
A、用B表示的平均反应速率为 B、该反应在10min恰好达到平衡 C、物质B的平衡转化率为75% D、保持其他条件不变,若反应开始时的浓度分别为 , 则达到平衡状态后,C的浓度大于 -
6、理论研究表明,在101kPa和298K下,异构化反应过程的能量变化如图所示。下列说法正确的是
 A、一分子HCN中的总键能比一分子HNC的总键能小 B、该异构化反应的 C、稳定性: D、催化剂的浓度越大,反应速率越大
A、一分子HCN中的总键能比一分子HNC的总键能小 B、该异构化反应的 C、稳定性: D、催化剂的浓度越大,反应速率越大 -
7、已知:。下列说法错误的是A、0.5molX和0.5molY充分反应生成Z的物质的量一定小于1.5mol B、达到化学平衡状态时,Y、Z的浓度不再发生变化 C、达到化学平衡状态时,反应放出的总热量可达akJ D、增大压强,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
-
8、下列关于化学反应与能量的说法正确的是A、已知正丁烷的燃烧热为 , 则表示正丁烷燃烧热的热化学方程式为 B、室温下不能自发进行,说明该反应的 C、的热值为 , 则氢气燃烧的热化学方程式可表示为 D、已知石墨,s金刚石,s) , 则金刚石比石墨稳定
-
9、下列各实验装置、目的或结论全都正确的是
实验装置




甲
乙
丙
丁
A、甲可验证镁片与稀盐酸反应放热 B、乙可验证FeCl3对的分解反应有催化作用 C、将丙中的铝片更换为等质量的铝粉后释放出的热量变多 D、由丁可推断出:反应为吸热反应 -
10、相同温度和压强下,关于反应的△H,下列判断错误的是
①
②
③
④
⑤
A、 B、 C、 D、 -
11、下列事实可以用勒夏特列原理解释的是A、合成氨工业选择高温 B、反应达到平衡时,加大压强,颜色加深 C、用排饱和食盐水的方法收集氯气 D、用和制备 , 工业选择常压而非高压
-
12、反应经amin后的浓度变化情况如下图所示,在内表示的平均反应速率为 , 则a等于
 A、5 B、2.5 C、0.1 D、10
A、5 B、2.5 C、0.1 D、10 -
13、密闭恒容容器中的反应: , 达到化学平衡状态时,下列描述错误的是A、氮气浓度保持不变 B、 C、容器内压强不再变化 D、断开键,同时断开键
-
14、下列叙述正确的是A、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 B、需要加热才能发生的反应不一定是吸热反应,但吸热反应只有加热才能发生 C、升温时吸热反应速率增大,放热反应速率减少 D、化学平衡常数发生变化,化学平衡一定发生移动
-
15、反应在四种不同情况下的反应速率如下,其中表示反应速率最快的是A、 B、 C、 D、
-
16、下列说法正确的是A、催化剂通过改变反应历程、增大反应活化能,加快反应速率 B、增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数 C、体系压强增大,反应速率不一定增大 D、平衡常数K越大,表示反应进行的越快
-
17、用铝片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是A、用铝粉替换铝片 B、加热 C、用浓硫酸替换稀硫酸 D、滴加少量溶液
-
18、氨的液化过程中,其焓变和熵变正确的是A、 B、 C、 D、
-
19、生活处处都与化学有关,下列属于放热反应的是A、冰融化 B、生石灰溶于水 C、蒸馒头时小苏打受热分解 D、干冰作制冷剂
-
20、炼钢电炉内发生反应: , 实验测得平衡常数K与温度的关系如图所示。某温度下向刚性密闭容器中充入足量铁粉和CO气体,发生上述反应,达到平衡时测得CO压强 , 保持温度不变,再向容器中充入少量CO,达到新平衡时测得。下列叙述正确的是
 A、反应热 B、两个平衡中CO压强: C、Fe质量不变时反应达到平衡 D、平衡时增大质量,平衡一定右移
A、反应热 B、两个平衡中CO压强: C、Fe质量不变时反应达到平衡 D、平衡时增大质量,平衡一定右移