相关试卷
-
1、工业生产需综合考虑反应进行的可能性、原料来源、成本高低和绿色环保等多种因素。工业生产下列物质时,对应的转化过程符合要求的是
选项
物质
转化过程
A
溶液
B
C
Al
铝土矿
D
黄铁矿
A、A B、B C、C D、D -
2、称取四份不同质量的和混合物样品溶于水后分别逐滴加入相同浓度盐酸20.0mL,充分反应后产生的体积如下表:
实验序号
I
II
III
IV
样品质量(g)
2.74
4.11
5.48
6.85
体积(mL)
672
1008
896
784
(表中体积数据均已折算成标准状况下的体积,且不考虑在水中的溶解)
(1)、样品中物质的量之比。(2)、盐酸的物质的量浓度mol/L。 -
3、是重要的化工产品,主要用作水处理剂,还用作媒染剂、催化剂等,某小组设计如图实验装置制备氯化铁并测定其纯度。
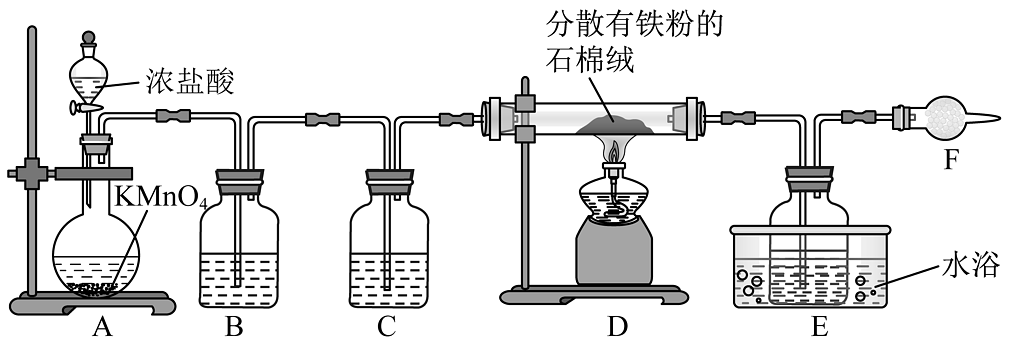
已知:①易升华,遇水蒸气易潮解
②石棉绒是一种耐火材料,不参与反应
(1)、写出装置A中盛装的仪器名称 , 装置B中的试剂为。(2)、写出装置D中发生的化学反应方程式。(3)、装置F中的试剂最恰当的是(填标号),其作用为。A.无水氯化钙 B.浓硫酸 C. D.碱石灰
(4)、纯度的测定:称取装置E中粗产品4.0g配制成100mL溶液。取10.0mL溶液置于锥形瓶中,加入过量的KI溶液,充分反应生成 , 生成的恰好与10.0mL的溶液反应(已知:粗产品中的杂质不参与反应,),则纯度为%。 -
4、如图为某消毒液产品参数的一部分:
主要成分:NaClO
浓度:
注意事项:密封保存,易吸收空气中的而变质
(1)、若此消毒液未变质,则25mL该消毒液中含NaClO的质量为g。(2)、某实验需用100mL上述消毒液,现用NaClO溶液配制,如图所示的仪器中肯定不需要的是(填序号),还需用到的玻璃仪器是(填仪器名称)。 (3)、下列操作会使配制的溶液浓度偏高的是_______。A、溶解后未经冷却就移液 B、转移时没有洗涤烧杯内壁和玻璃棒 C、定容时俯视刻度线 D、定容摇匀后,液面低于刻度线再加入少量蒸馏水
(3)、下列操作会使配制的溶液浓度偏高的是_______。A、溶解后未经冷却就移液 B、转移时没有洗涤烧杯内壁和玻璃棒 C、定容时俯视刻度线 D、定容摇匀后,液面低于刻度线再加入少量蒸馏水 -
5、物质类别和元素价态是研究物质性质的两个重要角度。下图为含铁物质的“价―类”二维图,图中列出了部分常见的含铁物质,其中乙具有磁性,构成丙、丁的阴离子均为。
 (1)、写出乙的化学式。(2)、写出甲与丁溶液反应的离子方程式。(3)、请设计实验方案检验丙溶液的阳离子。(4)、向、和丁组成的混合溶液中加入一定量铁粉,反应结束后有气体生成,溶液中存在的阳离子可能为_______。A、、、 B、、、 C、 D、、
(1)、写出乙的化学式。(2)、写出甲与丁溶液反应的离子方程式。(3)、请设计实验方案检验丙溶液的阳离子。(4)、向、和丁组成的混合溶液中加入一定量铁粉,反应结束后有气体生成,溶液中存在的阳离子可能为_______。A、、、 B、、、 C、 D、、 -
6、按要求完成下列各小题:(1)、纯碱的化学式:。(2)、实验室用软锰矿与浓盐酸反应制的化学方程式:。(3)、在1.9g某二价金属的氯化物中含有0.04mol , 该金属元素的摩尔质量为。(4)、用双线桥法标明电子转移方向及数目:。
-
7、某100mL溶液含有、、、、、、、中的若干种(不考虑水的电离),所含离子的物质的量浓度均相同。为了确定该溶液的组成,分别进行下列实验:
①取溶液先加适量氯水,再加入淀粉溶液,溶液变蓝;
②另取溶液加入足量溶液和盐酸,有白色沉淀生成,经过滤、洗涤、干燥,称重为2.33g;
③再取溶液做焰色试验可看到黄色火焰。
下列选项不正确的是
A、溶液中 B、溶液中一定不存在、 C、通过③实验不能推断溶液一定不含 D、判断是否含:需要取溶液滴加NaOH至过量,若出现白色沉淀,则含 , 反之则无 -
8、下列实验操作或结论有不正确的是
选项
实验操作
实验现象
实验结论
A
用洁净的玻璃棒蘸取新制氯水于干燥的pH试纸上
pH试纸先变红后褪色
新制氯水有酸性和漂白性
B
用磁铁靠近Fe与水蒸气反应后的固体残留物
固体被磁铁吸引
不能证明固体中含有
C
向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液
先变橙色,后变蓝色
氧化性:
D
取少量溶液于试管中,加入溶液,出现白色沉淀,再加入足量盐酸,观察现象
白色沉淀不溶解
该溶液中不一定含有
A、A B、B C、C D、D -
9、测定某铁的氧化物()组成的实验如下:
步骤I:取3.04g该氧化物加足量盐酸溶解得到溶液A
步骤II:向溶液A中通入标准状况下224mL使之恰好完全反应得到溶液B
下列选项不正确的是
A、溶液A中 B、溶液B中溶质的主要成分为 C、该铁的氧化物中氧元素的质量分数约为26.3% D、根据步骤I、II可以判断该氧化物组成为 -
10、“宏观辨识—微观探析—符号表征”是化学学习的重要方法。某化学反应的微观示意图如下,下列分析正确的是
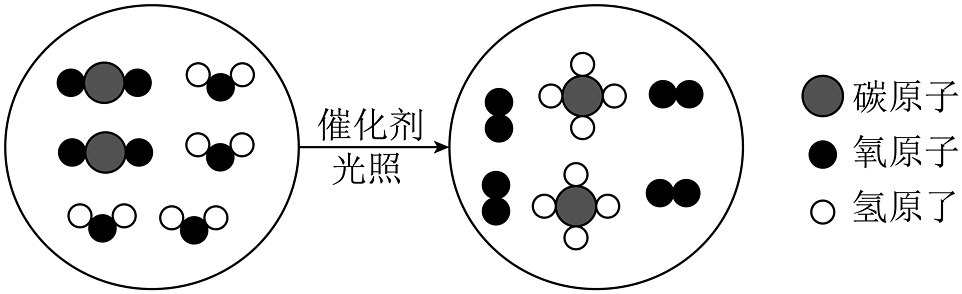 A、分析反应类型:该反应属于置换反应 B、分析物质种类:图中的反应物和生成物均为电解质 C、分析反应价值:该反应有利于改善酸雨现象 D、该反应为
A、分析反应类型:该反应属于置换反应 B、分析物质种类:图中的反应物和生成物均为电解质 C、分析反应价值:该反应有利于改善酸雨现象 D、该反应为 -
11、某小组查阅资料发现与的反应实质分为以下两步:
ⅰ
ⅱ
为验证该结论进行如下实验,下列说法不正确的是
 A、①中可观察到为淡黄色固体 B、用带火星的木条靠近②⑤试管口,均有复燃现象 C、④⑤中的现象可验证存在中间产物 D、反应ⅰ和ⅱ均为氧化还原反应
A、①中可观察到为淡黄色固体 B、用带火星的木条靠近②⑤试管口,均有复燃现象 C、④⑤中的现象可验证存在中间产物 D、反应ⅰ和ⅱ均为氧化还原反应 -
12、NaClO溶液可使含铵废水脱氮,该脱氮反应原理为:。下列说法正确的是A、反应中为还原产物 B、该反应能说明还原性: C、经此法处理过的废水不用再处理就可以直接排放 D、反应中每生成22.4L , 转移6mol电子
-
13、下列物质不能通过化合反应一步实现的是A、 B、 C、 D、
-
14、构建化学基本观念是学好化学的基础。下列对化学基本观念的认识正确的是A、微粒观:NaCl溶液中的水合离子:
 B、分类观:在水溶液中能电离出的一定是酸
C、守恒观:离子反应中,始终保持离子总数守恒
D、转化观:Na在空气中最终转化成
B、分类观:在水溶液中能电离出的一定是酸
C、守恒观:离子反应中,始终保持离子总数守恒
D、转化观:Na在空气中最终转化成
-
15、是阿伏加德罗常数的值。下列说法不正确的是A、常温常压下,48g和的混合气体中含有的原子数为 B、的NaOH溶液中含有的数目为 C、30mL盐酸与足量共热,转移的电子数小于 D、amol Na与足量反应,生成和的混合物,转移的电子数为
-
16、化学是一门具有实用性的学科,下列有关物质用途的说法不正确的是A、是一种新型绿色消毒剂,可用于饮用水处理 B、呈红棕色,可作颜料 C、Na具有还原性,可用于和溶液反应制备Ti D、HClO具有强氧化性,可用作棉、麻等物品的漂白剂
-
17、下列离子方程式或电离方程式正确的是A、钠投入稀硫酸中: B、在水溶液中的电离: C、向NaClO溶液中通入少量: D、溶液中通入过量:
-
18、下列有关、的性质比较中,正确的是A、热稳定性 , 同浓度碱性 B、溶于水时,有吸热现象,有放热现象 C、可用溶液区分固体和固体 D、等物质的量的和与足量稀盐酸反应,放出的多
-
19、下列反应能用表示的是A、硝酸与溶液反应 B、醋酸与溶液反应 C、硫酸与溶液反应 D、盐酸与溶液反应
-
20、某无色透明溶液能使紫色石蕊试液变红,此溶液中可能大量存在的是A、、、、 B、、、、 C、、、、 D、、、、