相关试卷
-
1、 硅是电子工业中应用最为广泛的半导体材料,少量磷的掺入可提高硅的导电性能。Zn高温还原(沸点27.6℃)是生产多晶硅的一种方法。回答下列问题:(1)、基态Zn原子的价电子排布式为 , 晶体的类型为。(2)、化合物的结构如图1所示,中F-P-F键角略大于分子中的F-P-F键角,原因是。
 (3)、Si、P和Zn三种元素组成化合物的晶胞如图2所示(晶胞参数),若将M点Si原子作为晶胞顶点,则N点Si原子在晶胞中的位置为(填“面心”“棱中点”或“体心”)。
(3)、Si、P和Zn三种元素组成化合物的晶胞如图2所示(晶胞参数),若将M点Si原子作为晶胞顶点,则N点Si原子在晶胞中的位置为(填“面心”“棱中点”或“体心”)。 (4)、在Zn还原的过程中会生成副产物 , 抑制生成可以增加Si产量并降低生产能耗。该过程存在如下主要化学反应:
(4)、在Zn还原的过程中会生成副产物 , 抑制生成可以增加Si产量并降低生产能耗。该过程存在如下主要化学反应:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①。
②在总压分别为、和下,反应达平衡时:物质的量与初始物质的量的比值x随温度变化如图3所示。图中压强由大到小顺序为 , 判断的依据是。在一定温度、180kPa条件下,体系中初始:和分别为1mol和4mol,假设此条件下生成的忽略不计,恒压反应4min时,分压变为20kPa,0~4min内用分压表示的平均反应速率为 , 此时可生成硅g。

-
2、 某实验小组利用EDTA标准溶液滴定 , 从而间接测定混合溶液中和的总浓度。已知EDTA与按物质的量之比反应。
主要实验步骤如下:
Ⅰ.如下图所示,取混合溶液于①中,在搅拌下滴加NaOH溶液,调pH至11,然后准确加入溶液(过量),搅拌下水浴加热至60℃并保持5min,冷却至室温。过滤、洗涤,合并滤液和洗涤液,在250mL容量瓶中定容。

Ⅱ.取25.00mL步骤Ⅰ配制的溶液于锥形瓶中,加入一定量蒸馏水,用NaOH溶液调pH在12~13之间,再滴加4~5滴钙指示剂。用标准溶液滴定至终点,平行测定三次。消耗EDTA溶液平均体积为。
回答下列问题:
(1)、仪器①的名称是;②的名称是。(2)、步骤Ⅰ中,若不慎将NaOH溶液沾到皮肤上,应对措施是。(3)、步骤Ⅰ中,调pH至11的目的是;加入的溶液需过量的原因是。(4)、步骤Ⅰ中,采用水浴加热方式的优点是。(5)、步骤Ⅱ滴定接近终点时,使滴定管尖嘴处悬垂的半滴标准溶液加入到锥形瓶中的操作是。(6)、混合溶液中,和的总浓度(写出计算式)。 -
3、 一种利用钛白粉副产品[主要成分为 , 含有少量等]和农药盐渣(主要成分为等)制备电池级磷酸铁的工艺流程如下。
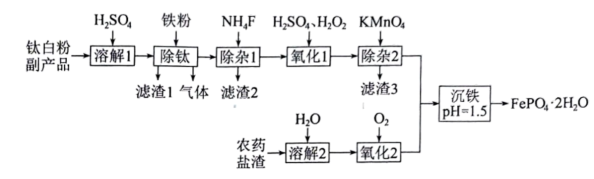
一定条件下,一些金属氟化物的如下表。
氟化物
回答下列问题:
(1)、“除钛”中产生的少量气体是(填化学式);铁粉的作用之一是提高体系的pH,使得水解以沉淀形式除去,其另一个作用是。(2)、“除杂1”中除去的离子是(填化学式)。(3)、“氧化1”中若加入速度过快,会导致用量增大,原因是。本步骤不能使用稀盐酸代替溶液,原因是。(4)、滤渣3的主要成分是 , 生成该物质的离子方程式为。(5)、“氧化2”的目的是减少气体的排放(填化学式)。(6)、“沉铁”中如果体系酸性过强,会导致产量降低,原因 。
。 -
4、 向饱和溶液(有足量固体)中通入HCl气体,调节体系pH促进溶解,总反应为。平衡时 , 分布系数与pH的变化关系如图所示(其中M代表或)。比如 , 。已知。

下列说法正确的是( )
A、曲线Ⅰ表示的变化关系 B、时,溶液中 C、总反应的平衡常数 D、时,和的分布系数关系为 -
5、 庚醛(N)与亚硫酸氢钠(P)可发生加成反应生成羟基磺酸钠(Q),正、逆反应速率可以表示为和和分别为正,逆反应的速率常数,和分别为正,逆反应的活化能。与关系如图所示。下列说法正确的是( )
 A、 B、升高温度,平衡逆向移动 C、达到平衡时 D、加入催化剂可以提高N的平衡转化率
A、 B、升高温度,平衡逆向移动 C、达到平衡时 D、加入催化剂可以提高N的平衡转化率 -
6、 的资源化利用有利于实现“碳中和”。一种功能性聚碳酸酯高分子材料G可由如下反应制备。

下列说法错误的是( )
A、 B、反应的原子利用率为100% C、G在酸性或碱性条件下均能降解 D、E与F均能使溴的四氯化碳溶液褪色 -
7、 环己酮可以在Zr基催化剂作用下转化为环己醇,其可能的反应机理如图所示。

下列说法错误的是( )
A、该反应的还原剂是 B、反应过程中涉及O-H键的断裂和形成
C、用同位素标记的
B、反应过程中涉及O-H键的断裂和形成
C、用同位素标记的 代替
代替 可得到
可得到 D、环己酮转化为环己醇的反应为
D、环己酮转化为环己醇的反应为
-
8、 由下列实验操作及现象能得到相应结论的是( )
选项
实验操作及现象
结论
A
以甲烷球棍模型为基础,用两个代表氯原子的小球替换代表氢原子的小球,只能得到一种结构模型
无同分异构体
B
将通入滴有酚酞的氨水,溶液由红色变为无色
具有漂白性
C
将洁净的铂丝在酒精灯外焰灼烧至与原来火焰颜色相同,再蘸取某溶液在外焰上灼烧,火焰呈黄色
该溶液的溶质为钠盐
D
常温下,溶液与KOH溶液等体积混合,测得混合溶液
为弱酸
A、A B、B C、C D、D -
9、 我国科学家设计了一种水系可充电电池,其工作原理如图所示。

下列说法正确的是( )
A、充电时,电极b为阳极 B、充电时,阳极附近溶液的pH增大 C、放电时,负极的电极反应: D、放电时,溶液中向电极b方向迁移 -
10、 配合物间的结构转变是一种有趣的现象。配合物1经过加热可转变为配合物2,如图所示。

下列说法错误的是( )
A、配合物1中含有2种配体 B、配合物2中N原子采取杂化 C、转变过程中涉及配位键的断裂和形成 D、转变前后,Co的化合价由价变为0价 -
11、 对于下列过程中发生的化学反应,相应离子方程式正确的是( )A、向浓硝酸中加入少量氧化亚铜: B、以热氢氧化钠溶液洗涤附着在试管内壁的少量硫: C、醋酸铵的水解: D、向碘酸钾溶液中滴加双氧水:
-
12、 某化合物分子式为 , W、X、Y、Z是原子序数依次增大的短周期元素,X与Z同主族,W与X质子数之和等于Z的质子数,Y最外层电子数是其内层电子总数的一半。下列说法正确的是( )A、电负性: B、的空间结构为直线形 C、最简单氢化物的沸点: D、Y的第一电离能高于同周期相邻元素
-
13、 化合物L是从我国传统中药华中五味子中提取得到的一种天然产物,其结构如图所示。下列有关该化合物的说法错误的是( )
 A、能使酸性溶液褪色 B、分子中含有2个手性碳原子 C、能与溶液反应放出气体 D、既能发生加成反应,又能发生取代反应
A、能使酸性溶液褪色 B、分子中含有2个手性碳原子 C、能与溶液反应放出气体 D、既能发生加成反应,又能发生取代反应 -
14、 下列图示中,操作规范的是( )


A.配制溶液
B.洗涤盛有废液的试管


C.蒸发浓缩NaCl溶液
D.长期存放标准溶液
A、A B、B C、C D、D -
15、 W是一种短周期金属元素的单质,V是无色气体。它们之间的转化关系如图所示(略去部分生成物和反应条件)。下列说法错误的是( )
 A、气体V可通过排水法收集 B、X与水反应能生成气体V C、Y易溶于水,溶液显碱性 D、电解Z的水溶液可得到W
A、气体V可通过排水法收集 B、X与水反应能生成气体V C、Y易溶于水,溶液显碱性 D、电解Z的水溶液可得到W -
16、 下列化学用语或图示正确的是( )A、CaO的电子式:
 B、的结构示意图:
B、的结构示意图: C、中子数为38的镓原子:
D、
C、中子数为38的镓原子:
D、 的化学名称:乙基戊烷
的化学名称:乙基戊烷
-
17、 我国传统手工艺品是劳动人民的智慧结晶,并随着时代发展不断创新。下列手工艺品中主要成分为无机物的是( )


A.云锦
B.牡丹瓷


C.麦秆画
D.油纸伞
A、A B、B C、C D、D -
18、探究电解质在水溶液中的平衡能了解它的存在形式,有重要的实际意义。回答下列相关问题:(1)、常温下,向溶液中逐滴加入溶液,所得溶液的随溶液的体积变化如图所示(溶液体积变化忽略不计)。

①由图中信息可知为(填“弱”或“强”)酸。
②点时,溶液中、、由大到小的顺序是。
③点时,溶液中。
(2)、氰化物有剧毒,若废水中含量超标,可用将其氧化。测定处理后(含少量)的废水(废水中不含干扰测定的物质)中的含量的操作如下:取处理后的废水于锥形瓶中,滴加几滴溶液作指示剂,再用的溶液滴定,消耗溶液的体积为。已知: , , 优先于与反应。
①溶液应装在(填“酸式”或“碱式”)滴定管中,且最好是棕色的,目的是。
②滴定终点时的现象是。经处理后的废水中的含量为。
③下列操作使得测定结果偏高的是(填标号)。
a.滴定终点时未等半分钟就读数
b.振荡锥形瓶时,有液滴溅出
c.滴定前俯视读数,滴定后仰视读数
(3)、的电化学合成。阳离子交换膜和阴离子交换膜将装置分成三室,两电极反应产生的离子在多孔介质中生成的原理如图所示,正极的电极反应式为。用代替进行实验,酸性多孔介质中的参与反应的证据是生成的过氧化氢中有(填分子式)。
-
19、钴是生产电池材料、耐高温合金、防腐合金、磁性材料及催化剂的重要原料。一种以湿法炼锌的净化渣(含有、、、等金属的单质及其氧化物)为原料提取钴的工艺流程如图所示:

已知:
①常温下, , , 。
②相关金属离子形成氢氧化物沉淀的范围如下表:
金属离子
开始沉淀时()的
沉淀完全时()的
回答下列问题:
(1)、“浸出渣”的主要成分为(填化学式)。(2)、常用作沉淀剂,在“铜渣”中检测不到 , “除铜液”中浓度为 , 则此时溶液的[已知常温下,饱和水溶液中存在关系式:。(3)、过硫酸钠()能将和氧化,和反应的离子方程式为。(4)、氧化后,溶液中浓度为 , 利用碳酸钠溶液调节溶液。“沉铁”时,调节溶液的范围是 , “沉铁”后,调节溶液的目的是。(5)、“沉钴”过程中反应的离子方程式为。“钴回收后废液”中含有的金属离子主要有。 -
20、甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。(1)、利用光能和催化剂,和可转化为: , 图1为在恒温、紫外光照射、不同催化剂(Ⅰ、Ⅱ)作用下,在体积为的密闭容器中,的量随光照时间(单位:)的变化。

①反应开始后的16小时内,在第种催化剂作用下,收集的较多。
②内,在第Ⅰ种催化剂作用下,的平均生成速率。实验测得当温度高于时,的平均生成速率明显下降,原因可能是。
(2)、工业上常用和水蒸气在一定条件下的恒温恒容密闭容器中制取:已知:a.
b.
c.
①反应的。
②下列说法中,无法说明该反应达到平衡状态的是(填标号)。
a.体积分数不再变化
b.气体的压强不再变化
c.体系的密度保持不变
d.消耗同时消耗
③一定温度时,在体积为的恒容密闭容器中,充入和水蒸气发生以上反应。测得平衡时的转化率与温度、压强的关系如图2所示,则(填“>”“<”或“=”);温度为时,点的浓度平衡常数。
