相关试卷
-
1、一定温度下,在的密闭容器中充入和发生反应: , 后达到平衡,的转化率为20%,下列说法正确的是A、时的反应速率是 B、平衡后再充入和 , 的转化率不变 C、该反应的平衡常数为4 D、加入催化剂,平衡不移动,反应速率不变
-
2、室温下,将0.10mol/LHClO溶液和0.10mol/LNaOH溶液等体积混合(忽略混合后体积变化)。下列关系不正确的是A、 B、 C、 D、
-
3、下列说法正确的是A、在①Mg、Ca、Ba和②Mg、Si、Cl中,元素的电负性随原子序数增大而递增的是② B、在元素周期表中,s区、d区和ds区的元素都是金属元素 C、N、O、F的最高正化合价依次升高 D、基态的简化电子排布式:
-
4、在25℃和下,下列热化学方程式书写正确的是A、燃烧生成液态水,放出热量: B、硫粉在中完全燃烧生成 , 放出热量: C、乙炔的燃烧热是: D、中和热为 , 氢氧化钡稀溶液与稀硫酸反应:
-
5、可逆反应 , 其它条件不变时,反应过程中某些物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,下列判断正确的是
 A、 , B、 , C、 , D、 ,
A、 , B、 , C、 , D、 , -
6、在恒温恒压下,某一容积可变的密闭容器中发生反应:。下列叙述中,能说明反应达到化学平衡状态的是A、平衡常数不再变化 B、混合气体的密度不再变化 C、单位时间内消耗 , 同时生成 D、
-
7、下列说法正确的是A、镁原子最外层电子的电子云轮廓图:
 B、第二周期元素中,第一电离能介于B、N之间的元素只有1种
C、第四周期的金属元素,从左到右元素的金属性依次减弱
D、激光、焰火都与核外电子跃迁释放能量有关
B、第二周期元素中,第一电离能介于B、N之间的元素只有1种
C、第四周期的金属元素,从左到右元素的金属性依次减弱
D、激光、焰火都与核外电子跃迁释放能量有关
-
8、与纯水的电离相似,液氨中也存在着微弱的电离:。一定温度下,液氨的电离达到平衡时,下列有关说法不正确的是A、是常数 B、存在 C、加入氯化铵固体,液氨的电离平衡逆向移动 D、和液氨在一定条件下能发生反应:
-
9、城镇地面下常埋有纵横交错的金属管道,如钢铁输水管等。当金属管道在潮湿土壤中形成电流回路时,就会引起这些金属制品的腐蚀。为了防止这类腐蚀的发生,某同学设计如图所示的装置。下列有关说法中正确的是
 A、金属M比铁活泼,防护过程中电子流入金属M B、钢铁输水管表面发生还原反应 C、铜的电导率高,金属M可选用铜提高防护效果 D、若外加直流电源,钢铁输水管应连接电源的正极
A、金属M比铁活泼,防护过程中电子流入金属M B、钢铁输水管表面发生还原反应 C、铜的电导率高,金属M可选用铜提高防护效果 D、若外加直流电源,钢铁输水管应连接电源的正极 -
10、下列说法不正确的是A、放热反应的发生都不需要加热 B、放热反应的逆反应一定是吸热反应 C、升高温度,反应物分子中活化分子百分数增大 D、对有气体参加的化学反应,增大压强使容器容积减小,单位体积内活化分子数增多
-
11、某化学兴趣小组为探究酸性高锰酸钾与铜的反应,设计实验如下,在培养皿中加入足量的酸性高锰酸钾溶液,放入铜珠,实验结果如下:
实验
现象

一段时间后,培养皿中由铜珠向外侧依次呈现:
Ⅰ区澄清且紫色褪色明显
Ⅱ区底部覆盖棕黑色固体
Ⅲ区澄清且紫色变浅
已知:在酸性溶液中不能稳定存在: , 下列说法正确的是
A、Ⅰ区铜反应后的主要产物,可能是、也可能是 B、Ⅱ区棕黑色固体是 , 由铜和酸性高锰酸钾反应产生 C、Ⅲ区紫色变浅说明在Ⅲ区也发生了氧化还原反应 D、如果酸性高锰酸钾大大过量,所有反应完全后,产物中可能没有 -
12、近日,由蒋华良院士和饶子和院士领衔的联合课题组,综合利用虚拟筛选和酶学测试相结合的策略进行药物筛选,发现I(肉桂硫胺)是抗击新型冠状病毒的潜在用药,其合成路线如图:
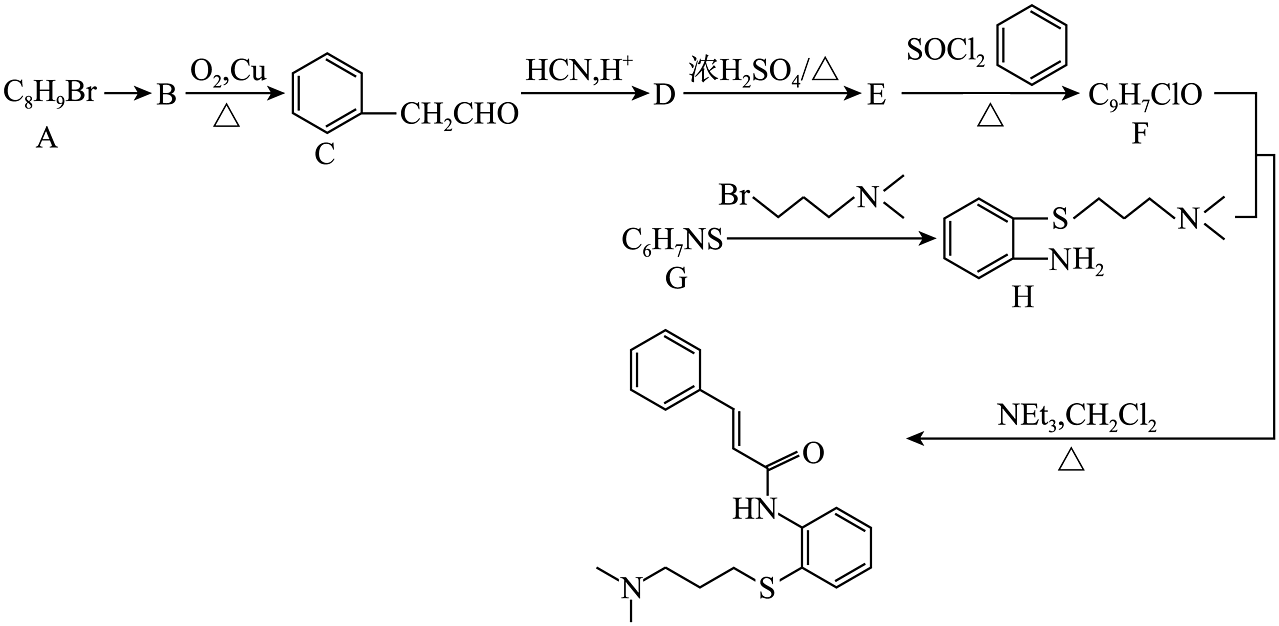
已知
 (1)、A中官能团的名称为。(2)、C分子中碳原子的杂化方式为杂化,E的结构简式为。(3)、B反应生成C的化学方程式是。该反应的反应类型为。(4)、K是D的同分异构体,请写出符合下列条件的K的所有结构简式。
(1)、A中官能团的名称为。(2)、C分子中碳原子的杂化方式为杂化,E的结构简式为。(3)、B反应生成C的化学方程式是。该反应的反应类型为。(4)、K是D的同分异构体,请写出符合下列条件的K的所有结构简式。①与NaOH溶液反应时,1molK最多可消耗3molNaOH
②能水解,且能发生银镜反应
③核磁共振氢谱显示有四种不同化学环境的氢,且峰面积之比为6:2:1:1
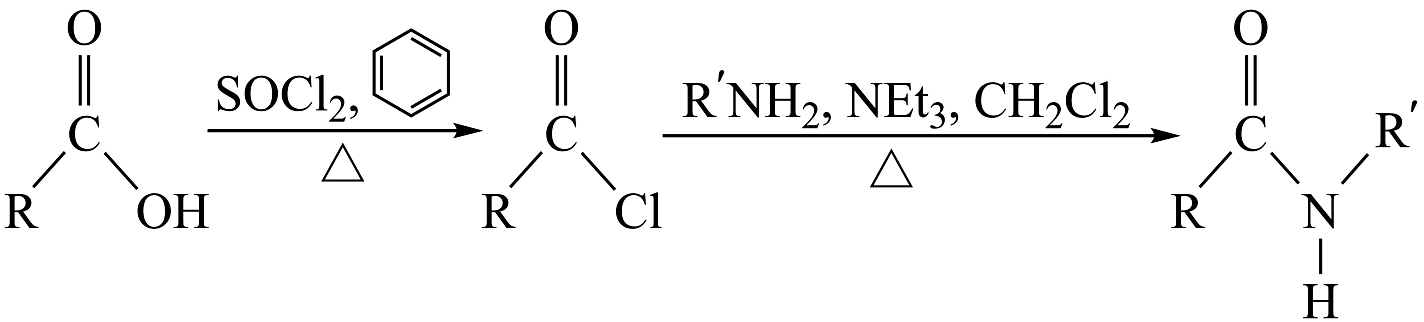
(5)、已知:
 , 参照上述流程中的合成路线,写出以苯和乙酸为原料制备乙酰苯胺(
, 参照上述流程中的合成路线,写出以苯和乙酸为原料制备乙酰苯胺(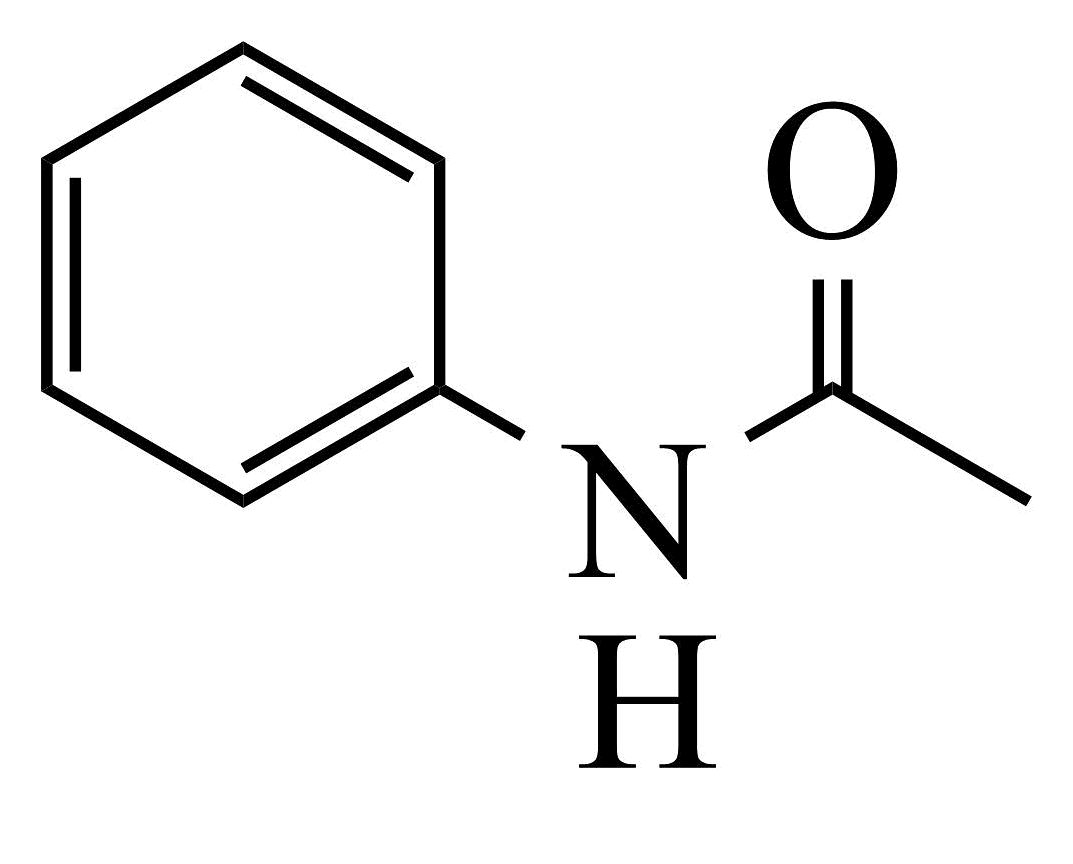 )的合成路线(无机试剂和有机溶剂任选)。
)的合成路线(无机试剂和有机溶剂任选)。 -
13、邻苯二甲酰亚胺(PIMD)是一种重要的亚胺,是Gabriel合成法制备胺的原料。某实验室模拟氨水法以邻苯二甲酸酐为原料制备PIMD。
反应原理:
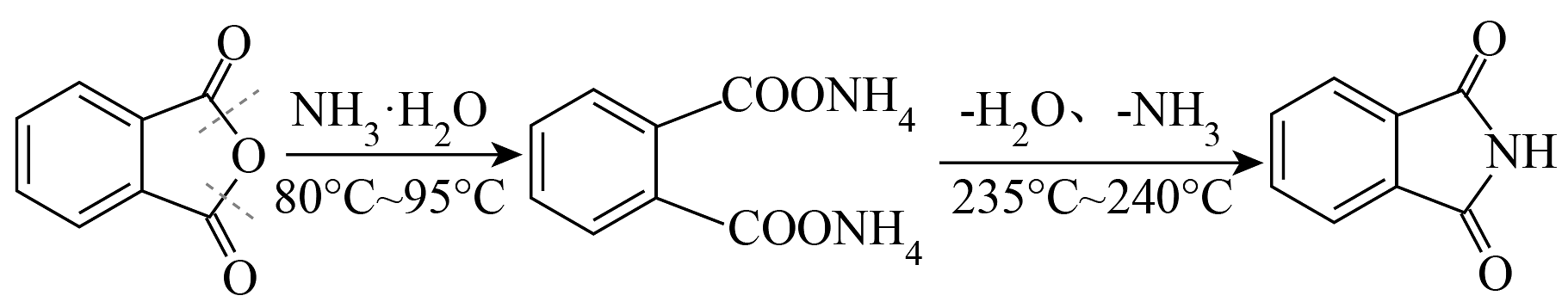
实验装置如图:
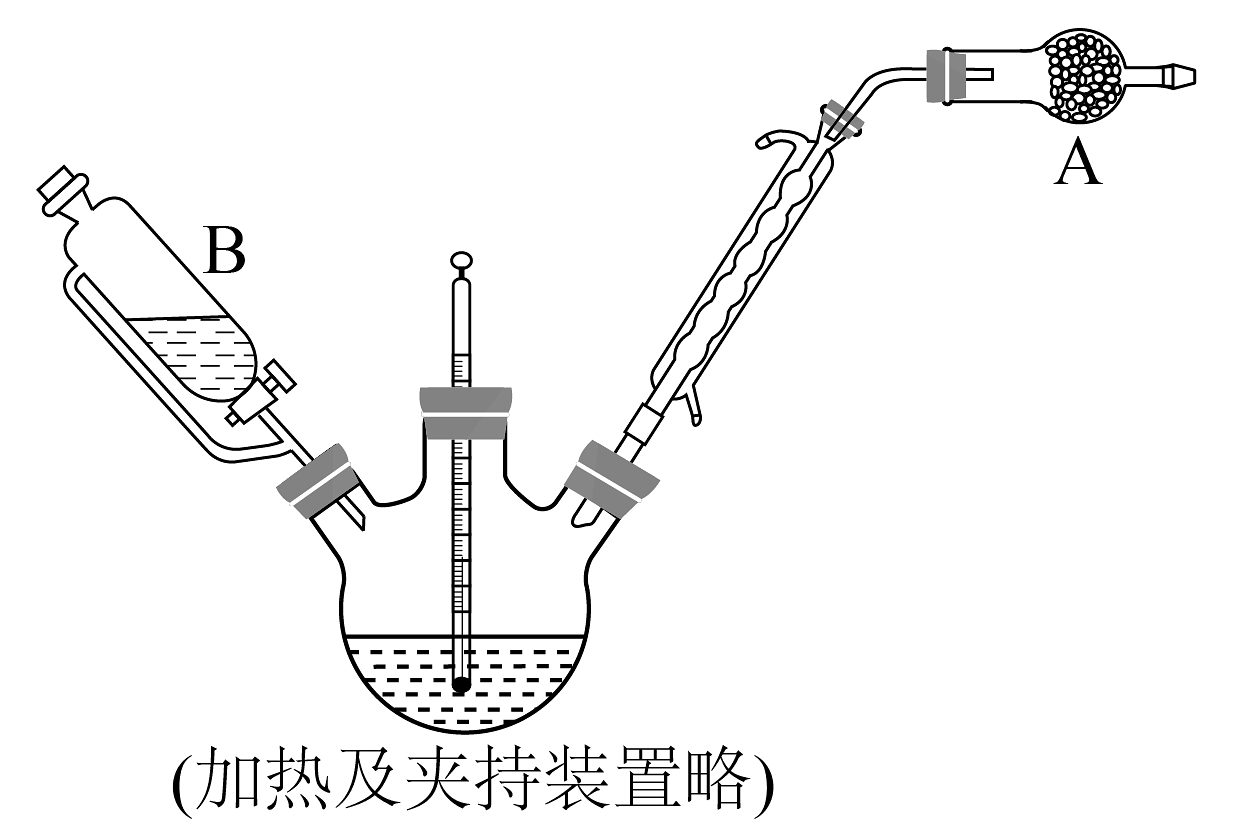
相关物质的物理性质如表:
物质
相对分子质量
熔点/℃
沸点/℃
溶解性
邻苯二甲酸酐
148
131~134
284
不溶于冷水,微溶于热水,稍溶于乙醇
邻苯二甲酰亚胺
147
232~235
366
微溶于热水,易溶于乙醇,易溶于碱溶液
实验步骤:
I.向250mL三颈烧瓶中加入74.0g邻苯二甲酸酐,边搅拌边滴入50.0mL浓氨水(稍过量),加热至80℃-95℃,待固体完全溶解后停止加热。将三颈烧瓶右端口所连装置取下改为蒸馏装置,继续加热,将溶液中的水及过量的氨蒸馏回收,此时烧瓶中有白色固体析出。
Ⅱ.继续升温至235℃-240℃,固体熔化,反应60分钟后,停止加热。冷却至室温,热水洗涤固体、抽滤、烘干,得到粗品白色粉末72.2g。
Ⅲ.向白色粉末中加入适量乙醇,加热回流使固体恰好溶解, , 将滤液降温冷却,有白色晶体析出,抽滤、洗涤、烘干后得白色晶体59.2g。
请回答下列问题:
(1)、仪器A的名称为 , 仪器A中盛装的试剂是。(填标号)a.碱石灰 b.五氧化二磷 c.浓硫酸
(2)、步骤Ⅱ所得粗品中的杂质主要为。(3)、邻苯二甲酸酐的熔沸点远低于邻苯二甲酰亚胺,原因可能是。(4)、步骤Ⅲ的目的是利用重结晶进一步提纯邻苯二甲酰亚胺,该步骤中划线部分应补全的操作是。选择乙醇作为提纯溶剂的主要原因是。(5)、本实验中邻苯二甲酰亚胺的产率最接近于。(填标号)a.85% b.80% c.75% d.70%
(6)、邻苯二甲酰亚胺还可以用由邻二甲苯与氨气、氧气在加热条件下催化反应一步制得,写出该反应的化学方程式:。 -
14、2023年6月27日,我国工业与信息化部办公下达了2023年度国家工业节能监察任务的通知,其监察的重点为企业节能减排的落实情况。(1)、利用反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H,可减少CO2排放,并介成清洁能源。该反应一般认为可通过以下两步来实现:
①CO2(g)+H2(g)H2O(g)+CO(g) △H1=+41kJ•mol-1
②CO2(g)+2H2(g)CH3OH(g) △H2=-90kJ•mol-1
则合成反应的△H=kJ•mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是(填标号)。
A.
 B.
B.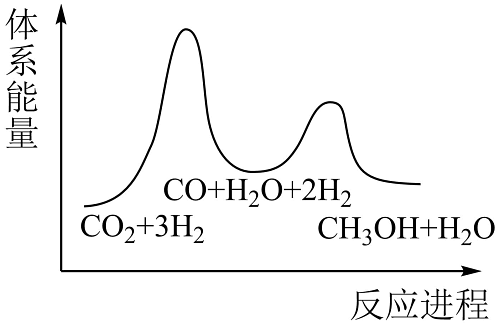
C.
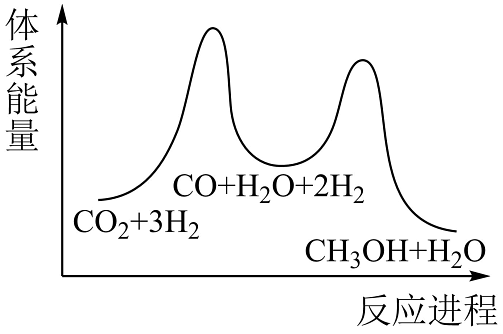 D.
D.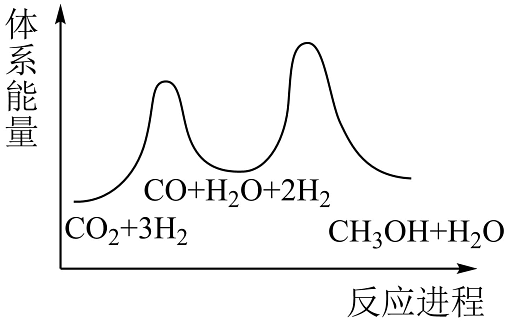 (2)、500℃时,在2L的密闭容器中充入3molCO2和8molH2 , 发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是。
(2)、500℃时,在2L的密闭容器中充入3molCO2和8molH2 , 发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)。下列现象可以说明反应达到平衡的是。A.3正(H2)=逆(H2O) B.气体平均相对分子质量不再改变
C.气体密度不再改变 D.CO2与H2的物质的量之比不再改变
测得t=5min时,反应达到平衡,此时c(CO2)=0.5mol/L,则从反应开始到平衡,CO2的平均反应速率(CO2)=。
(3)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。已知ZrO2的熔点高达2700℃,四方ZrO2的晶胞如图所示: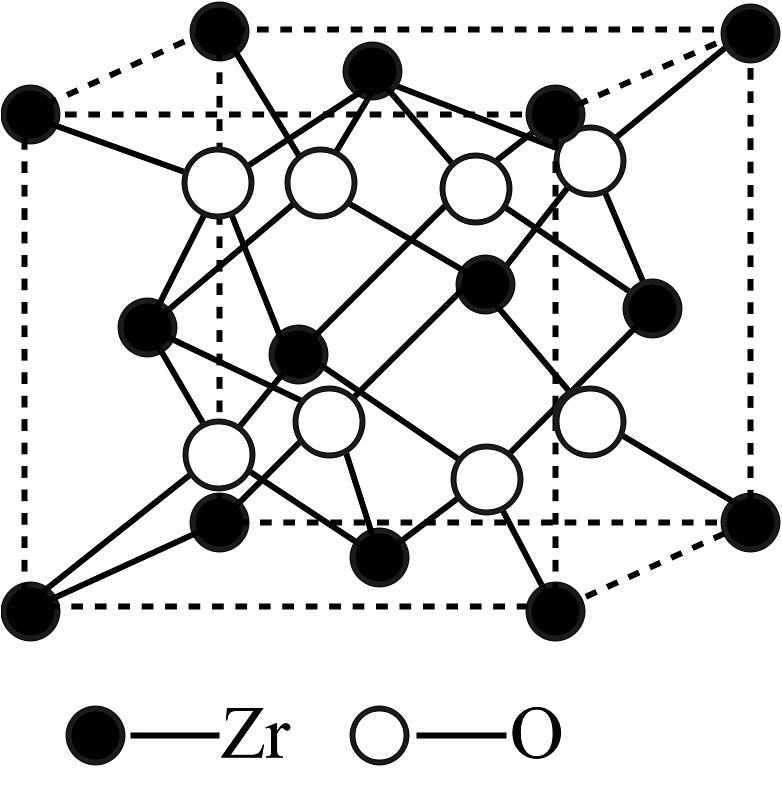
ZrO2属于晶体(选填“分子”或“离子”),若四方ZrO2的晶胞参数为apm,该晶体的密度为g•cm-3(写表达式,用NA表示阿伏加德罗常数)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy , 则y=(用含x的代数式表示)。
-
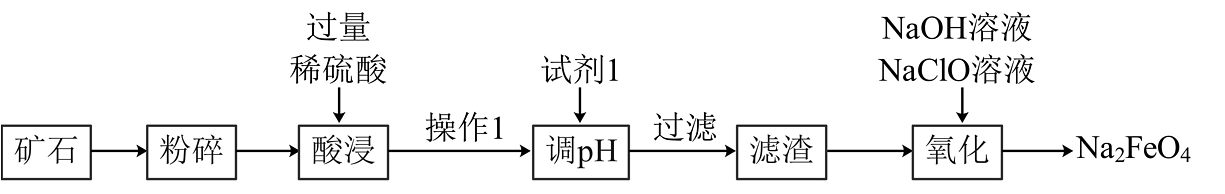
15、巫山桃花铁矿是重庆迄今发现的最大铁矿,储量上亿吨,按市场估值在400亿以上。其所含化学成分有Fe2O3、MgO、SiO2和不溶物(不溶物不参与反应)。现模拟用该铁矿来制备高铁酸钠[Na2FeO4],其流程设计如图:
已知:常温下,几种难溶氢氧化物的Ksp
难溶物
Fe(OH)2
Fe(OH)3
Mg(OH)2
Ksp
8×10-16
4×10-38
2×10-11
请回答下列问题:
(1)、请写出基态Fe原子的价电子排布式。(2)、将矿石粉碎的目的。(3)、操作1的名称是 , 调pH后过滤所得滤渣的主要成分是。(4)、常温下,若测得操作1后所得滤液中c(Mg2+)=0.2mol/L,则调pH时的最佳取值范围为。(已知lg2=0.3,当某离子浓度≤10-5mol/L时可认为其完全沉淀,计算结果保留1位小数)。(5)、氧化时可向滤液中先加入稍过量NaOH溶液,然后再加入NaClO溶液,请写出该反应的离子方程式。NaClO为常见漂白剂,其水溶液因水解而呈碱性,则NaClO溶液中各离子浓度由大到小的关系为。 -
16、某离子晶体的晶胞是由M、N两种离子组成的正方体结构,晶胞参数为apm。该晶胞沿x轴在yz平面的投影如图2所示,沿体对角线方向的投影如图3所示(注:M离子用
 表示,N离子用
表示,N离子用 表示,两种离子投影重合时用
表示,两种离子投影重合时用 表示)。下列说法错误的是
表示)。下列说法错误的是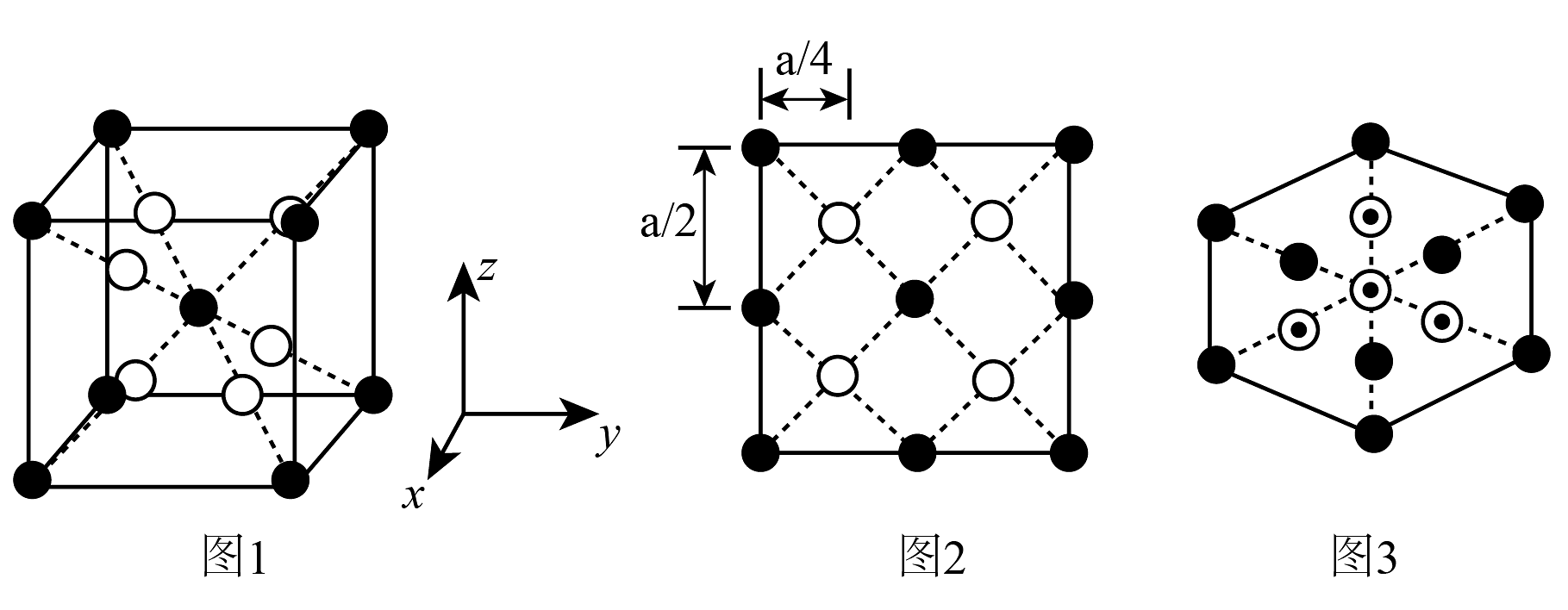 A、该晶体的化学式可表示为MN B、与N离子距离最近的N离子有8个 C、M离子与N离子之间的最近距离为apm D、晶胞中其中一个N离子的分数坐标可能为( , , )
A、该晶体的化学式可表示为MN B、与N离子距离最近的N离子有8个 C、M离子与N离子之间的最近距离为apm D、晶胞中其中一个N离子的分数坐标可能为( , , ) -
17、MnO2催化降解甲醛的机理如图所示,其中MnO2起着吸附活化的作用。下列说法错误的是
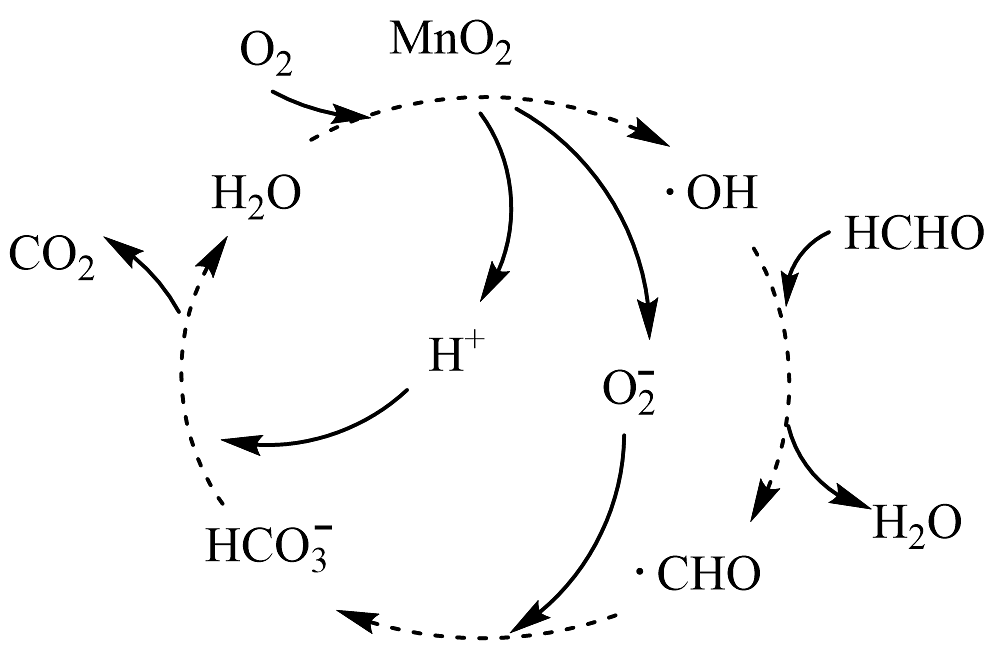 A、基态Mn原子的未成对电子数为5个 B、•CHO中碳原子采取sp2杂化 C、CO2的空间结构为V形 D、HCHO在降解过程中碳氧双键未发生断裂
A、基态Mn原子的未成对电子数为5个 B、•CHO中碳原子采取sp2杂化 C、CO2的空间结构为V形 D、HCHO在降解过程中碳氧双键未发生断裂 -
18、下列离子方程式正确的是A、向CuSO4溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH B、甲醛发生银镜反应:HCHO+4[Ag(NH3)2]OH2NH+CO+4Ag↓+6NH3+2H2O C、向草酸溶液中加入少量酸性高锰酸钾溶液:5H2C2O4+6H++2MnO=10CO2↑+2Mn2++8H2O D、向NaHCO3溶液中加入少量Ba(OH)2溶液:HCO+Ba2++OH-=BaCO3↓+H2O
-
19、下列有关化合物结构和性质的论述正确的是A、无机苯(
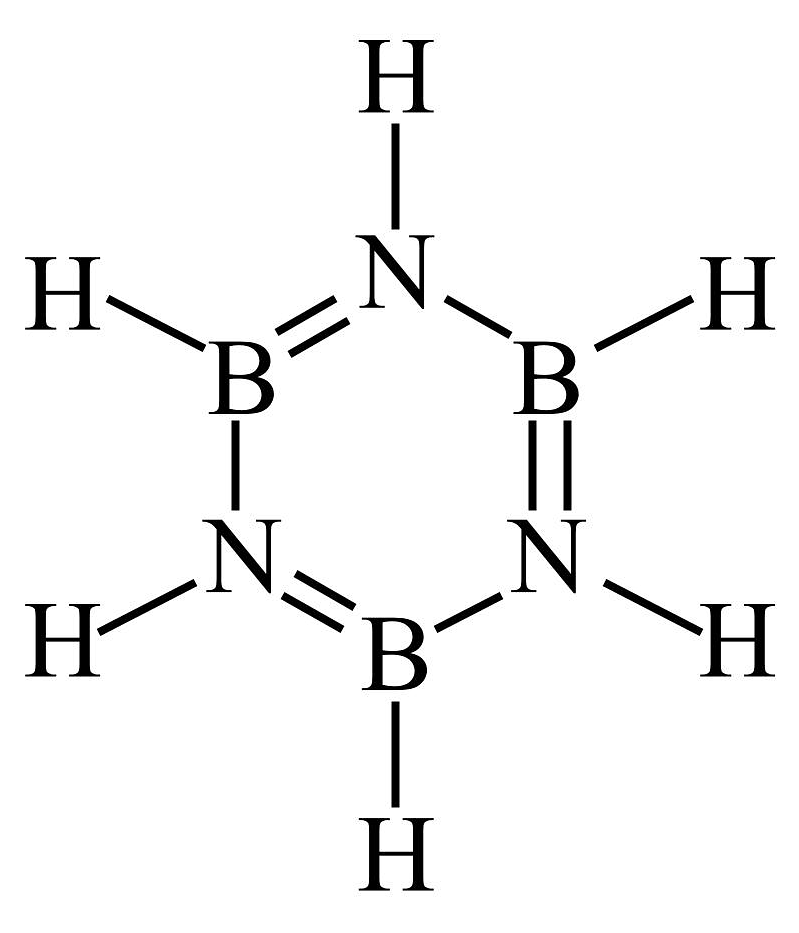 )的结构与苯相似,其中形成大π键的电子全部由N提供
B、根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定
C、NH3的成键电子对间排斥力比PH3小,所以NH3的键角比PH3小
D、O3是弱极性分子,其在水中的溶解度大于在四氯化碳中的溶解度
)的结构与苯相似,其中形成大π键的电子全部由N提供
B、根据原子半径推知,F-F键的键能大于Cl-Cl键,F2化学性质更稳定
C、NH3的成键电子对间排斥力比PH3小,所以NH3的键角比PH3小
D、O3是弱极性分子,其在水中的溶解度大于在四氯化碳中的溶解度
-
20、下列有关说法正确的是A、合成氨为放热反应,所以在实际生产过程中温度越低越好 B、在恒温恒容条件下,发生2SO2(g)+O2(g)2SO3(g)。当反应达到平衡后,若再充入少量O2 , 再次达到平衡后,SO3的浓度降低 C、在恒温恒压条件下,发生2NO2(g)N2O4(g)。当反应达到平衡后,若再充入少量N2O4 , 再次达到平衡后,体系颜色不变 D、CaCO3(s)+2NH(aq)Ca2+(aq)+2NH3(aq)+CO2(g)+H2O(l) H=+68.9kJ•mol-1、S=+37.3J/(mol•K)该反应可在沸水中自发进行