相关试卷
-
1、从科技前沿到人类的日常生活,化学无处不在。下列说法不正确的是A、海水原位电解制氢技术的关键材料是多孔聚四氟乙烯,其单体属于卤代烃 B、食品外包装材料使用的聚乳酸可在自然界自然降解 C、“天问一号”使用的SiC-Al (新型铝基碳化硅)属于复合材料 D、我国华为公司自主研发的5G芯片巴龙5000与光导纤维是同种材料
-
2、“羲和”探日、“嫦娥”探月、空间站巡天,中国航天技术在人类探索浩渺宇宙的前沿不断创新、突破。下列说法不正确的是A、空间站中用将转化为 , 中含离子键和非极性键 B、运载火箭的燃料偏二甲肼()燃烧过程中将化学能转化为热能 C、月壤中富集了大量的 , 其与互为同素异形体 D、太空陨石中存在氖气,的中子数为10
-
3、文物是承载中华文化的血脉。下列文物的材质属于天然有机高分子的是


A.绢画“女史箴图”
B.莲花形玻璃托盏


C.乐器陶埙
D.青铜礼器四羊方尊
A、A B、B C、C D、D -
4、AgCN与可发生取代反应,反应过程中的C原子和N原子均可进攻 , 分别生成腈和异腈两种产物。通过量子化学计算得到的反应历程及能量变化如图(TS为过渡态,Ⅰ、Ⅱ为后续物)。

由图示信息,下列说法错误的是
A、从生成和的反应都是放热反应 B、过渡态TS1是由的C原子进攻的而形成的 C、Ⅰ中“”之间的作用力比Ⅱ中“”之间的作用力弱 D、生成放热更多,低温时是主要产物 -
5、啤酒常用焦亚硫酸钠(Na2S2O5)作抗氧化剂。某工厂按如图工艺生产焦亚硫酸钠,兴趣小组在啤酒厂水质检验员指导下,测定啤酒中抗氧化剂的含量。

已知:①亚硫酸氢钠达到过饱和溶液,能析出Na2S2O5晶体,2NaHSO3Na2S2O5+H2O;
②测定抗氧化剂的残留量是以游离的SO2含量计算的。
回答下列问题:
(1)、燃烧炉中主要反应的化学方程式为。(2)、在纯碱溶液中通入SO2调至pH为4.1时,产物中含NaHSO3 , 反应液温度升高,其化学方程式为;在NaHSO3溶液中加入纯碱溶液调至pH为7~8时,NaHSO3转化为Na2SO3悬浮液,Na2SO3悬浮液中继续通入SO2调至pH为4.1时,生成亚硫酸氢钠过饱和溶液,写出该反应的化学方程式:。(3)、下列说法不正确的是________。A、I、II、III设备分别为除杂装置、冷却装置和过滤装置 B、反应器中反应需在恒温下进行,三反应器中若溶液温度突然下降,说明反应已完成 C、生产工艺中为了使硫黄充分燃烧,需通入过量压缩空气 D、Na2S2O5不稳定,易溶于水且与水反应后溶液呈酸性(4)、为了减少产品Na2S2O5中杂质含量,需控制SO2气体与纯碱固体的物质的量之比为2∶1。否则产品中会混有碳酸钠杂质,检验杂质选择试剂最简单的组合是(填编号)。
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④NaOH ⑤稀硝酸 ⑥稀硫酸
(5)、兴趣小组向330.00mL啤酒中加入适量的稀硫酸,加热使气体全部逸出通入足量的H2O2中,只有SO2与H2O2反应,微热后,将反应液体转移至小烧杯中,向烧杯内逐滴加入BaCl2溶液至沉淀量不再增加,过滤、洗涤、干燥,称得固体质量为0.0072g,则该啤酒中抗氧化剂的残留量为mg/L(以SO2计)。 -
6、氢能是极具发展潜力的清洁能源,以氢燃料为代表的绿色燃料有良好的应用前景。回答下列问题:(1)、在载人航天器中,可以利用CO2与H2反应生成H2O,通过电解水,从而实现O2的再生。
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) △H1=-252.9kJ•mol-1
②2H2O(l)=2H2(g)+O2(g) △H1=+534kJ•mol-1
甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为。
(2)、工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。I.CH4(g)+H2O(g)CO(g)+3H2(g)
II.CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2kJ•mol-1
①下列操作中,能提高反应I中CH4(g)平衡转化率的是(填标号)。
A.增加CH4(g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②在恒温恒压下,按水碳比=12:5投料,总压强为1.70MPa,达到平衡时CO2、H2和CH4的分压(某成分分压=总压×该成分的物质的量分数)如表:
p(CO2)/MPa
0.30
p(H2)/MPa
0.30
p(CH4)/MPa
0
则反应II的平衡常数Kc=。
(3)、水煤气反应II需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。
①在催化剂活性温度范围内,图2中b~c段对应降温操作的过程,实现该过程的操作方法是。
A.喷入冷水(蒸气) B.通过热交换器换热 C.按原水碳比通入冷的原料气
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线。
-
7、以废铜为原料(主要成分是Cu,含少量Fe2O3)制备胆矾和Fe2O3的工艺流程如图。回答下列问题:
 (1)、“滤渣3”与浓硫酸反应的化学方程式是。(2)、早在1000多年前,我国就采用胆矾分解产生SO3 , SO3再与水反应生产硫酸,随着生产力的发展,硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。
(1)、“滤渣3”与浓硫酸反应的化学方程式是。(2)、早在1000多年前,我国就采用胆矾分解产生SO3 , SO3再与水反应生产硫酸,随着生产力的发展,硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。①下列说法正确的是。
A.高温下胆矾分解有可能产生四种气体(SO2、O2、SO3、H2O)
B.框图工艺中氧化亚铁可以替代过量铁粉,且得到的滤液2一定具有强酸性
C.现代工艺,制取发烟硫酸是用98.3%浓硫酸吸收SO3
D.工业出厂硫酸一般质量分数大于92%是厂家用92%的浓硫酸稀释发烟硫酸得到的
E.在彩画工程中红褐色固体和胆矾可分别作为红色和蓝色油漆
②步骤V用无水酒精洗涤胆矾的理由是。
③步骤Ⅳ在酸性条件下O2氧化性增强的原因是。
(3)、设计实验鉴定滤液1中的金属阳离子:。 -
8、硒(34Se)属于氧族元素,是人体必需微量元素之一,含硒化合物在材料和药物等领域具有重要应用。回答下列问题:(1)、基态Se原子价电子排布式是。(2)、由二苯基二硒醚(I)合成含硒化合物IV的化学方程式如图:

①下列说法不正确的是。
A.反应物中所有C原子的杂化方式均为sp2
B.能量最低的激发态N原子内层电子排布式为1s22s22p2
C.化合物III(苯磺酰肼)既能与盐酸反应,也能与氢氧化钠溶液反应
D.硒氧组合的微粒中,SeO3分子的键角小于SeO
E.化合物IV的熔点主要取决于所含化学键的键能大小
②化合物VI(N2H2)不稳定,易分解成N2和H2。其不稳定的原因是。
③一定压强下,化合物V(苯硒酚)的沸点低于苯酚的原因是。
(3)、通过数学建模利用材料的晶体结构数据可预测其热电性能。下列化合物是潜在热电建模材料,晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
①其化学式为。
②设该化合物的最简式式量为M1 , 晶体密度为ρg•cm-3 , 则该化合物中相邻K之间的最短距离为nm(列出计算式,NA为阿伏加德罗常数的值)。
-
9、探究铜单质及其化合物的性质,下列实验操作和现象能得出相应结论的是
选项
实验操作和现象
结论
A
将2mL0.5mol•L-1的CuCl2溶液加热后置于冷水中,溶液黄色变为蓝色
说明降温,[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O向正反应方向移动
B
向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热未出现砖红色沉淀
X不可能是含有醛基官能团的有机化合物
C
常温下,铜与浓硝酸反应后溶液呈绿色,加热后,溶液绿色消失
加热条件下,铜与绿色物质发生化学反应
D
在5mL0.1mol•L-1CuSO4溶液中,逐滴加入30mL0.10mol•L-1氨水溶液,再滴加少量Na2S溶液,先产生蓝色沉淀,后出现深蓝色,最后为黑色沉淀
Cu(OH)2转化为[Cu(NH3)4]2+ , 说明[Cu(NH3)4]2+比Cu(OH)2更难电离;最后转化为CuS,能说明Ksp(CuS)小于Ksp[Cu(OH)2]
A、A B、B C、C D、D -
10、298K时,在H3PO4溶液中滴入NaOH溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。下列说法不正确的是
 A、可依次选用甲基橙、石蕊作指示剂,标定反应终点 B、Ka2(H3PO4)的数量级为10-8 C、等物质的量NaH2PO4和Na2HPO4溶于水,其pH小于7.2 D、向Na2HPO4溶液中加入足量的CaCl2溶液,溶液碱性减弱
A、可依次选用甲基橙、石蕊作指示剂,标定反应终点 B、Ka2(H3PO4)的数量级为10-8 C、等物质的量NaH2PO4和Na2HPO4溶于水,其pH小于7.2 D、向Na2HPO4溶液中加入足量的CaCl2溶液,溶液碱性减弱 -
11、石油化工中可利用丙烷与氧气反应制取防水卷材丙纶的生产原料丙烯,若反应中加入NO气体,速率明显加快,其反应历程和机理可简单表示如图。已知:异丙基的稳定性强于正丙基。下列有关说法不正确的是
 A、HONO为中间产物,其对应的酸酐是N2O3 B、增大NO物质的量浓度,可以提高丙烷的平衡转化率 C、物质状态和反应式计量数相同,丙烷与氧气生成丙烯的焓变是恒量 D、异丙基[(CH3)2CH•]转化为正丙基[CH3CH2CH2•]的焓变大于0
A、HONO为中间产物,其对应的酸酐是N2O3 B、增大NO物质的量浓度,可以提高丙烷的平衡转化率 C、物质状态和反应式计量数相同,丙烷与氧气生成丙烯的焓变是恒量 D、异丙基[(CH3)2CH•]转化为正丙基[CH3CH2CH2•]的焓变大于0 -
12、通过传感器测定冰醋酸被水稀释后的电导率及pH,根据变化曲线图判断下列说法正确的是
 A、离子总浓度越大,溶液电导率越大 B、b点后,溶液继续稀释,所有离子浓度均减小 C、a点醋酸水溶液未达到电离平衡状态 D、实验曲线说明传感器测量值取决于带电微粒种类、浓度、温度等因素
A、离子总浓度越大,溶液电导率越大 B、b点后,溶液继续稀释,所有离子浓度均减小 C、a点醋酸水溶液未达到电离平衡状态 D、实验曲线说明传感器测量值取决于带电微粒种类、浓度、温度等因素 -
13、2-硝基-1,3-苯二酚(桔红色针状晶体,难溶于水,沸点为88℃)可由间苯二酚经磺化、硝化等步骤合成,其中一步按图示装置(部分仪器略去)收集产品。下列说法不正确的是

 A、“混酸”混合操作步骤是将浓硫酸慢慢地加入浓硝酸中,并及时搅拌冷却至室温 B、控制反应温度不超过30℃的主要原因是避免硝酸分解或挥发,同时避免副反应发生 C、水蒸气蒸馏中,2-硝基-1,3-苯二酚残留在三颈烧瓶中,取出加水过滤得粗产品 D、按上述步骤合成产物的主要目的是防止硝基取代间苯二酚羟基对位上的氢原子
A、“混酸”混合操作步骤是将浓硫酸慢慢地加入浓硝酸中,并及时搅拌冷却至室温 B、控制反应温度不超过30℃的主要原因是避免硝酸分解或挥发,同时避免副反应发生 C、水蒸气蒸馏中,2-硝基-1,3-苯二酚残留在三颈烧瓶中,取出加水过滤得粗产品 D、按上述步骤合成产物的主要目的是防止硝基取代间苯二酚羟基对位上的氢原子 -
14、清华大学某教授开发出一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3 , 另一极为金属锂和石墨的复合材料,电解质只传导锂离子。下列说法不正确的是
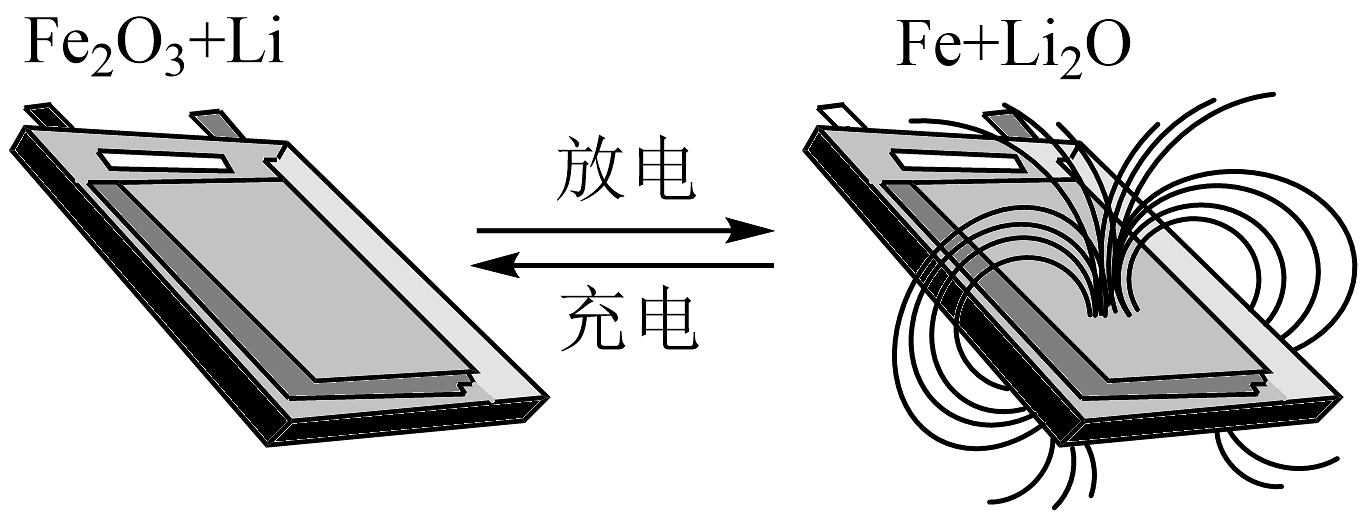 A、充电时,Fe2O3连接电源的负极,发生氧化反应 B、该电池不能使用氯化锂水溶液作为电解质溶液 C、该电池的正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe D、放电时,电池逐渐靠近磁铁,且正极质量增加
A、充电时,Fe2O3连接电源的负极,发生氧化反应 B、该电池不能使用氯化锂水溶液作为电解质溶液 C、该电池的正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe D、放电时,电池逐渐靠近磁铁,且正极质量增加 -
15、有机化合物甲、乙、丙均为合成非甾体抗炎药洛索洛芬钠片的反应物或中间体。下列关于甲、乙、丙的说法正确的是
 A、甲分子中所有碳原子共平面 B、乙分子能发生水解反应和消去反应 C、丙分子中只有一个手性碳原子 D、甲、乙、丙均能发生还原反应
A、甲分子中所有碳原子共平面 B、乙分子能发生水解反应和消去反应 C、丙分子中只有一个手性碳原子 D、甲、乙、丙均能发生还原反应 -
16、下列说法正确的是A、可用新制氢氧化铜悬浊液鉴别甲酸甲酯、甲醛和甲酸 B、可用金属钠或无水硫酸铜检验乙醇中是否混有蒸馏水 C、氢氧化铁胶体和久置氯化铁溶液可用丁达尔效应区别 D、用Br2的CCl4溶液或酸性KMnO4溶液区别二烯烃和芳香烃
-
17、下列反应的离子方程式正确的是A、工业上生产漂白粉:2OH-+Cl2=Cl-+ClO-+H2O B、用惰性电极电解饱和ZnCl2溶液:Zn2++2Cl-Zn+Cl2↑ C、二氧化硫通入氯化铁溶液中:SO2+2Fe3++2H2O=2Fe2++4H++SO D、NaHSO4溶液与Ba(OH)2溶液反应恰好呈中性:H++SO+Ba2++OH-=BaSO4↓+H2O
-
18、我国航天科工自主研发的某种芳纶纤维强度高,韧性强,不仅抗拉能力强,还有极强的防割性能,广泛用作头盔、航空航天等防护材料,其高分子结构片段如图。下列说法不正确的是
 A、氢键作用使芳纶纤维具有更优异的热稳定性和耐辐射性能 B、完全水解的产物分子中,苯环上的氢原子具有不同的化学环境 C、通过灼烧闻气味的方法可鉴别芳纶纤维和羊毛纤维 D、通过质谱法测定芳纶纤维的平均相对微粒质量,可计算出聚合度
A、氢键作用使芳纶纤维具有更优异的热稳定性和耐辐射性能 B、完全水解的产物分子中,苯环上的氢原子具有不同的化学环境 C、通过灼烧闻气味的方法可鉴别芳纶纤维和羊毛纤维 D、通过质谱法测定芳纶纤维的平均相对微粒质量,可计算出聚合度 -
19、下列说法正确的是
 A、甲装置可验证生铁的吸氧腐蚀 B、乙装置能收集到纯净干燥的Cl2 C、丙装置用蒸馏水分离苯和四氯化碳 D、丁装置用于制取并收集少量NH3
A、甲装置可验证生铁的吸氧腐蚀 B、乙装置能收集到纯净干燥的Cl2 C、丙装置用蒸馏水分离苯和四氯化碳 D、丁装置用于制取并收集少量NH3 -
20、物质的性质决定用途。下列两者对应关系不正确的是A、钾钠合金室温下呈液态,可用作核反应堆的传热介质 B、75%乙醇水溶液有强还原性,广泛用于皮肤或环境消毒 C、SO2能使某些色素褪色,加热恢复原色,可用作暂时性漂白剂 D、NaNO2是一种防腐剂和着色剂,可用于香肠等肉制品的添加剂