相关试卷
-
1、下列方案设计、现象和结论都正确的是
目的
方案设计
现象和结论
A
检验某无色溶液中是否含有
取少量该溶液于试管中,加稀硝酸酸化,再加入硝酸钡溶液
若有白色沉淀生成,则该溶液中一定含有
B
探究不同金属离于对分解速率的影响
取2支试管,向2支试管中各加入5 mL 6%溶液,分别向试管中各加入溶液和溶液
相同时间内产生气泡多的,则催化效果好
C
判断某有机物是否为醛类
取2mL样品溶液于试管中,加入5~6滴新制氢氧化铜,加热
若产生砖红色沉淀,则该有机物属于醛类
D
检验某无色气体是否为
将气体通入品红溶液中,再加热
若通入气体后品红溶液褪色,加热该褪色溶液能恢复红色,则一定为
A、A B、B C、C D、D -
2、下列关于Fe3+、Fe2+性质实验的说法错误的是( )A、用如图装置可以制备沉淀Fe(OH)2
B、配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 C、向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 D、FeCl3溶液中滴加KSCN溶液会生成红色沉淀
-
3、下列离子方程式的书写正确的是A、电解氯化镁溶液的阴极电极反应式: B、惰性电极电解饱和食盐水: C、醋酸与乙醇混合、浓硫酸催化加热: D、硫酸铝和小苏打溶液混合:
-
4、常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
 Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A、降低c(CO),平衡逆向移动,反应的平衡常数减小 B、第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ C、第二阶段,Ni(CO)4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) -
5、设NA是阿伏加德罗常数的数值,下列说法正确的是A、1 mol Al3+离子含有的核外电子数为3NA B、常温常压下,22.4 L乙烯中C—H键数为4NA C、10 L pH=1的硫酸溶液中含有的H+离子数为2NA D、18gH2O中含有的质子数为10NA
-
6、阿斯巴甜是市场上主流甜味剂之一,以下是以天门冬氨酸为原料合成阿斯巴甜的路线。

下列说法不正确的是
A、天门冬氨酸难溶于乙醇、乙醚 B、①④的目的是为了保护氨基 C、反应过程中包含了取代反应、消去反应 D、相同物质的量的阿斯巴甜分别与盐酸和氢氧化钠充分反应,消耗与的物质的量之比为 -
7、下列叙述错误的是A、二氧化碳分子的比例模型:
 B、的化学性质与基本相同
C、的电子式:
B、的化学性质与基本相同
C、的电子式: D、中含有非极性共价键
D、中含有非极性共价键
-
8、用下列实验装置进行相应的实验,能达到实验目的的是
 A、用甲装置进行已知浓度的NaOH溶液滴定未知浓度的硫酸 B、用乙装置收集NO2气体 C、用丙装置制备气体并对生成的气体体积进行测量,可以减少误差 D、用丁装置灼烧碳酸钠晶体
A、用甲装置进行已知浓度的NaOH溶液滴定未知浓度的硫酸 B、用乙装置收集NO2气体 C、用丙装置制备气体并对生成的气体体积进行测量,可以减少误差 D、用丁装置灼烧碳酸钠晶体 -
9、下列说法正确的是A、光伏发电是将化学能转化为电能 B、钢铁吸氧腐蚀正极的电极反应式是 C、通过电解NaCl水溶液的方法生产金属钠 D、铅蓄电池的负极材料是Pb,正极材料是
-
10、设表示阿伏加德罗常数的值,下列说法中正确的是A、标准状况下,、的混合气体与中所含原子总数均为 B、常温下,的溶液中由水电离出的个数为 C、标准状况下,的和的混合气体中所含中子数和原子数的差值为 D、将溶液制成胶体,所得胶体粒子数为
-
11、生活处处都伴随有化学,以下有关说法不正确的是A、天然金刚石形成于地壳中 B、液晶介于液态和晶态之间,可用于制造显示器 C、细胞双分子膜的两边都亲水 D、生物机体可以产生具有光学活性的分子
-
12、工业制备盐酸以和为原料。实验室将在空气中点燃的气体缓慢伸入集气瓶中模拟制备少量(如图所示),下列说法不合理的是
 A、气体是 B、工业上不能采用混合光照的方法制备 C、反应过程中集气瓶口有白雾生成 D、实验方案会用到
A、气体是 B、工业上不能采用混合光照的方法制备 C、反应过程中集气瓶口有白雾生成 D、实验方案会用到 、
、 等图标进行提示
等图标进行提示
-
13、常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。和(亚氯酸钠)均具有漂白性,工业上由气体制取固体的工艺流程如图所示:
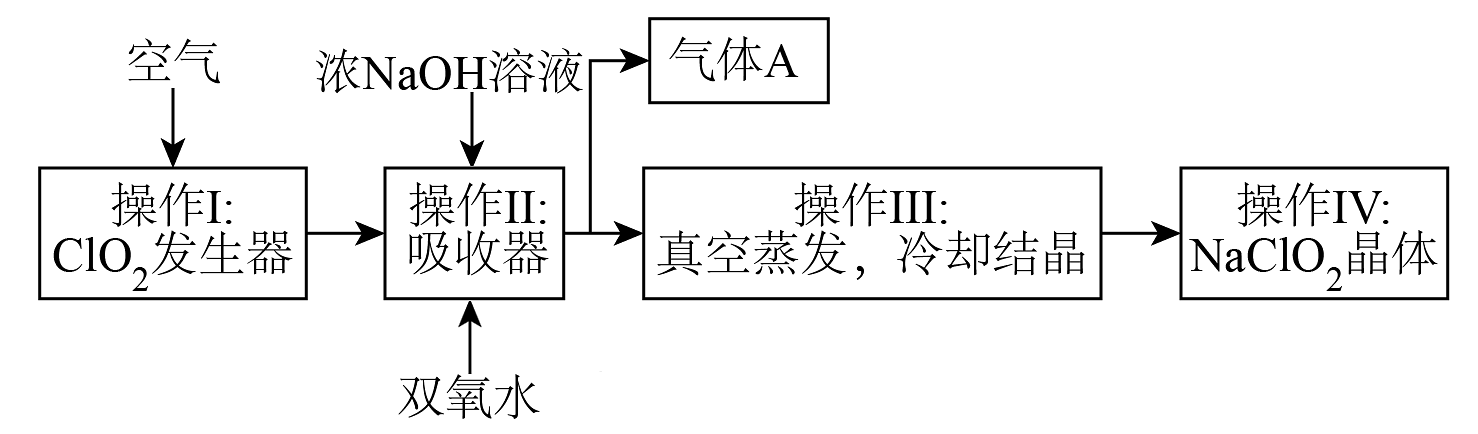
请回答下列问题:
(1)、吸收器中生成的离子方程式为(补充完整):① 。___________+___________+___________=___________↑+___________。
②此氧化还原反应中,双氧水表现性;若2个完全反应,一共(填“得到”或“失去”)的电子数为个。
(2)、为了探究和的氧化性或还原性,某兴趣小组进行下列2个实验,请完成实验报告。实验②可供选用的试剂有:溶液、KI溶液、淀粉溶液、酸性溶液序号
实验操作
实验现象
实验结论
①
将通入足量KI溶液中,加入稀硫酸,再加入几滴淀粉溶液
②
, 再滴加几滴溶液
具有还原性
(3)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克的氧化能力(氧化能力相同,即有效氯生成氯离子时,转移电子数目相同)。的有效氯含量为(计算结果保留两位小数)。 -
14、在抗击新冠肺炎疫情的战役中,消毒剂发挥了重要的作用。(1)、常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2与浓盐酸反应
b.2KMnO4+16HCl (浓)=2KCl+2MnCl2+5Cl2↑+8H2O
c.KClO3+6HCl (浓)=KCl+3Cl2↑+3H2O
①酒精、Cl2、KMnO4、浓盐酸中属于电解质的是 , 属于非电解质的是。
②写出反应a的化学方程式。
③反应b中被氧化的元素为 , 氧化剂为。当15.8 g KMnO4参与反应时,发生电子转移的HCl有g。
④当参与三个反应的HCl的质量相同时,得到Cl2的质量最多的是(填字母序号)。
(2)、“84”消毒液的有效成分为NaClO,常温下用烧碱溶液吸收Cl2可制备“84”消毒液。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO、NaClO3的混合溶液。当混合溶液中的Cl-和的个数比为15∶2时,混合液中的ClO-和的个数比为。(3)、“洁厕灵”的有效成分为较浓的盐酸。“洁厕灵”和“84”消毒液不可以混合使用,否则会产生有毒气体。请用离子方程式解释原因:。(4)、高铁酸钠(Na2FeO4))是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:。请配平该化学方程式并用单线桥表示电子转移的方向和数目。 -
15、已知有如下反应:
①
②
③
根据上述反应,判断下列结论中错误的是
A、在①、③反应中均作氧化剂 B、在反应②中既是氧化产物又是还原产物 C、氧化性强弱的顺序为: D、溶液中可发生: -
16、MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:

下列说法错误的是
A、酸浸过程中可以用浓盐酸代替稀硫酸 B、操作X的名称是过滤 C、氧化过程发生反应的离子方程式为:5Mn2++2ClO+4H2O=5MnO2↓+Cl2↑+8H+ D、Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 -
17、某兴趣小组为制备氯气并验证其性质,做了如下实验,实验装置如图所示(部分固定装置未画出)。下列说法不正确的是
 A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中可以看到有色布条Ⅰ褪色,布条Ⅱ不褪色 D、F中发生的离子方程式为:Cl2+OH- =Cl- +ClO- +H2O
A、将装置A中换成 , 也能达到实验目的 B、装置B有除去及作安全瓶的作用 C、装置C中可以看到有色布条Ⅰ褪色,布条Ⅱ不褪色 D、F中发生的离子方程式为:Cl2+OH- =Cl- +ClO- +H2O -
18、下列操作、现象和结论均正确的是
选项
操作
现象
结论
A
向碳酸钠粉末滴几滴水,再插入温度计
碳酸钠结块变成晶体,温度升高
碳酸钠与水反应生成 , 同时放热
B
将通入淀粉-KI溶液
淀粉-KI溶液变蓝色
氧化性:
C
向待测液中加入盐酸酸化的溶液
有白色沉淀生成
待测液中含有Cl-
D
在空气中点燃氢气,将导管伸入盛有氯气的集气瓶
集气瓶中产生白烟
生成HCl
A、A B、B C、C D、D -
19、向Ba(OH)2溶液中滴入NaHSO4溶液,其导电能力随滴入溶液体积的变化关系如图所示,下列分析不正确的是
 A、NaHSO4是离子化合物 B、a至b对应反应的离子方程式为Ba2+ +H+ +OH-+SO= BaSO4↓+H2O C、b点溶液呈中性 D、c点溶液中存在大量的Na+、H+、SO
A、NaHSO4是离子化合物 B、a至b对应反应的离子方程式为Ba2+ +H+ +OH-+SO= BaSO4↓+H2O C、b点溶液呈中性 D、c点溶液中存在大量的Na+、H+、SO -
20、实验室用石灰石与稀盐酸制备的实验中,下列装置图能达到对应实验目的的是


A.制备
B.除去中混有的HCl气体


C.干燥
D.排空气法收集
A、A B、B C、C D、D