-
1、H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
 (1)、已知破坏键、键、键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出kJ的热量。(2)、将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如右图所示的原电池装置,正极发生的电极反应式为;该电池在工作时,电子的移动方向为。(3)、电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:
(1)、已知破坏键、键、键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出kJ的热量。(2)、将石墨和铜片用导线及电流计相连浸入500mLFeCl3溶液中,构成如右图所示的原电池装置,正极发生的电极反应式为;该电池在工作时,电子的移动方向为。(3)、电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。
(4)、液态肼(N2H4)—过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如下图所示。该电池的B极区发生(填“氧化反应”或“还原反应”),电池工作过程中,若A极区产生N2 , 请写出A极区的电极反应式 。
-
2、Ⅰ.某学习小组进行浓硫酸对蔗糖的脱水实验,为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如图装置:
 (1)、图1的A选用图2中的(填编号)。(2)、图1的B装置所装试剂是;D装置中试剂的作用是。(3)、图1的A装置中使蔗糖体积膨胀的化学方程式为。(4)、Ⅱ.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究外界条件对化学反应速率的影响。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
(1)、图1的A选用图2中的(填编号)。(2)、图1的B装置所装试剂是;D装置中试剂的作用是。(3)、图1的A装置中使蔗糖体积膨胀的化学方程式为。(4)、Ⅱ.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究外界条件对化学反应速率的影响。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:实验编号
L酸性溶液的体积/mL
溶液的体积/mL
的体积/mL
实验温度/℃
溶液褪色所需时间/min
①
10
35
25
②
10
10
30
25
③
10
10
50
表中V1=
(5)、探究温度对化学反应速率影响的实验编号是(填编号)(6)、实验③测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化。这段时间内平均反应速率v(H2C2O4)=。 -
3、回答下列问题
Ⅰ.自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:
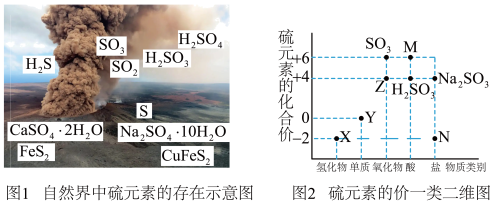 (1)、图2中的N对应图1中物质的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、Na2SO3溶液易被氧化成Na2SO4 , 检验Na2SO3溶液是否变质的试剂为。(4)、铜和M的浓溶液反应生成Z的化学方程式为。(5)、Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。
(1)、图2中的N对应图1中物质的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、Na2SO3溶液易被氧化成Na2SO4 , 检验Na2SO3溶液是否变质的试剂为。(4)、铜和M的浓溶液反应生成Z的化学方程式为。(5)、Ⅱ.氮氧化物(NOx)是大气污染物之一,处理NOx对于环境保护具有重要的意义。在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
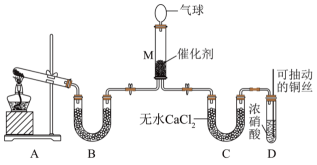
装置D中发生反应的离子方程式是。
(6)、在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,则该反应的化学方程式。(7)、工业生产中利用氨水吸收少量SO2和NO2 , 原理如图所示。NO2被吸收过程的离子方程式是。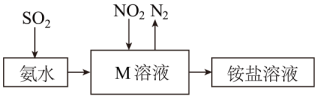
-
4、在一定温度下,将等物质的量的A和B两种气体混合于恒容密闭容器中,发生如下反应:。末该反应达平衡,生成 , , C的平均反应速率是。下列判断正确的是A、 B、内B的反应速率为 C、A的转化率为60% D、混合气体的密度不变或平均相对分子质量不变,都可以表明该反应已达到平衡状态
-
5、恒温恒容,可逆反应2SO2(g)+ O2(g) 2SO3(g)达到平衡的标志是( )A、SO2的分解速率与SO3的生成速率相等 B、混合气体的密度不再变化 C、SO2、O2、SO3的物质的量之比为2:1:2 D、体系的压强不变
-
6、对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列措施能加快反应速率的是( )
①恒容条件下,再通入一定量的NH3 ②增大体系容积③恒容条件下,再通入一定量的N2 ④适当升高温度
A、①②④ B、①③④ C、①④ D、②④ -
7、党的二十大报告中指出:要“加强污染物协同控制,基本消除重污染天气”。一氧化氮—空气质子交换膜(只允许H+通过)燃料电池将化学能转化为电能的同时,实现了制硝酸、发电、环保三位一体的结合,其工作原理如图所示。下列说法正确的是( )
 A、为电池的负极,发生还原反应 B、电极附近发生的反应: C、若过程中产生2molHNO3 , 则消耗O2的体积为33.6L(标准状况) D、电池工作时H+穿过质子交换膜向Pt1电极迁移
A、为电池的负极,发生还原反应 B、电极附近发生的反应: C、若过程中产生2molHNO3 , 则消耗O2的体积为33.6L(标准状况) D、电池工作时H+穿过质子交换膜向Pt1电极迁移 -
8、下列关于化学反应与能量变化的说法正确的是( )
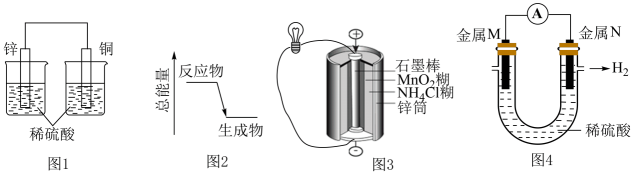 A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中在正极发生还原反应 D、图4所示装置可验证金属活动性:M<N
A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中在正极发生还原反应 D、图4所示装置可验证金属活动性:M<N -
9、如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
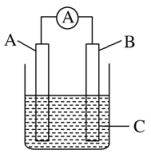 A、B极为原电池的正极 B、A、B、C可能分别为Zn、Cu、稀硫酸 C、C可以是酒精溶液 D、A极发生氧化反应
A、B极为原电池的正极 B、A、B、C可能分别为Zn、Cu、稀硫酸 C、C可以是酒精溶液 D、A极发生氧化反应 -
10、下列图示与对应的叙述相符的是( )
 A、图甲代表浓H2SO4稀释过程中体系的能量变化 B、图乙表示反应物断键吸收的能量小于生成物成键放出的能量 C、图丙表示白磷比红磷稳定 D、图丁表示CO与H2O的反应是吸热反应
A、图甲代表浓H2SO4稀释过程中体系的能量变化 B、图乙表示反应物断键吸收的能量小于生成物成键放出的能量 C、图丙表示白磷比红磷稳定 D、图丁表示CO与H2O的反应是吸热反应 -
11、NA为阿伏加德罗常数的值。下列说法正确的是( )A、50 mL、18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA B、1molFe和足量S充分反应转移电子数为2NA C、常温下,将2.7 g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA D、标准状况下,22.4 LSO2与足量O2的反应,生成的SO3分子数为NA
-
12、如图是实验室制备、除杂、收集常见四种气体的装置(其中a、b、c表示相应仪器中加入的试剂),其中可行的一组是( )

选项
气体
a
b
c
A
NO
稀硝酸
Cu
浓硫酸
B
盐酸
碳酸钙
饱和NaHCO3溶液
C
浓氨水
生石灰
碱石灰
D
浓盐酸
MnO2粉末
浓硫酸
A、A B、B C、C D、D -
13、下列装置适用于实验室制氨气并验证氨气的性质,其中能达到实验目的的是( )
 A、用装置甲制取氨气 B、用装置乙除去氨气中的水蒸气 C、丙的原理为 D、装置丁中,干燥烧瓶内盛有氨气,烧杯和胶头滴管内盛有水(含酚酞),打开止水夹,挤压胶头滴管的胶头,会出现蓝色喷泉
A、用装置甲制取氨气 B、用装置乙除去氨气中的水蒸气 C、丙的原理为 D、装置丁中,干燥烧瓶内盛有氨气,烧杯和胶头滴管内盛有水(含酚酞),打开止水夹,挤压胶头滴管的胶头,会出现蓝色喷泉 -
14、室温下,在透明的强酸性溶液中能大量共存的离子组是( )A、、、Mg2+、SO42- B、Na+、NH、Cl-、 C、、、Fe2+、NO3- D、Na+、、、HSO
-
15、下列因果关系正确是( )A、浓硫酸有脱水性,用浓硫酸可除去 N2中的水蒸气 B、浓硝酸见光易分解,浓硝酸要保存在棕色试剂瓶里 C、氢氟酸具有弱酸性,氢氟酸可用来刻蚀玻璃 D、氨气液化时吸收大量的热,液氨常用作制冷剂
-
16、下列说法正确的是( )A、泡菜中的微生物将硝酸盐还原为亚硝酸盐的过程,属于氮的固定 B、石英玻璃、碳化硅陶瓷、水泥、石墨烯都是硅酸盐材料 C、高纯硅可用于制作计算机芯片的材料 D、“钡餐”的主要成分为BaCO3
-
17、砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为GaAs,含、、等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。

已知:①“碱浸”时,GaAs中Ga以的形式进入溶液。
②离子完全沉淀时的pH:为8,为5.6。
(1)、第一电离能比较:AsGa(填“<”“>”或“=”,下同),原子半径比较:AsGa。(2)、下图为砷化镓晶胞,白球所代表原子的配位数是。已知:晶胞参数为apm,密度为 , 则阿伏加德罗常数可表示为(用含a、d的式子表示)。 (3)、“碱浸”时,GaAs参加的离子方程式为。(4)、“调pH①”时,pH=最合适;滤液②的溶质成分为(写化学式)。(5)、写出用情性电极电解制备镓单质的电极反应方程式:。
(3)、“碱浸”时,GaAs参加的离子方程式为。(4)、“调pH①”时,pH=最合适;滤液②的溶质成分为(写化学式)。(5)、写出用情性电极电解制备镓单质的电极反应方程式:。 -
18、冬季下雪天气,使用道路融冰剂消除冰雪保证交通安全。氯化钙是道路融冰剂的主要成分,某实验小组欲测定市售融冰剂中氯化钙的纯度,进行如下实验:
步骤一:取10.0g样品,加入适量水溶解,配成溶液。
步骤二:将上述所得溶液加水稀释,最后定容至。
步骤三:每次取25.00mL待测液于锥形瓶中,加入1-2滴指示剂,用(硝酸酸化)标准液进行滴定,重复滴定三次。
回答下列问题:
(1)、使用碱式滴定管量取待测液。排出碱式滴定管中气泡的方法应采用如图所示操作中的 , 然后小心操作使尖嘴部分充满待测液。 (2)、用标准液进行滴定时,下列试剂可作为该滴定实验指示剂的是____(填“A”或“B”) [已知为白色沉淀,]A、溶液[砖红色沉淀,] B、溶液[黑色沉淀,](3)、滴定时注意观察锥形瓶内沉淀颜色的变化,根据(2)中所选指示剂判断滴定达到终点的依据是。(4)、表示指示剂酸根离子,达到滴定终点时溶液中。(5)、滴定结果如表,第1次滴定读数如图:
(2)、用标准液进行滴定时,下列试剂可作为该滴定实验指示剂的是____(填“A”或“B”) [已知为白色沉淀,]A、溶液[砖红色沉淀,] B、溶液[黑色沉淀,](3)、滴定时注意观察锥形瓶内沉淀颜色的变化,根据(2)中所选指示剂判断滴定达到终点的依据是。(4)、表示指示剂酸根离子,达到滴定终点时溶液中。(5)、滴定结果如表,第1次滴定读数如图:
滴定次数
待测液体积/mL
标准溶液的体积/mL
滴定前刻度
滴定终点刻度
1
25.00
a
b
2
25.00
0.00
20.00
3
25.00
0.20
20.10
第1次滴定终点时读数为;该市售融冰剂中氯化钙的纯度为。
(6)、下列操作会导致氯化钙的纯度测定结果偏高的是____。A、待测液定容时仰视刻度线 B、滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 C、盛装标准液的滴定管没有用标准液润洗 D、滴定前滴定管尖嘴处有气泡,滴定后消失 -
19、X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,它的某种氧化物可用作红色颜料;Q基态原子的3d层全充满,N层没有成对电子。(1)、P、Q中位于周期表的d区的是(填元素符号,下同),基态Q原子的价层电子排布式为; 元素X、Y、Z中,电负性最大的是。(2)、烃的1个分子中含有个σ键;X和Y的简单氢化物中沸点更高的是(填化学式),理由是(答2点)。(3)、化合物可用作杀菌消毒剂和漂白剂,分子的中心原子杂化类型是;工业上可用W的单质与潮湿的碳酸钠反应制取 , 并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式。
-
20、Ⅰ肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)、写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:。(2)、已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是 kJ。(3)、Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。
(4)、0~4min内,CO2的转化率为(保留三位有效数字) ,CO的平均反应速率为。(5)、下列选项能说明上述反应已达平衡状态的是____(填字母)。A、v(CO2)=v(CO) B、单位时间内生成n mol Fe的同时生成n mol FeO C、容器中气体压强不随时间的变化而变化 D、容器中CO2浓度不随时间的变化而变化(6)、燃料电池因具有发电效率高。环境污染少等优点而备受人们关注。用于笔记本电脑的甲醇(CH3OH)燃料电池示意图如下,a是极,此电极反应为。