-
1、化合物Ⅶ是制备抗菌药的中间体,实验室以芳香化合物Ⅰ为原料制备Ⅶ的一种合成路线如下:
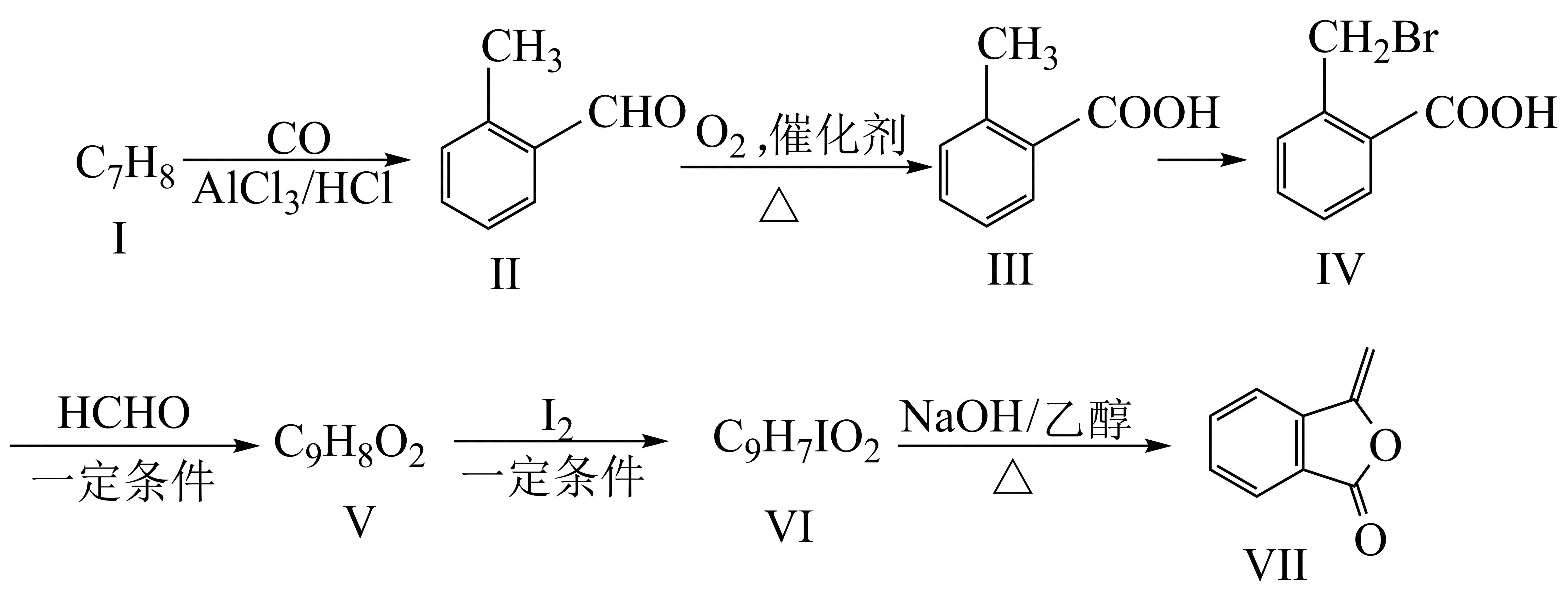
已知:

回答下列问题:
(1)、化合物Ⅰ的名称为;化合物Ⅳ含有的官能团的名称是。(2)、化合物Ⅴ的结构简式为;化合物Ⅵ→化合物Ⅶ的反应类型为。(3)、化合物Ⅱ→化合物Ⅲ的化学方程式为。(4)、芳香化合物Ⅹ是化合物Ⅳ的同分异构体,同时满足如下条件的化合物Ⅹ的结构有种(不考虑立体异构);条件:a)含有的官能团的种类和数目与化合物Ⅳ的相同;b)苯环上有两个取代基
其中,核磁共振氢谱有四组峰的结构简式(任写一种)。
(5)、根据上述信息,写出以溴乙烷为原料制备聚-2-丁烯的合成路线 (无机试剂任选,需注明反应条件)。 -
2、2021年全世界前沿新材料领域取得新的进展。推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:(1)、钛的核外电子排布式是 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛元素的检验方法如图:

可与形成配离子 , 其原因是。
(3)、二氧化钛()是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米催化的一个实例如图所示:
化合物乙的分子中采取杂化方式成键的原子数目是个。
(4)、氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为 , 该晶体结构中与N原子距离最近且相等的N原子有个;该晶胞的密度 , 则晶胞结构中两个氮原子之间的最近距离为。(为阿伏加德罗常数的数值,只列计算式)
-
3、铁是地球上分布最广泛的金属之一,约占地壳质量的5%,仅次于氧、硅、铝,位居地壳含量第四位。蛋白琥珀酸铁(CaHbOcNdFe)口服液可以用来治疗缺铁性贫血的治疗。请回答以下相关问题:(1)、写出基态铁原子的价层电子排布式。(2)、给出蛋白琥珀酸铁含有的C、N、O三种元素的第一电离能从小到大排序 , 并解释原因。(3)、将C、N、O三种元素最简单氢化物按照键角从大到小排序。(4)、已知O、S、Se、Te在元素周期表中位于同主族,将这四种元素的最简单氢化物按照沸点从大到小排序。(5)、琥珀酸的结构如图所示,写出琥珀酸分子中σ键与π键的个数比。
 (6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。
(6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。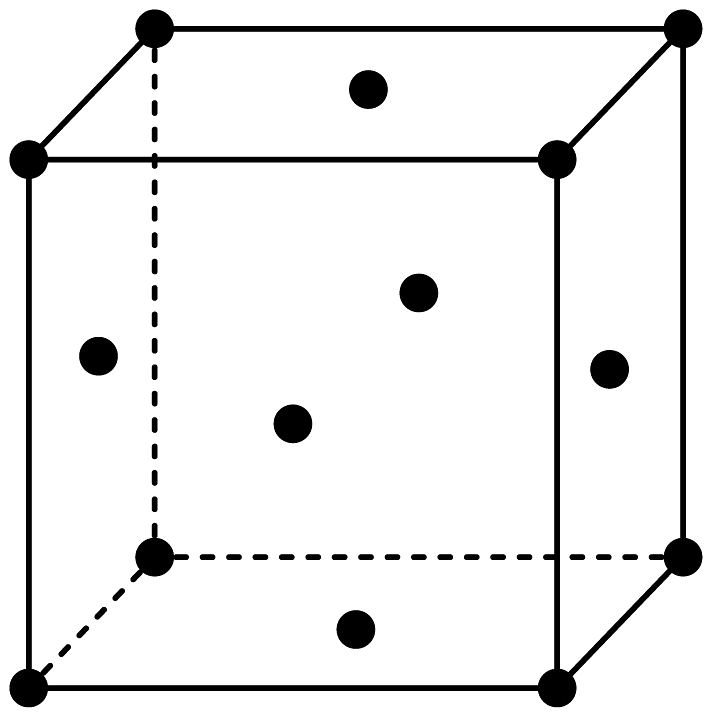
-
4、将下列反应产生的气体通入如图所示的装置,所选试剂不能达到实验目的的是

选项
操作
目的
试剂a
试剂b
A
往电石中滴加饱和食盐水
验证乙炔的性质
溶液
酸性溶液
B
混合苯、液溴、铁粉
验证苯的取代反应
无
溶液
C
加热1-溴丁烷与的乙醇溶液
验证反应产生了烯烃
无
溴的溶液
D
往中滴加醋酸
验证酸性:碳酸>苯酚
饱和溶液
苯酚钠溶液
A、A B、B C、C D、D -
5、阿莫西林是常见的抗生素,其结构如图所示,下列说法错误的是
 A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应
A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应 -
6、设为阿伏加德罗常数值.下列有关叙述正确的是A、甲烷中的氢原子被氯原子完全取代,需要氯气分子数为 B、甘油(丙三醇)中含有羟基数为 C、乙烯和丙烯混合气体中的氢原子数为 D、标准状况下,含有的共价键数为
-
7、自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是
 A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)
A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长) -
8、下列说法正确的是A、
 的一溴代物和
的一溴代物和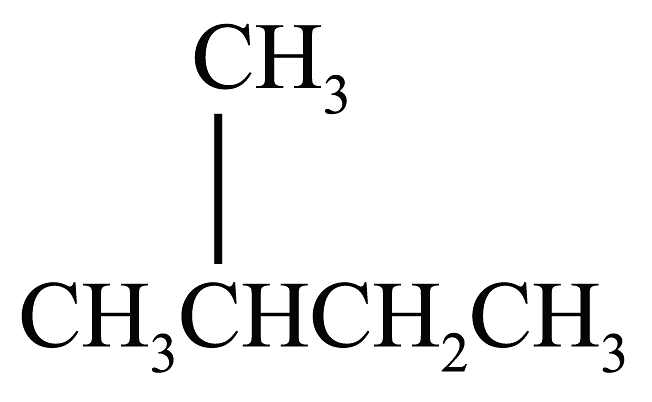 的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物
的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物 的名称是2,3,4一三甲基-2-乙基戊烧
D、
的名称是2,3,4一三甲基-2-乙基戊烧
D、 和
和 互为同系物
互为同系物
-
9、石棉具有高度耐火性、电绝缘性和绝热性,是重要的防火、绝缘和保温材料,其化学式为 , 其组成也可写成余化物形式:。下列说法正确的是A、组成元素均位于元素周期表的p区 B、的熔点比的高 C、ⅣA族元素单质的晶体类型相同 D、基态硅原子核外电子有8种不同的空间运动状态
-
10、下列说法正确的是A、基态Cr原子的价层电子:3d54s1 , 违反能量最低原理 B、基态C原子的电子排布式:1s22s22px12pz1 , 违反能量最低原理 C、基态C原子的价层电子排布图:
 ,违反泡利原理
D、基态Fe3+的3d电子排布图:
,违反泡利原理
D、基态Fe3+的3d电子排布图: ,违反洪特规则
,违反洪特规则
-
11、溶于浓溶液中可得到配合物。下列说法错误的是A、提供空轨道 B、中心离子的配位数是4 C、含有键数目为 D、向溶液中逐滴滴加浓溶液至过量,先形成蓝色沉淀,后沉淀溶解
-
12、依据元素周期律,下列判断不正确的是A、原子半径:Mg<Na<K B、第一电离能:Li<Be<B C、电负性:N<O<F D、热稳定性:SiH4<PH3<HCl
-
13、下列关于水合氢离子的说法错误的是A、含有极性键 B、空间构型为三角锥形 C、键角: D、和中氧原子均为杂化
-
14、下列化学用语表示正确的是A、中子数为10的氧原子: B、的空间结构:(直线型) C、二甲基甲酰胺的结构简式:
 D、的电子式:
D、的电子式:
-
15、人类对核外电子运动的认知不断进步。下列说法正确的是A、电子在线性轨道上绕核运行 B、电子从激发态跃迁到基态时能产生吸收光谱 C、、、轨道相互平行、能量相等 D、轨道比轨道大,其空间包含了轨道
-
16、下列关于有机化合物的说法不正确的是
A
B
C
D



木糖醇()是一种天然甜味剂,属于糖类化合物
聚乙烯由线型结构转变为网状结构能够增加材料的强度
DNA分子复制过程中存在氢键的断裂和形成
烷基磺酸钠(表面活性剂)在水中聚集形成的胶束属于超分子
A、A B、B C、C D、D -
17、下列实验操作对应的现象预测正确或能达到有关实验目的的是
 A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体
A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体 -
18、为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、(从下列图中选择,写出名称)。

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择作为电解质。
阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 , 铁电极的电极反应式为。因此,验证了Fe2+氧化性小于 , 还原性小于。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是。
-
19、下列关于物质的结构或性质及解释都正确的是
选项
物质的结构或性质
解释
A
金属活动性:Mg>Al
第一电离能:Mg>Al
B
熔点:SiO2>CO2
相对分子质量:SiO2大于CO2
C
酸性:HCOOH>CH3COOH
O-H的极性:HCOOH强于CH3COOH
D
熔点:Cl2<Br2<I2
键能:Cl-Cl>Br-Br>I-I
A、A B、B C、C D、D -
20、钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点的为 , 晶胞边长为anm,下列说法中不正确的是
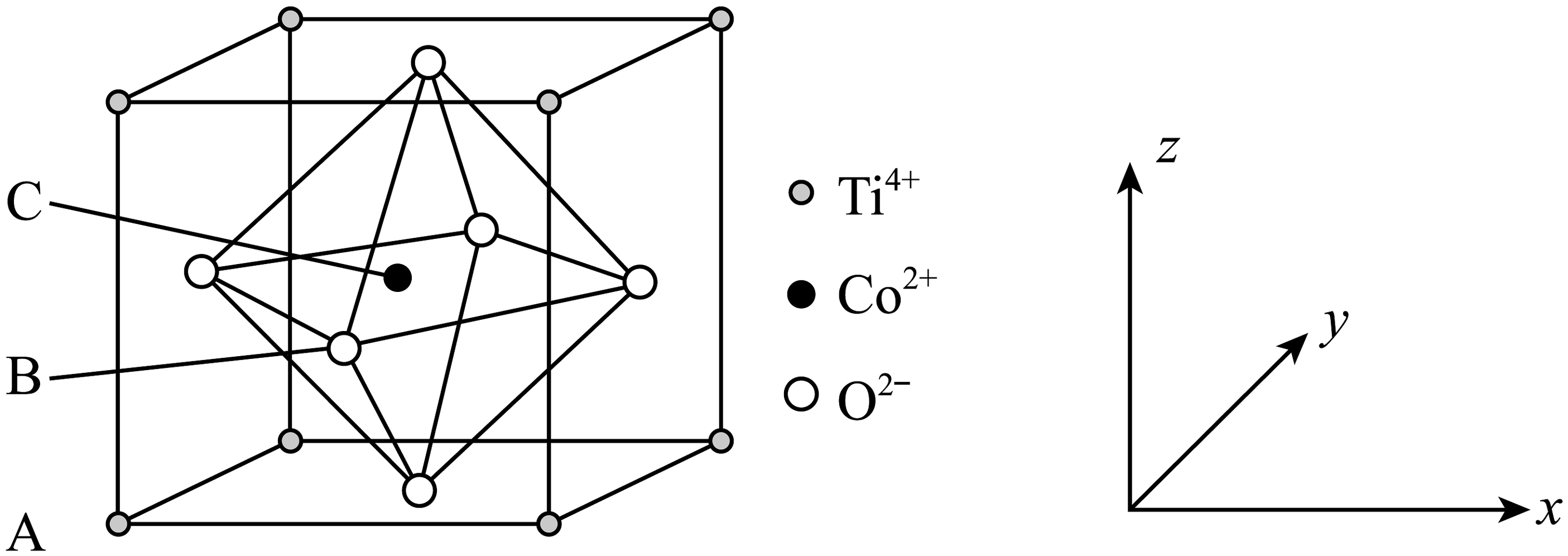 A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为
A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为