-
1、将NaCl固体加入水中,在水分子的作用下,Na+和Cl−脱离NaCl固体的表面进入水中。该过程的示意图不正确的是A、
 B、
B、 C、
C、 D、
D、
-
2、二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
反应①
反应②
回答下列问题:
(1)、(2)、有利于提高转化为平衡转化率的措施有(填编号)。A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大和的初始投料比
(3)、二氧化碳加氢制甲醇的总反应按投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 , 在下的随温度变化,在下的随压强变化如图所示。
①图中对应在下的随温度变化的等压过程的曲线是(填“”或“”)。判断理由是。
②时,反应条件可能为或。
③时,计算的平衡转化率,写出计算过程。
-
3、研究之间的转化具有重要意义。
已知:
将一定量气体充入恒容的密闭容器中,控制反应温度为。
(1)、下列可以作为反应达到平衡的判据是___________(填编号)。A、气体的压强不变 B、 C、K不变 D、容器内颜色不变(2)、反应温度时,体系中、随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 , 随t(时间)变化曲线如图虚线所示。
① , 在0~60s时段,反应速率为
②反应温度为(填“大于”或“小于”)。
③温度时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动。
④时刻反应达到平衡,混合气体平衡总压强为p,气体的平衡转化率为75%,则反应的平衡常数。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)、NO氧化反应:分两步进行,其反应过程能量变化示意图如图。
Ⅰ.
Ⅱ.
决定NO氧化反应速率的步骤是(填“Ⅰ”或“Ⅱ”)。
-
4、常温下,HCOOH和的电离常数分别为和。将pH和体积相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
 A、曲线Ⅰ代表HCOOH溶液 B、溶液中水的电离程度:b点>c点 C、相同体积a点的两溶液分别与NaOH恰好中和后,溶液中相同 D、从c点到d点,溶液不变(HA、分别代表相应的酸和酸根离子)
A、曲线Ⅰ代表HCOOH溶液 B、溶液中水的电离程度:b点>c点 C、相同体积a点的两溶液分别与NaOH恰好中和后,溶液中相同 D、从c点到d点,溶液不变(HA、分别代表相应的酸和酸根离子) -
5、能使反应的反应速率增大,且平衡向正反应方向移动的是A、及时分离出气体 B、增大的浓度 C、适当降低温度 D、选择高效催化剂
-
6、固氮的其中一种方法: , 温度和化学平衡常数(K)关系如下表,下列说法正确的是
温度/℃
25
2000
化学平衡常数/K
0.100
A、该反应放热反应 B、K与温度、压强均有关系 C、NO与、生成铵态氮肥 D、不宜用此方法大规模生成NO -
7、下列设备工作时,化学能转化为电能的是




A.碱性普通锌锰电池
B.天然气灶
C.风力发电
D.太阳能电池
A、A B、B C、C D、D -
8、下列图像分别表示有关反应的反应过程与能量变化的关系。

据此判断下列说法中正确的是( )
A、由图1知,石墨转变为金刚石是吸热反应 B、由图2知,S(g)+O2(g)=SO2(g) ΔH1 , S(s)+O2(g)=SO2(g)ΔH2 , 则ΔH1>ΔH2 C、由图3知,白磷比红磷稳定 D、由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0 -
9、下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是A、氢氧化钠与盐酸;氢氧化钠与碳酸 B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与NaHSO4溶液 C、Na2CO3溶液与硝酸溶液;CaCO3与硝酸溶液 D、石灰石与硝酸;石灰石与盐酸
-
10、单质到盐的转化关系可表示为:
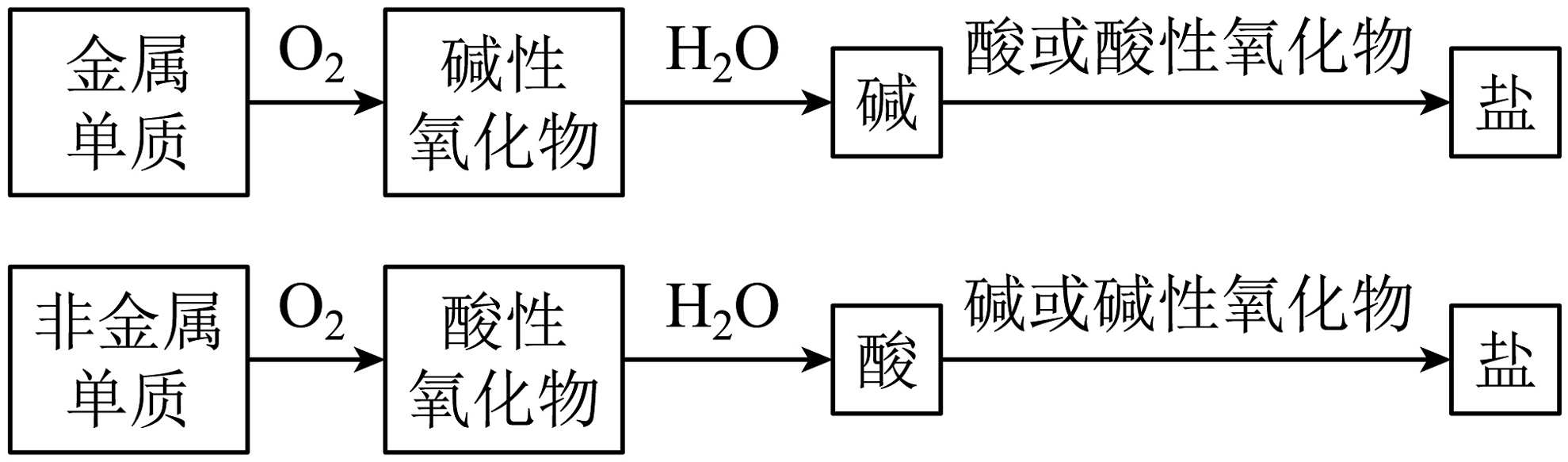
下述转化关系不正确的是( )
A、Na Na2O NaOH CH3COONa B、Mg MgO MgCl2 MgSO4 C、C CO2 H2CO3 CaCO3 D、S SO2H2SO3 Na2SO3 -
11、下列电离方程式书写正确的是A、把H2SO4放入水中:H2SO4=H2++ B、把Ba(OH)2放入水中:Ba(OH)2=Ba2++ C、把NaHSO4放入水中:NaHSO4=Na++H++ D、把CaCl2放入水中:CaCl2=Ca2++
-
12、化学与生活、社会发展息息相关,下列说法不正确的是A、从化学角度来说,“往伤口上撒盐”也有科学道理,这种做法的化学原理是胶体的聚沉 B、“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及氧化还原反应 C、“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 D、“熬胆矾铁釜,久之亦化为铜”,该过程发生了复分解反应
-
13、盐酸洛美沙星是一种氟喹诺酮药物,具有抗肿瘤活性。某课题组设计的合成路线如下(部分反应条件已省略):



请回答:
(1)、下列说法不正确的是_______。A、化合物A分子中所有原子一定共平面 B、根据合成路线推测,化合物C能与其他物质发生缩聚反应 C、化合物G中含有配位键 D、洛美沙星的分子式为(2)、化合物B的官能团名称是;化合物H的结构简式是。(3)、写出D→E的化学方程式。(4)、写出3种同时符合下列条件的化合物F的同分异构体的结构简式(不包括立体异构体)。①谱表明:分子中共有3种不同化学环境的氢原子;
②IR谱检测表明:苯环上有多酚羟基且相邻,且分子不含-CN,含-N=O;
③分子中还有一个五元碳环。
(5)、以苯胺( )和甲氧亚甲基丙二酸二甲酯[]为原料,设计合成如下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
)和甲氧亚甲基丙二酸二甲酯[]为原料,设计合成如下图所示化合物的合成路线(用流程图表示,无机试剂、有机溶剂任选)。
-
14、酸式盐是盐的一种,可看作多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2 , 则下列说法正确的是A、H3PO2属于二元酸 B、H3PO2属于三元酸 C、NaH2PO2属于正盐 D、NaH2PO2属于酸式盐
-
15、某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠的性质有
①钠比水的密度小
②钠的熔点较低
③钠与水反应时放出热量
④钠与水反应后溶液呈碱性
A、①④ B、①②④ C、①③④ D、①②③④ -
16、下列仪器与名称不相符的是



A.三脚架
B.漏斗
C.坩埚
D.干燥管
A、A B、B C、C D、D -
17、
根据所学知识回答下列问题:
I.现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示:

(1)沉淀A的主要成分是BaSO4和(填化学式)。
(2)②中反应的离子方程式是。
(3)①②③中均进行的分离操作是。
(4)③中加入过量的Na2CO3溶液的目的是。
II.某河道两旁有甲、乙两厂,甲厂排放的工业废水中含有下列离子中的三种,乙厂的废水中含有下列离子中的另外三种。[已知:OH-与Ag+不能共存,AgCl和Fe(OH)3均为沉淀]
阳离子
K+、Ag+、Fe3+
阴离子
Cl-、OH-、
(5)经检测,甲厂的废水明显呈碱性,故甲厂废水中所含的离子为。
(6)如果在乙厂的废水中加一定量的铁粉,可以回收其中的金属(填写金属的元素符号),此反应的离子方程式为。
-
18、实践是检验真理的唯一标准。某兴趣小组利用以下装置制备并验证其性质,其中能达到预期目的的是




A.制备
B.验证还原性
C.干燥
D.验证漂白性
A、A B、B C、C D、D -
19、科技强国。我国科学家在诸多领域取得新突破,下列说法不正确的是A、杭州亚运主火炬燃料为零碳甲醇,甲醇具有还原性 B、国产大型邮轮“爱达・魔都号”采用的薄形钢板属于合金 C、量子计算机“悟空”面世,其传输信号的光纤主要成分为 D、“华龙一号”中的二氧化铀陶瓷芯块是核电站的“心脏”,铀是第ⅠA族元素
-
20、醋酸溶液中存在电离平衡 CH3COOH⇌CH3COO-+H+ , 下列各项不正确的是A、醋酸溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO- ) B、常温下,pH=2 的 CH3COOH 溶液与 pH=12 的 NaOH 溶液等体积混合后,溶液的 pH<7 C、向 CH3COOH 溶液中加少量的 CH3COONa固体,平衡逆向移动 D、将 0.10mol/L CH3COOH 溶液加水稀释,溶液中所有的离子浓度都减小