-
1、辛勤劳动才能创造美好生活。下列劳动场景中,不涉及氧化还原反应的是




A.冶炼钢铁
B.海水晒盐
C.古法酿酒
D.用过氧化物消毒
A、A B、B C、C D、D -
2、设为阿伏加德罗常数的值。下列说法正确的是A、蔗糖完全水解得到的葡萄糖分子数为 B、常温常压下,中含有的碳碳双键数目为 C、乙醇溶液与足量钠反应生成的分子数为 D、光照条件下,(标准状况下)与足量氯气反应生成的分子数小于
-
3、古医典中富含化学知识,下列描述与氧化还原反应无关的是A、汞的性质:汞得硫则赤如丹 B、强水(硝酸):用水入五金皆成水 C、熬制胆矾:熬胆矾铁釜,久之亦化为铜 D、制取黄铜:红铜(Cu)六斤、倭铅(Zn)四斤,先后入罐熔化,冷定取出,即成黄铜
-
4、以铁镍合金(含少量铜)为原料,生产电极材粗的部分工艺流程如下:

已知:常温下, , , , 。
回答下列问题:
(1)、基态Ni原子价层电子轨道表示式是;Cu原子位于周期表中区。(2)、“酸溶”时Ni转化为 , 该过程中温度控制在70~80℃的原因是。(3)、“氧化”时的作用是(用离子方程式表示)。(4)、“除铜”时若选用NaOH溶液,会导致部分也产生沉淀,当常温时溶液中、沉淀同时存在时,溶液中。(5)、“沉镍”时得到碳酸镍沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 , 该反应的化学方程式是。(6)、金属镍的配合物用途广泛,其中配体CO与结构相似,CO分子内σ键与π键个数之比为。 -
5、常温下,用溶液滴定溶液所得滴定曲线如图。下列说法正确的是
 A、该滴定实验中,选择甲基橙作指示剂的滴定误差小 B、点①所示溶液中: C、点②所示溶液中: D、点③所示溶液中:
A、该滴定实验中,选择甲基橙作指示剂的滴定误差小 B、点①所示溶液中: C、点②所示溶液中: D、点③所示溶液中: -
6、用分液漏斗可以分离的一组液体混合物是A、溴和苯 B、苯和溴苯 C、水和硝基苯 D、苯和汽油
-
7、研究化学能与电能的相互转化规律是电化学的核心问题,下列说法中正确的是
 A、图a装置是原电池,可以实现化学能转化为电能 B、图b装置电解一段时间后在石墨电极上有紫红色固体析出 C、图c装置利用电解池原理,可以防止铁钉生锈 D、图d中轮船铁质外壳上镶嵌锌块可减缓船体的腐蚀速率
A、图a装置是原电池,可以实现化学能转化为电能 B、图b装置电解一段时间后在石墨电极上有紫红色固体析出 C、图c装置利用电解池原理,可以防止铁钉生锈 D、图d中轮船铁质外壳上镶嵌锌块可减缓船体的腐蚀速率 -
8、粗食盐水中常含有少量Ca2+、Mg2+、杂质离子,实验室提纯粗食盐水制取食盐的流程如下,关于实验过程中所选用的试剂、目的及所发生反应的离子方程式均正确的是

选项
试剂
目的
离子方程式
A
KOH溶液
仅除去Mg2+
Mg2++2OH-=Mg(OH)2↓
B
BaCl2溶液
仅除去
Ba2++Na2SO4=BaSO4↓+2Na+
C
Na2CO3溶液
仅除去Ca2+
Ca2++=CaCO3↓
D
盐酸
除去OH-和
H++OH-=H2O
2H++=CO2↑+H2O
A、A B、B C、C D、D -
9、在的反应中,现采取下列措施:①缩小体积;②增加碳的量;③恒容下通入;④恒容下充入;⑤恒压下充入能够使反应速率增大的措施是A、①④ B、②③⑤ C、①③ D、①②④
-
10、下列关于化学反应与能量变化的说法正确的是
 A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中发生还原反应 D、图4所示装置可验证金属活动性:M<N
A、图1所示装置可将化学能转化为电能 B、图2可表示晶体与晶体反应的能量变化 C、图3所示的锌锰干电池中发生还原反应 D、图4所示装置可验证金属活动性:M<N -
11、乙烯是重要有机化工原料。结合以下路线回答:
已知:其中F为高分子化合物
(1)、物质B所含官能团的名称为;(2)、D的结构简式为;(3)、反应①、⑥所涉及的反应类型是、;(4)、写出反应①的化学方程式为;(5)、写出反应⑦的化学方程式为;(6)、关于CH2=CH2的说法正确的是_______;A、易溶于水 B、是平面结构的分子 C、能被高锰酸钾氧化 D、在一定条件下能发生加聚反应(7)、丙烯(CH2=CHCH3)与乙烯具有相似的化学性质(写结构简式)。①丙烯与Br2的加成产物为。
②在一定条件下丙烯与H2O的加成产物可能为。
-
12、
水体的化学需氧量(COD)能反映水体受还原性物质污染的程度。某小组用高锰酸钾法测定学校周边河水的COD值。请回答下列问题:
I.配制200mL2.00×10-3mol•L-1的KMnO4溶液
(1)计算、称量:需用分析天平称量gKMnO4固体(保留到小数点后四位)。(2)选择仪器:需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、。(3)称量后,以下操作步骤的顺序为。
定容的操作是:将蒸馏水注入容量瓶,当 , 改用胶头滴管加水至溶液凹液面最底端与刻度线相切。
(4)下列操作会使KMnO4溶液浓度偏低的是。①转移溶液前,容量瓶底部有水
②转移溶液时,溶液不慎洒到容量瓶外
③定容时,仰视刻度线
④摇匀后,液面低于刻度线,不再加水
(5)配制KMnO4溶液后用稀硫酸酸化,说明不用盐酸酸化的原因。II.KMnO4法测定河水的COD值
测定原理为:4KMnO4+5C+6H2SO4=4MnSO4+2K2SO4+5CO2↑+6H2O
其中C代替水中还原性物质,根据消耗KMnO4溶液的体积计算水样中还原性物质的浓度,进而计算水样的COD值[COD=c(C)×M(O2)]。
(6)取水样25.00mL于锥形瓶中,加入稀硫酸,消耗所配制的KMnO4溶液的体积为12.50mL(三次实验平均值),计算该水样是否符合国家一级A出水标准。(写出计算过程,国家一级A出水标准为COD≤50mg•L-1) -
13、物质类别和元素价态是学习元素及化合物性质的重要认识视角。部分含硫物质的分类与相应硫元素化合价的关系图如图所示。下列说法不正确的是
 A、d溶液久置于空气中会生成e B、气体c可用e的浓溶液干燥 C、将a和f的钠盐溶液混合会生成b D、将气体c通入品红溶液中,溶液褪色,体现了c的氧化性
A、d溶液久置于空气中会生成e B、气体c可用e的浓溶液干燥 C、将a和f的钠盐溶液混合会生成b D、将气体c通入品红溶液中,溶液褪色,体现了c的氧化性 -
14、化合物ⅸ是一种烯丙胺类抗真菌药物,可用于皮肤浅部真菌感染的治疗,它的一种合成路线如下:
 (1)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:
(1)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:序号
反应试剂、条件
反应形成的有机产物的结构简式
反应类型
a
消去反应
b
加成反应
(2)、反应①中,化合物ⅰ与有机物x反应,生成化合物ⅱ,原子利用率为100%,x的名称为。(3)、化合物iv中含氧官能团的名称是 , 反应③的类型是。(4)、关于反应⑤的说法中,不正确的有___________。A、反应过程中,有C-Cl键和C-N键断裂 B、反应过程中,有C-N键和H-Cl键的形成 C、反应物ⅶ中,所有原子可能处于同一平面上 D、生成物ⅶ具有碱性,能与稀盐酸发生反应(5)、化合物iii有多种同分异构体,其中含C=C-C=C结构,且核磁共振氢谱图上只有两组峰的结构简式为。(6)、以苯乙烯和乙醛为含碳原料,利用反应③的原理,通过四步反应合成结构简式如下的化合物y,基于你设计的合成路线,回答下列问题: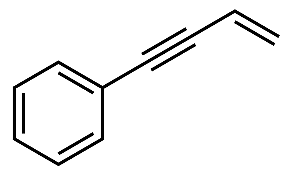
(a)从苯乙烯出发,第一步反应的化学方程式为。
(b)合成路线中涉及两步消去反应,最后一步通过消去反应得到产物的化学方程式为(注明反应条件)。
-
15、过氧化氢的水溶液适用于医用消毒、环境消毒和食品消毒。回答下列问题:(1)、的分子结构如图所示,两个氢原子犹如在半展开的书的两面上。过氧化氢属于(填“极性”或“非极性”)分子。
 (2)、根据的解离反应:、 , 、 , , 可判断为元弱酸,常温下,1的溶液的pH约为。(3)、趣味实验“大象牙膏”的实验原理是溶液在KI催化作用下分解,反应的机理表示如下:
(2)、根据的解离反应:、 , 、 , , 可判断为元弱酸,常温下,1的溶液的pH约为。(3)、趣味实验“大象牙膏”的实验原理是溶液在KI催化作用下分解,反应的机理表示如下:第一步: 慢反应
第二步: 快反应
①写出第一步反应的化学反应离子方程式:。
②在下图中画出有无KI两种情况的分解反应过程能量变化示意图:

③298K时,实验测得反应在不同浓度时的化学反应速率如表所示:
实验编号
1
2
3
4
5
0.100
0.200
0.300
0.100
0.100
0.470
0.470
c
0.940
1.410
0.00093
0.00186
0.00280
0.00187
0.00279
已知速率方程为 , 其中k为速率常数。
根据表中数据判断:a= , c=。
(4)、298K时,将10mL a mol/L溶液、10mL 2a mol/L溶液和10mL NaOH溶液混合(忽略溶液混合时的体积变化),发生反应 , 溶液中与反应时间(t)的关系如图所示。
①时时(填“大于”“小于”或“等于”)。
②若平衡时溶液的pH=12,则该反应的平衡常数K=(用含a和y的代数式表示)。
-
16、钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分为、 , 杂质有、及Mg、Al、Mn等化合物)制备单质钒的工艺流程如图所示。

已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示;
金属离子
开始沉淀时pH
1.9
7.0
3.0
8.1
完全沉淀时pH
3.2
9.0
4.7
10.1
② , , 远大于。回答下列问题:
(1)、基态V的价层电子排布式为。(2)、为了提高“焙烧”效率,可采取的措施有。(答出其中一条即可)(3)、“焙烧”时,、都转化为 , 写出转化为的化学方程式为。(4)、“水浸”加入调节溶液的pH为8.5,可完全除去的金属离子有 , 部分除去的金属离子有。“水浸”加入过量不能使完全转化为 , 用沉淀溶解平衡原理解释原因是。(一般情况下, , 化学上通常认为该反应进行完全了)。(5)、“离子交换”与“洗脱”可表示为 , 为强碱性阴离子交换树脂,为在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用。(6)、“沉钒”过程析出晶体,需要加入过量 , 目的是。(7)、钒的某种氧化物的晶胞结构如图所示,晶胞的长、宽、高分别是a pm、b pm、c pm,阿伏加德罗常数的值为 , 则该晶体的密度为(用含a、b、c、的代数式表示)。
-
17、铁的化合物在水溶液中呈现丰富的颜色,这与其水解平衡和配位平衡有关。(1)、下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
A
B
C
D
配制溶液
制备胶体
观察胶体的丁达尔效应
分离胶体与溶液



 A、A B、B C、C D、D(2)、实验室用溶液制备胶体的化学反应方程式为。(3)、实验小组为探究溶液对水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
A、A B、B C、C D、D(2)、实验室用溶液制备胶体的化学反应方程式为。(3)、实验小组为探究溶液对水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。已知:①水解程度越大,颜色越深
②颜色越深,透光率越低
组别
溶液
蒸馏水
溶液
透光率
1
2
3
① , 。
②由 , 可证明:减小,的水解平衡逆向移动。(选填“>”“<”或“=”)
③分析实验结果: , 同学甲推测原因可能是:(较深的黄色),并做了如下实验:
组别
溶液
蒸馏水
试剂
透光率
4
试剂为 , 可由 , 证实同学甲的推测。
通过对比(填字母)的实验结果,证明对的水解平衡的影响。
A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)、为了探究的热效应,同学乙设计了下列四组实验方案:组别
温度
试剂
透光率
5
溶液
6
溶液
7
溶液
8
溶液
若实验结果为 , 则可证明:为吸热反应。
(5)、写出一种强酸弱碱盐(除)及其用途:。 -
18、已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示(实验结束后,b中NaCl溶液浓度变大)。下列说法正确的是
 A、外电路中,电子由FeS极流向Li极 B、当电路中转移1mol e-时,b室离子数增加NA个 C、离子交换膜m为阴离子交换膜 D、若将图中n膜去掉,将b、c两室合并,则电解反应总方程式不会改变
A、外电路中,电子由FeS极流向Li极 B、当电路中转移1mol e-时,b室离子数增加NA个 C、离子交换膜m为阴离子交换膜 D、若将图中n膜去掉,将b、c两室合并,则电解反应总方程式不会改变 -
19、次磷酸(H3PO2)是一元酸,可用于金属的表面处理。已知常温下,NaH2PO2的水溶液呈碱性,下列说法错误的是A、0.01mol·L-1 H3PO2水溶液的pH>2 B、NaH2PO2的水溶液中:c(Na+)=c(H3PO2)+c(H2PO)+c(HPO)+c(PO) C、NaH2PO2在水溶液的电离方程式为:NaH2PO2=Na+ +H2PO D、NaH2PO2的水溶液加水稀释,减小
-
20、在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
 A、 B、该反应的平衡常数表达式为 C、在时加入催化剂,平衡时 D、达到平衡状态后,充入纯氧,再次达到平衡后,
A、 B、该反应的平衡常数表达式为 C、在时加入催化剂,平衡时 D、达到平衡状态后,充入纯氧,再次达到平衡后,