-
1、关于化合物M:
 下列说法正确的是 A、M分子中处于同一直线上的原子数最多为9个 B、M分子中仅含有1个手性碳原子 C、1mol M可以消耗1mol NaOH D、M不能使酸性KMnO4稀溶液褪色
下列说法正确的是 A、M分子中处于同一直线上的原子数最多为9个 B、M分子中仅含有1个手性碳原子 C、1mol M可以消耗1mol NaOH D、M不能使酸性KMnO4稀溶液褪色 -
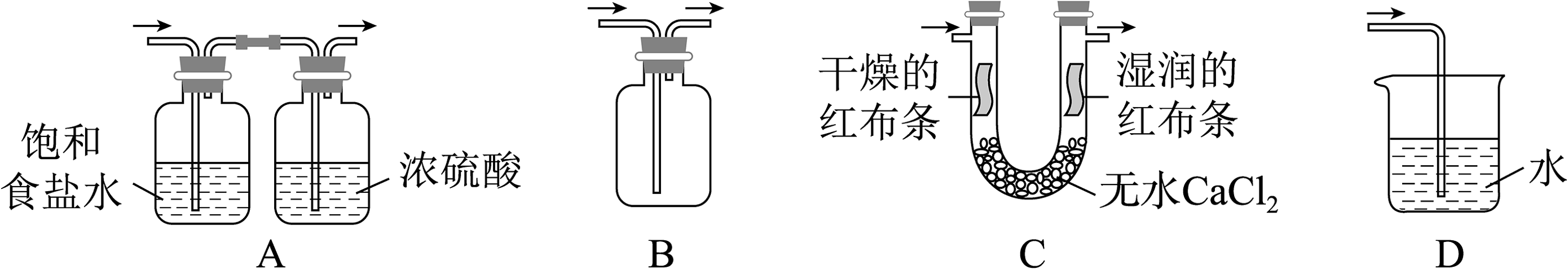
2、下列实验装置或操作不正确的是


A.测定锌与稀硫酸反应速率
B.测定中和反应的反应热


C.制备乙烯
D.探究铁的吸氧腐蚀
A、A B、B C、C D、D -
3、下列过程中,颜色变化与氧化还原反应无关的是A、湿润的淀粉KI试纸遇氯气变蓝色 B、放置时间较长的苯酚固体变为粉红色 C、氯化铁溶液滴入KSCN溶液变红色 D、酸性K2Cr2O7溶液滴入乙醇变绿色
-
4、下列各组离子中能大量共存的是A、Cl-、OH-、SO、NH B、H+、Fe2+、SO、Cl- C、K+、Ba2+、NO、SO D、H+、Cl-、MnO、Fe2+
-
5、维生素C是重要的营养素,其分子结构如图。下列关于维生素C的叙述不正确的是
 A、维生素C的分子式为C6H8O6 B、分子中含有3种官能团 C、1mol该物质最多能与2mol H2加成 D、该物质能发生氧化反应、取代反应、消去反应
A、维生素C的分子式为C6H8O6 B、分子中含有3种官能团 C、1mol该物质最多能与2mol H2加成 D、该物质能发生氧化反应、取代反应、消去反应 -
6、实验室为配制0.10mol/L的稀硫酸,不需要用到的仪器是A、
 B、
B、 C、
C、 D、
D、
-
7、干冰升华过程中,其焓变和熵变正确的是A、 , B、 , C、 , D、 ,
-
8、某溶液中含有Na+、CO、HCO、Cl- , 在加入Na2O2后浓度不发生变化的是A、Na+、CO B、Cl- C、CO、Cl- D、HCO
-
9、实验室用和浓盐酸反应生成后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
 A、A B、B C、C D、D
A、A B、B C、C D、D -
10、下列关于化合物
 的说法正确的是 A、与苯互为同系物 B、可以发生取代、加成、加聚反应 C、分子中所有原子可能共平面 D、一氯代物有4种(不考虑立体异构)
的说法正确的是 A、与苯互为同系物 B、可以发生取代、加成、加聚反应 C、分子中所有原子可能共平面 D、一氯代物有4种(不考虑立体异构) -
11、部分含或含物质的分类与相应化合价关系如图所示。下列推断不合理的是
 A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键
A、可存在c→d→e的转化 B、能与反应生成c的物质只有b C、新制的d可用于检验葡萄糖中的醛基 D、若b能与反应生成 , 则b中含共价键 -
12、常温下,将体积均为的HA溶液和BOH溶液分别加水稀释至V,溶液的pH随的变化如图所示。已知 , 下列说法正确的是
 A、电离常数: B、水的电离程度:b>d C、升温,a点溶液中增大 D、等浓度HA和BOH溶液等体积混合,溶液的pH<7
A、电离常数: B、水的电离程度:b>d C、升温,a点溶液中增大 D、等浓度HA和BOH溶液等体积混合,溶液的pH<7 -
13、氮氧化物、二氧化硫能引发酸雨、雾霾等。回答下列问题:(1)、汽车尾气催化转化器可将尾气中的CO、NO均转化为无害气体,该反应的化学方程式为。(2)、目前工业上烟气脱硫脱硝的工艺流程如下:

已知:烟气中含尘、、。
“催化氧化”的目的是;图中产品中含硫成分为(填化学式)。该物质中含有键(填化学键类型),写出该物质的一种用途。
(3)、为探究某种催化剂在有氧条件下用还原的最佳温度,将一定比例的、和混合,以一定的流速通过催化还原反应器[如图(a)],反应相同时间后测得的去除率随反应温度的变化曲线如图(b)所示。
①写出催化反应器中与反应的化学方程式:。
②当反应温度高于380℃时,的去除率迅速下降的原因可能是。
-
14、将NaCl固体溶于水后,溶液中存在多种微粒,如图所示的微粒是
 A、聚合水分子 B、水合钠离子 C、水合氯离子 D、水合氢离子
A、聚合水分子 B、水合钠离子 C、水合氯离子 D、水合氢离子 -
15、将下列各组物质按单质、酸性氧化物、酸、碱、盐分类顺序排列,其中正确的是A、液氮、七氧化二锰、硫酸、烧碱、小苏打 B、碘酒、冰、硫酸氢钠、烧碱、碳酸钙 C、氢气、一氧化碳、硝酸、纯碱、胆矾 D、铜、干冰、醋酸、石灰水、氯化铜
-
16、下列关于电化学装置的叙述中正确的是
 A、图1所示装置可实现将设计成原电池 B、图2所示电池放电过程中,负极的质量逐渐减少 C、图3所示装置可实现在铁表面镀铜 D、图4所示装置工作过程中,电解质溶液中浓度始终不变
A、图1所示装置可实现将设计成原电池 B、图2所示电池放电过程中,负极的质量逐渐减少 C、图3所示装置可实现在铁表面镀铜 D、图4所示装置工作过程中,电解质溶液中浓度始终不变 -
17、将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为A、0.02 mol/L B、0.03 mol/L C、0.05 mol/L D、0.3 mol/L
-
18、氢化钠可在野外用作生氢剂,其中氢元素为价.用作生氢剂时的化学反应原理为: . 下列有关该反应的说法中,正确的是A、该反应属于置换反应 B、该反应属于复分解反应 C、中的氢元素被还原 D、是氧化剂
-
19、某学习小组需0.1000mol·L-1的碳酸钠溶液450mL。下列有关说法正确的是A、称量前应将Na2CO3·xH2O灼烧至恒重,冷却后称量 B、配制时需用托盘天平称取4.8g无水碳酸钠 C、配制前容量瓶必须干燥 D、配制定容时俯视容量瓶刻度线会使配制溶液的物质的量浓度偏高
-
20、使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是

选项
A
B
C
D
试剂a
CuSO4
NH4HCO3
H2SO4
CH3COOH
试剂b
Ba(OH)2
Ca(OH)2
Ba(OH)2
NH3·H2O
A、A B、B C、C D、D