-
1、糖类、蛋白质、油脂是生命中的基础有机化合物,下列说法中正确的是A、糖类、蛋白质、油脂均能发生水解反应,但水解产物不相同 B、成熟苹果的汁液中含葡萄糖,可在一定的条件下和银氨溶液发生银镜反应 C、温度越高,酶的催化效率越高 D、检验淀粉是否水解完全的方法:在水解液中先加入过量的氢氧化钠溶液,然后滴加碘水,若溶液未变蓝,则说明已水解完全
-
2、科学生产中蕴藏着丰富的化学知识。下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
煮豆浆点卤水制作豆腐
胶体聚沉
B
盐碱地(含较多Na2CO3等)施用适量石膏,降低土壤的碱性
盐与盐发生复分解反应
C
利用铝热法焊接钢轨
铝与氧化铁反应,且放出大量的热
D
用75%酒精杀菌消毒
酒精具有还原性
A、A B、B C、C D、D -
3、化学反应中常常伴随着能量的变化,某气体反应的能量变化如图所示,下列叙述正确的是
 A、该反应不一定需要加热 B、△H=E2-E1 C、该反应的反应物一定比生成物稳定 D、该反应断开所有反应物化学键所吸收的能量小于形成所有生成物化学键所释放的能量
A、该反应不一定需要加热 B、△H=E2-E1 C、该反应的反应物一定比生成物稳定 D、该反应断开所有反应物化学键所吸收的能量小于形成所有生成物化学键所释放的能量 -
4、银饰用久了表面会有一层而发黑,将银饰与片接触并加入溶液,发生原电池反应可以除去银饰表面的。下列说法不正确的是
 A、Al片作原电池的负极 B、溶液中钠离子向银饰极移动 C、电子由负极经NaCl溶液流向正极 D、表面发生反应:
A、Al片作原电池的负极 B、溶液中钠离子向银饰极移动 C、电子由负极经NaCl溶液流向正极 D、表面发生反应: -
5、常温下,下列各组离子在指定溶液中一定能大量共存的是A、pH=1的溶液中:NO、SO、K+、Cl- B、无色透明的溶液中:K+、SO、Na+、MnO C、遇石蕊变蓝的溶液中:H+、Na+、Al3+、K+ D、含大量NO的溶液中:H+、Mg2+、S2-、NH
-
6、下列物品主要成分是无机非金属材料的是
物品




选项
A.玉器
B.丝绸
C.铁器
D.纸张
A、A B、B C、C D、D -
7、钠离子电池成本优势明显,有望在大规模储能中取代传统铅酸电池。下图为一种钠离子电池放电的示意图,关于该电池说法正确的是
 A、a为电池的负极 B、放电时b极反应: C、充电时a极反应: D、用该电池给铅酸电池充电时,b电极接铅酸电池的极
A、a为电池的负极 B、放电时b极反应: C、充电时a极反应: D、用该电池给铅酸电池充电时,b电极接铅酸电池的极 -
8、傍晚,无数光柱透过云层,将天空映照得非常美丽。该光柱
 A、源于丁达尔效应 B、证明空气是纯净物 C、由O2无规则运动引起 D、由N2的“惰性”引起
A、源于丁达尔效应 B、证明空气是纯净物 C、由O2无规则运动引起 D、由N2的“惰性”引起 -
9、常温下,将含有酚酞的溶液平均分成两份,分别逐滴滴加稀硫酸和硫酸钠溶液,测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是
 A、甲曲线对应氢氧化钡与稀硫酸的反应 B、甲曲线上的M点代表两种溶液恰好完全反应 C、乙曲线导电能力减弱的过程中,溶液由红色变为无色 D、乙曲线对应的反应过程中、浓度均减小
A、甲曲线对应氢氧化钡与稀硫酸的反应 B、甲曲线上的M点代表两种溶液恰好完全反应 C、乙曲线导电能力减弱的过程中,溶液由红色变为无色 D、乙曲线对应的反应过程中、浓度均减小 -
10、关于实验室安全,下列表述错误的是A、等钡的化合物均有毒,相关废弃物应进行无害化处理 B、观察烧杯中钠与水反应的实验现象时,不能近距离俯视 C、具有
 标识的化学品为易燃类物质,应注意防火
D、硝酸具有腐蚀性和挥发性,使用时应注意防护和通风
标识的化学品为易燃类物质,应注意防火
D、硝酸具有腐蚀性和挥发性,使用时应注意防护和通风
-
11、化合物X是由细菌与真菌共培养得到的一种天然产物,结构简式如图。下列相关表述错误的是
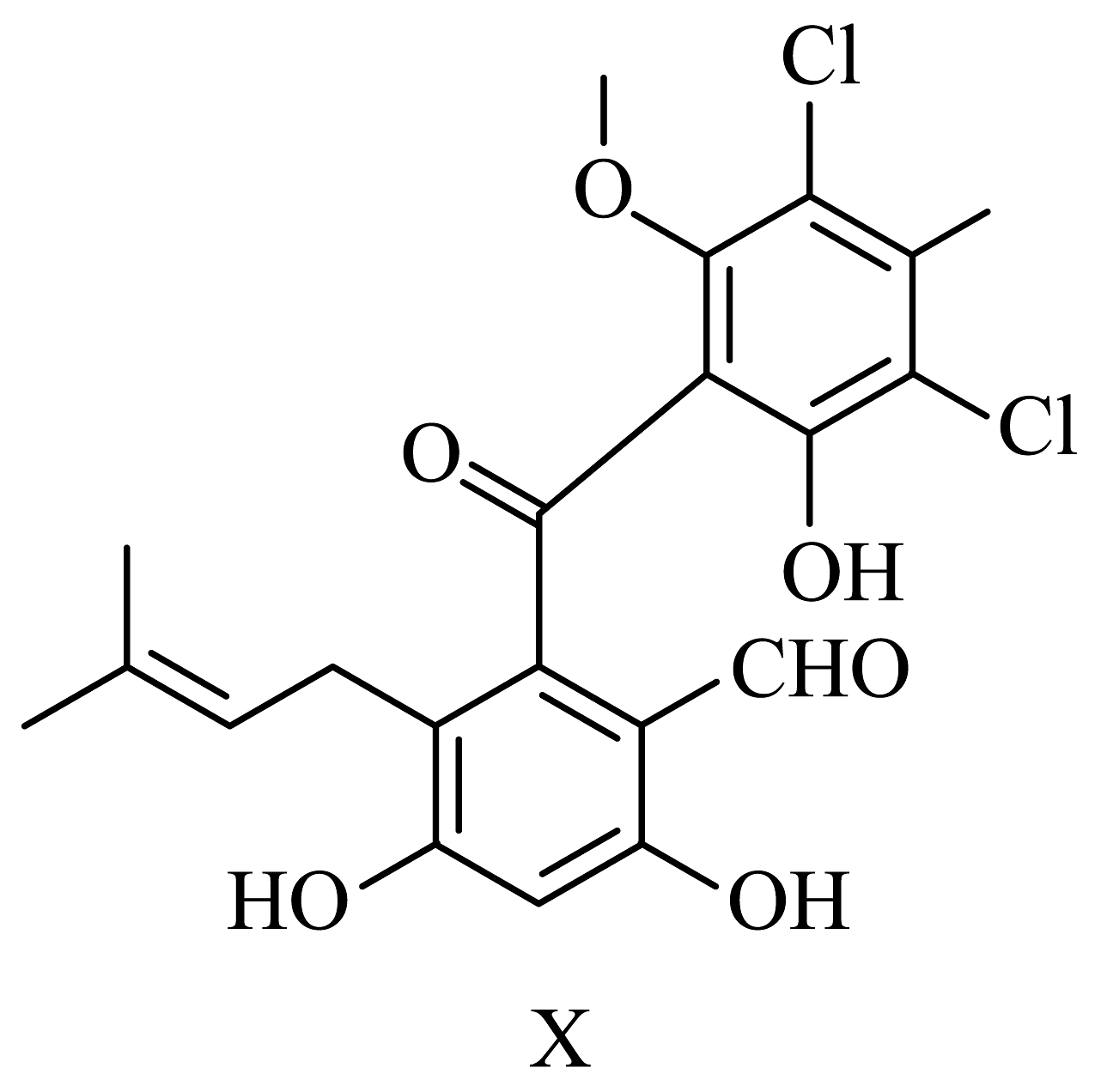 A、可与发生加成反应和取代反应 B、可与溶液发生显色反应 C、含有4种含氧官能团 D、存在顺反异构
A、可与发生加成反应和取代反应 B、可与溶液发生显色反应 C、含有4种含氧官能团 D、存在顺反异构 -
12、高分子材料在生产、生活中得到广泛应用。下列说法错误的是A、线型聚乙烯塑料为长链高分子,受热易软化 B、聚四氟乙烯由四氟乙烯加聚合成,受热易分解 C、尼龙66由己二酸和己二胺缩聚合成,强度高、韧性好 D、聚甲基丙烯酸酯(有机玻璃)由甲基丙烯酸酯加聚合成,透明度高
-
13、化学来源于生活,下列关于宣纸的传统制作工艺主要发生化学变化的是




A.挑选原料
B.加碱蒸煮
C.竹帘捞纸
D.剪裁纸张
A、A B、B C、C D、D -
14、已知反应Ⅰ和反应Ⅱ的反应原理及反应进程中能量变化如下:
Ⅰ.
Ⅱ.
下列说法正确的是
 A、 B、反应Ⅰ的反应速率大于反应Ⅱ的反应速率 C、反应Ⅱ正反应的活化能为 D、加入合适催化剂后、、均会降低
A、 B、反应Ⅰ的反应速率大于反应Ⅱ的反应速率 C、反应Ⅱ正反应的活化能为 D、加入合适催化剂后、、均会降低 -
15、“火星上‘找’到水的影子”被《科学》杂志评为10大科技突破之一。某温度下,重水(D2O)的离子积 , 可以用pH一样的定义来规定。下列说法错误的是A、重水是极弱的电解质,将金属Na加入重水中,重水的电离程度增大 B、该温度下,纯重水的 C、该温度下,1 L含0.01 mol DCl的重水溶液,其pD=2 D、该温度下,在100 mL的DCl重水溶液中,加入100 mL NaOD的重水溶液,充分反应后溶液的pD=13(忽略溶液体积的变化)
-
16、是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:。下列说法不正确的是A、发生还原反应 B、在反应中被氧化 C、的氧化性强于 D、生成时,反应转移了电子
-
17、在一定条件下的密闭容器中发生反应: , 当达到平衡时,下列各项措施,不能提高转化率的是A、升高反应的温度 B、增大容器的容积 C、恒容下通入稀有气体 D、分离出部分
-
18、化合物H是合成某一天然产物的重要中间体,其合成路线如下:

已知:
 。
。回答下列问题:
(1)、化合物C的官能团名称是。(2)、化合物A的结构简式是。(3)、下列说法不正确的是。A.联氨的碱性弱于化合物A
B.化合物H与足量氢气充分加成后,每个分子中存在3个手性碳原子
C.化合物B→C的转化过程中,试剂作氧化剂
D.化合物E中,氨基的反应活性:
E.化合物E→F的转化过程中,试剂起到保护氨基的作用
(4)、化合物D→E的转化过程中两种产物均含两个六元环,写出转化的化学方程式。(5)、有机物X( )是一种医药中间体,设计以苯乙烯(
)是一种医药中间体,设计以苯乙烯( )和光气为原料合成有机物X的路线(用流程图表示,无机试剂任选)。 (6)、写出4种同时符合下列条件的化合物E的同分异构体的结构简式。
)和光气为原料合成有机物X的路线(用流程图表示,无机试剂任选)。 (6)、写出4种同时符合下列条件的化合物E的同分异构体的结构简式。①谱和R谱检测表明:分子中共有5种氢原子;
②除了苯环外无其他环,可以发生银镜反应
-
19、
“碳循环”是指碳元素在地球上的生物圈、岩石圈、水圈及大气圈中交换,并随地球的运动循环不止的现象。请回答:
I.通过捕捉工业废气中的 , 再将其合成甲醇,这种甲醇被称为零碳燃料。其合成甲醇的反应为:
(1)该反应正反应活化能比逆反应活化能(填“大”、“小”或“无法确定”),理由是。
(2)一定温度下,向恒容密闭容器中通入和 , 初始压强为 , 体系达到平衡状态时的体积分数为20%。
①下列说法正确的是。
A.平衡时,气体的转化率为80%
B.升高体系温度,导致正反应速率减小,逆反应速率增大
C.当混合气体的密度保持不变时,无法说明反应已达到平衡状态
D.为提高甲醇的产率与反应速率,可通过选择性分离膜不断分离甲醇来实现
②对于气体参与的反应表示平衡常数时用气体组分的平衡压强代替该气体物质的量浓度。在温度下,合成甲醇反应的平衡常数。
Ⅱ.“碳循环”在一定程度上推动了“氮循环”。其中铵盐是一类重要的含氮化合物,应用广泛。如可用作净水剂、食品添加剂;用于定量分析医药和电子产业中。
(3)在下,溶液中溶液中 , 则ab(填“>”、“<”或“=”)。
(4)如图是的几种电解质溶液的随温度变化的曲线。在下,溶液中(填准确值)

-
20、矿物资源的综合利用有多种方法,硅镀钇矿是一种含钇族稀土元素和氧化铍为主的主要矿物,该矿石中含稀土元素约35%,含氧化铍约5%,如图是利用硅铍钇矿生产氧化铍与稀土产品的转化过程:

已知:过程I中未有电子转移,且物质X由多种氧化物混合而成。请回答:
(1)、写出物质X中的所有氧化物(填化学式);步骤III中,加入的作用是。步骤II中存在氧化还原过程,设计实验验证含铍溶液中的阳离子(除以外)。(2)、已知:铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。下列说法不正确的是_______。A、是两性氢氧化物,能与强酸、强碱反应 B、沸点低于相似结构的 C、为得到无水 , 可通过与混合并加热制得 D、的第一电离能大于B的第一电离能的主要原因是电子排布为半充满,较为稳定(3)、某化学科研工作者对复盐沉淀进行精密分析,最终确认其化学式为。①向复盐沉淀中加入溶液生成 , 写出该反应的化学方程式。
②检验氢氧化钇是否洗涤干净的操作方法为。