-
1、
碱式氯化铜是重要的无机杀菌剂,难溶于水,溶于稀酸和氨水。
Ⅰ.碱式氯化铜制备:
向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70∼80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器a的名称________;仪器b的作用为导气和________。
(2)下列说法错误的是__________。
A. 可用pH计测定装置B中溶液的pH以达到实验要求 B. 装置C是利用浓硫酸和浓盐酸混合来制备HCl气体 C. 增加氨气用量可提高碱式氯化铜产量 D. 反应结束后将反应液静置、过滤、洗涤可得产品 Ⅱ.利用滴定原理进行无水碱式氯化铜[Cux(OH)yClz]组成测定:称取产品4.290 g,加硝酸溶解,并加水定容至250 mL,得到待测溶液。
(3)铜的测定:取25.00 mL待测溶液,经测定,Cu2+浓度为0.1600 mol·L-1。则称取的样品中n(Cu2+)为________mol。
(4)采用沉淀滴定法测定氯:将待测溶液pH调整到6.7~10.5,完全沉淀Cu2+后,用AgNO3标准溶液滴定Cl-。已知:
难溶电解质
AgCl(白色)
AgBr(浅黄色)
Ag2CrO4(红色)
溶度积常数Ksp
1.8×10-10
15.4×10-13
1.1×10-12
①从下列选项中选择合适的操作补全测定步骤________。
检漏、水洗→( )→装入标准溶液、赶气泡、调液面、读数→准确移取25.00 mL待测溶液加入锥形瓶→( )→用0.1000 mol·L-1 AgNO3标准溶液滴定→接近终点时,改为半滴滴定,到达滴定终点→读数。

a.滴定管甲 b.滴定管乙
c.润洗,从滴定管上口倒出液体 d.润洗,从滴定管尖嘴放出液体
e.滴加指示剂K2CrO4溶液 f.滴加指示剂KBr溶液
②如果指示剂加入量偏多,会导致所测含氯量________(填“偏高”“偏低”或“无影响”)。
③三次滴定消耗AgNO3标准溶液的平均体积为20.00 mL,可推知该无水碱式氯化铜的化学式为________。
-
2、硒是人体必需元素之一,在工业上也具有广泛应用。(1)、硒酸(H2SeO4)是一种强酸,在水溶液中,只有第一步的电离是完全的,第二步电离并不完全:、 , 据此回答:
①25℃时,K2SeO4溶液显(填“弱酸性”“弱碱性”或“中性”)。
②在0.100 mol·L-1的硒酸溶液中,c(H+)=0.110 mol·L-1 , 则硒酸的第二步电离平衡常数K约为(保留两位有效数字)。
③向NaClO溶液中滴加少量硒酸,离子方程式为。
(2)、常温下,H2Se的电离平衡常数为Ka1=1.3×10-4 , Ka2=10-11 , 据此回答:①常温下,0.100 mol·L-1的Na2Se溶液的pH约为。
②已知常温下CuSe的Ksp=8×10-49 , CuCO3的Ksp=1.6×10-10;常温下能不能实现CuCO3向CuSe的一步转化,理由是。
-
3、回答下列问题。(1)、明矾[化学式为KAl(SO4)2·12H2O]溶液中c(H+)c(OH-)(填“>”“<”或“=”),原因是(用离子方程式表示)。(2)、已知热化学方程式: △H,则△H=0(填“>”“<”或“=”)。(3)、科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
则甲烷直接将NO2还原为N2的热化学方程式为。
(4)、已知某金属氧化物催化丙烷脱氢过程中,部分反应进程如右图,则X(g)→Y(g)过程中的焓变为(列式表示)。
-
4、甲醇是一种重要的化工原料,工业上使用水煤气(CO和H2的混合气体)合成甲醇,反应方程式为:;在一恒容密闭容器中,充入2 mol的CO和6 mol的H2发生上述反应,CO的平衡转化率与温度、压强的关系如图所示。
 (1)、请判断大小关系:pApC。(2)、A点时刻,若此时容器体积为2L,则KA=。(3)、下列叙述能说明上述反应达到化学平衡状态的是__________。A、混合气体的密度不再改变 B、v(CO)=v(CH3OH) C、混合气体的平均相对分子质量保持不变 D、H2的体积分数保持不变(4)、当反应温度为T1时,以不同于上述比例投料,测得某一时刻各物质的浓度如下:c(CO)=2 mol·L-1 , c(H2)=2 mol·L-1 , c(CH3OH)=1 mol·L-1 , 判断此时反应(填“正向进行”“逆向进行”或“达到平衡状态”)。(5)、对于全部都是气体参与的反应,我们也可以用标准平衡常数Kp(用气体平衡分压代替气体平衡浓度,分压=总压×气体的物质的量分数),若C点的压强恒定为p,则此时Kp=。
(1)、请判断大小关系:pApC。(2)、A点时刻,若此时容器体积为2L,则KA=。(3)、下列叙述能说明上述反应达到化学平衡状态的是__________。A、混合气体的密度不再改变 B、v(CO)=v(CH3OH) C、混合气体的平均相对分子质量保持不变 D、H2的体积分数保持不变(4)、当反应温度为T1时,以不同于上述比例投料,测得某一时刻各物质的浓度如下:c(CO)=2 mol·L-1 , c(H2)=2 mol·L-1 , c(CH3OH)=1 mol·L-1 , 判断此时反应(填“正向进行”“逆向进行”或“达到平衡状态”)。(5)、对于全部都是气体参与的反应,我们也可以用标准平衡常数Kp(用气体平衡分压代替气体平衡浓度,分压=总压×气体的物质的量分数),若C点的压强恒定为p,则此时Kp=。 -
5、已知磷酸二氢钾(KH2PO4)可用作高磷钾复合肥料,已知25℃时,Ka1(H3PO4)=6.9×10-3 , Ka2(H3PO4)=6.2×10-8 , Ka3(H3PO4)=4.8×10-13。下列关于0.1 mol·L-1 KH2PO4溶液的说法正确的是A、溶液中: B、溶液中存在: C、该溶液中: D、该温度下反应的化学平衡常数约为6.9×1011
-
6、关于化工生产原理的描述中正确的是A、电解精炼铜时,负极反应式: B、氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气 C、在氯碱工业中,电解池中的阴极产生的是H2 , NaOH在阳极附近产生 D、电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
-
7、工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。
在C和O2的反应体系中:
反应1:
反应2:
反应3:
设 , 反应1、2和3的y随温度的变化关系如图所示。下列说法不正确的是
 A、图中对应反应3的线条是c B、ΔH1为-394 kJ·mol-1 C、反应1可以自发进行 D、推动反应2在该条件下自发进行的主要因素是反应的焓变
A、图中对应反应3的线条是c B、ΔH1为-394 kJ·mol-1 C、反应1可以自发进行 D、推动反应2在该条件下自发进行的主要因素是反应的焓变 -
8、下列说法不能用勒夏特列原理解释的是A、氯水中有平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 B、对CO(g)+NO2(g)CO2(g)+NO(g),平衡体系增大压强可使颜色变深 C、配制Fe2(SO4)3溶液时,需要加入少量稀硫酸 D、高压比常压条件更有利于合成氨的反应
-
9、向A、B两试管中加入等量H2O2溶液,然后再向B中滴入几滴FeCl3溶液,其反应历程如图:

I.H2O2+2Fe3+=2Fe2++2H++O2↑
II.H2O2+2Fe2++2H+=2Fe3++2H2O
下列说法不正确的是
A、曲线②是滴加了FeCl3溶液的反应过程,Fe3+改变了H2O2分解反应的历程 B、Fe3+是催化剂;Fe2+是中间产物 C、E1、E2分别是反应I、II的活化能,反应I的速率大于反应II的速率 D、催化剂能降低反应的活化能,提高反应物分子中活化分子百分数 -
10、中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如图:

下列说法正确的是
A、过程Ⅰ、过程Ⅲ均为放热过程 B、图示过程中的H2O均参与了反应过程 C、使用催化剂降低了水煤气变换反应的ΔH D、过程Ⅲ只生成了H2O、O2 -
11、某化学小组欲探究不同条件对化学反应速率的影响,分组进行了如下实验。已知:(30℃及以下,双氧水具有较好的稳定性;忽略溶液体积变化)下列说法不正确的是
编号
0.1 mol·L-1酸性KMnO4溶液体积/mL
1 mol·L-1 H2O2溶液体积/mL
水的体积/mL
反应温度/℃
紫色褪去所用的时间/s
Ⅰ
20
20
0
20
t1
Ⅱ
20
V1
10
20
t2
Ⅲ
20
V2
0
30
t3
Ⅳ
20
10
10
30
t4
A、V1=10,V2=20 B、各组实验充分反应后,产生的氧气的体积均为0.112 L(标准状况下) C、实验Ⅰ和Ⅲ、Ⅱ和Ⅳ均可探究温度对反应速率的影响 D、t1<t4 , 说明浓度越大,反应速率越快 -
12、下列物质属于弱电解质的是A、蔗糖 B、CH3COOH C、BaSO4 D、Cu
-
13、已知下列热化学方程式:
①
②
③
则反应的(单位:kJ·mol-1)为
A、 B、 C、 D、 -
14、下列有关反应热的描述中正确的是A、S(g)+O2(g)=SO2(g) ΔH1 , S(s)+O2(g)=SO2(g) ΔH2 , 则ΔH1<ΔH2 B、H2的燃烧热为285.8kJ•mol-1 , 则H2燃烧的热化学方程式可表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ•mol-1 C、H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1 , 则NaOH稀溶液与CH3COOH稀溶液反应生成1molH2O(l)时放出的热量为57.3kJ D、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ•mol-1 , 则反应物的总能量小于生成物的总能量
-
15、以熔融盐为电解液,以含和等的铝合金废料为阳极进行电解,实现的再生。该过程中A、阴极发生的反应为 B、阴极上被氧化 C、在电解槽底部产生含的阳极泥 D、阳极和阴极的质量变化相等
-
16、
电解食盐水可以制备烧碱、次氯酸钠消毒液等。
【用途一】制备烧碱
(1)离子交换膜法电解饱和食盐水原理示意图如图1。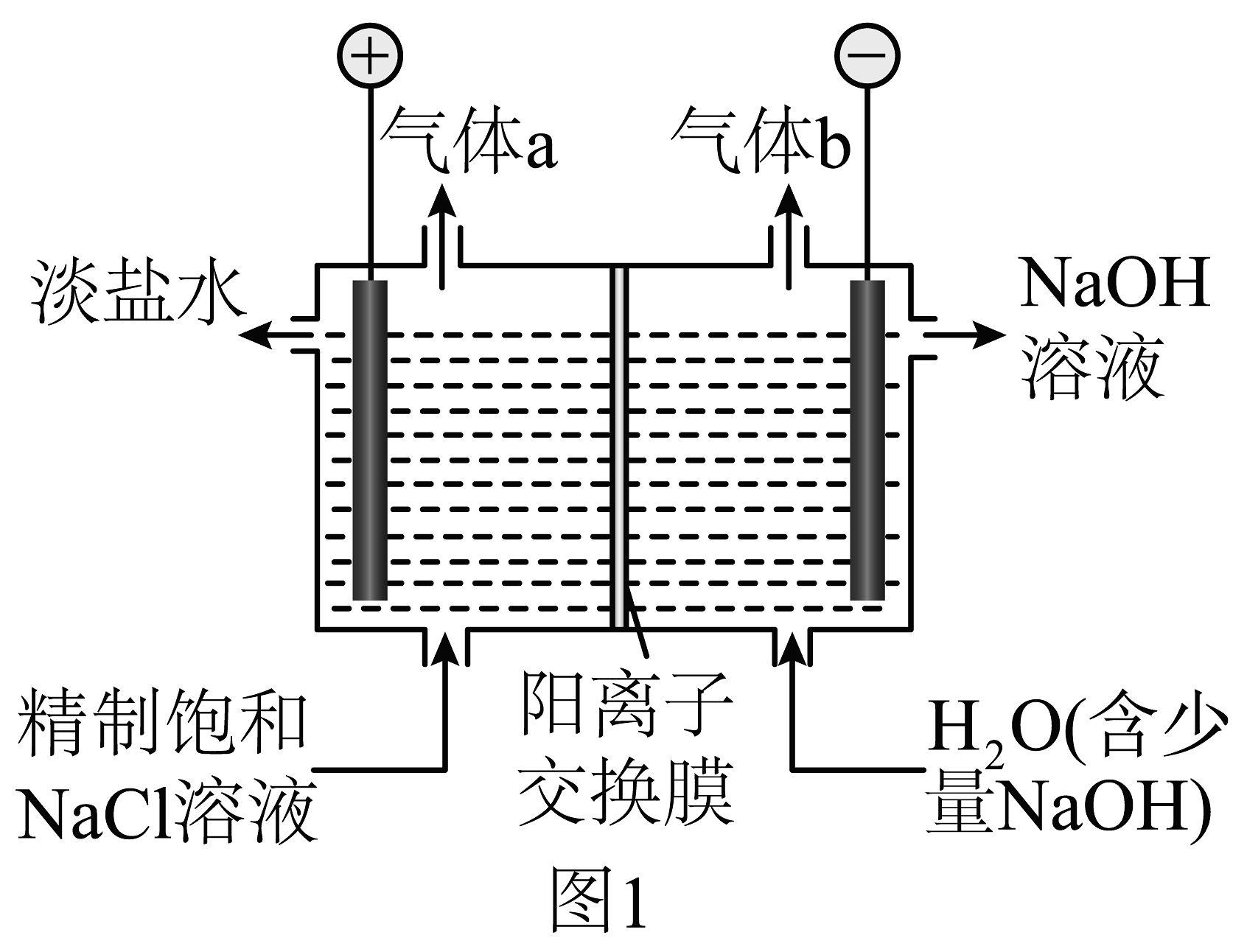
①气体a的电子式为:。
②结合电极反应式解释阴极区得到溶液的原因。
【用途二】制备次氯酸钠溶液
采用无隔膜电解槽,电解3%~5%的溶液,可制备溶液。控制较低温度,适宜电压电解制备溶液原理示意图如图2。
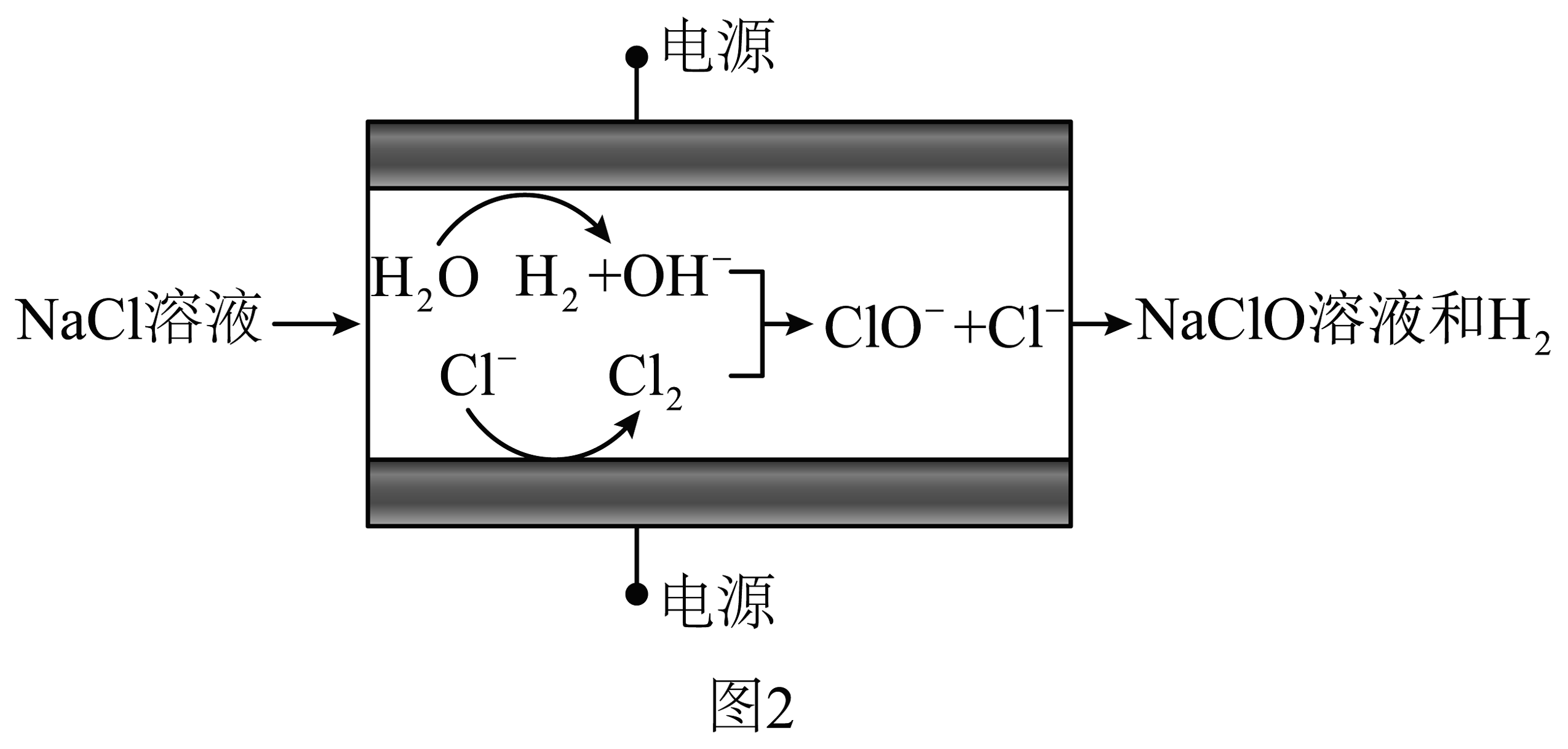
已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
(2)电解食盐水制备溶液总反应的化学方程式为。(3)研究发现,电解制备溶液时,中性溶液为宜,若初始过高()或过低()都会降低的浓度。分析可能原因:①过高,阳极会发生放电,导致电解效率降低,电极反应为。
②过低,产生影响的可能原因:
假设过低时,导致溶解度 , 生成的减少。
假设过低时,浓度增大氧化 , 生成和。
I.查阅文献,假设b成立。相应反应的离子方程式为。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液,。可供选择的试剂和仪器:a.稀硫酸 b.稀盐酸 c.石蕊溶液 d.计
-
17、
铅酸蓄电池(如图)的电压稳定、使用方便、安全可靠、价格低廉而使用广泛。
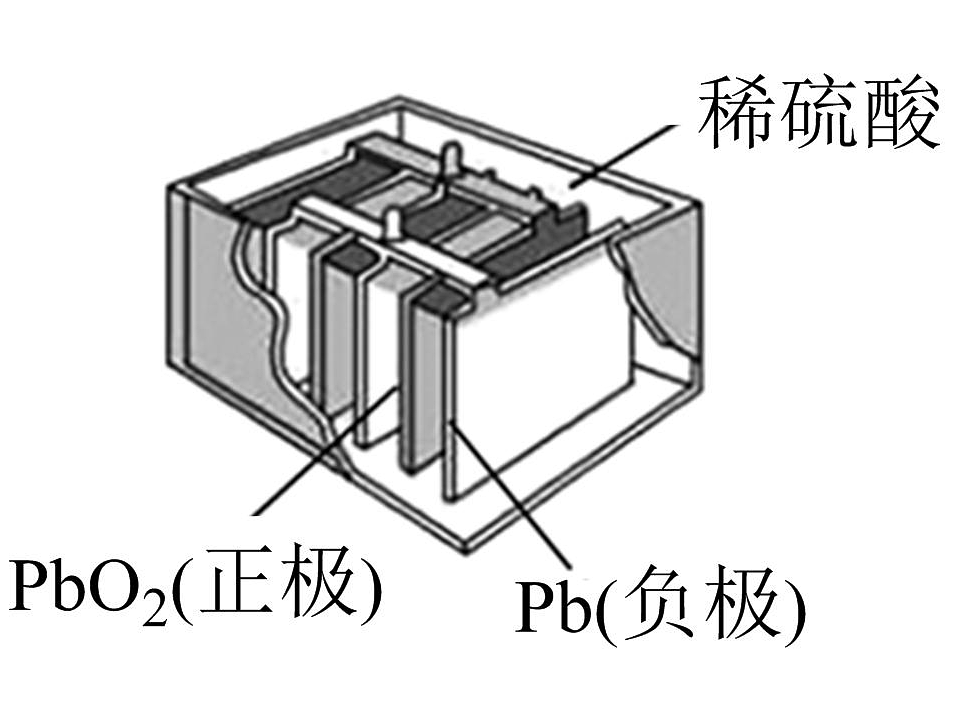
I.
(1)写出电池使用过程中的两个电极反应方程式:负极; 正极。
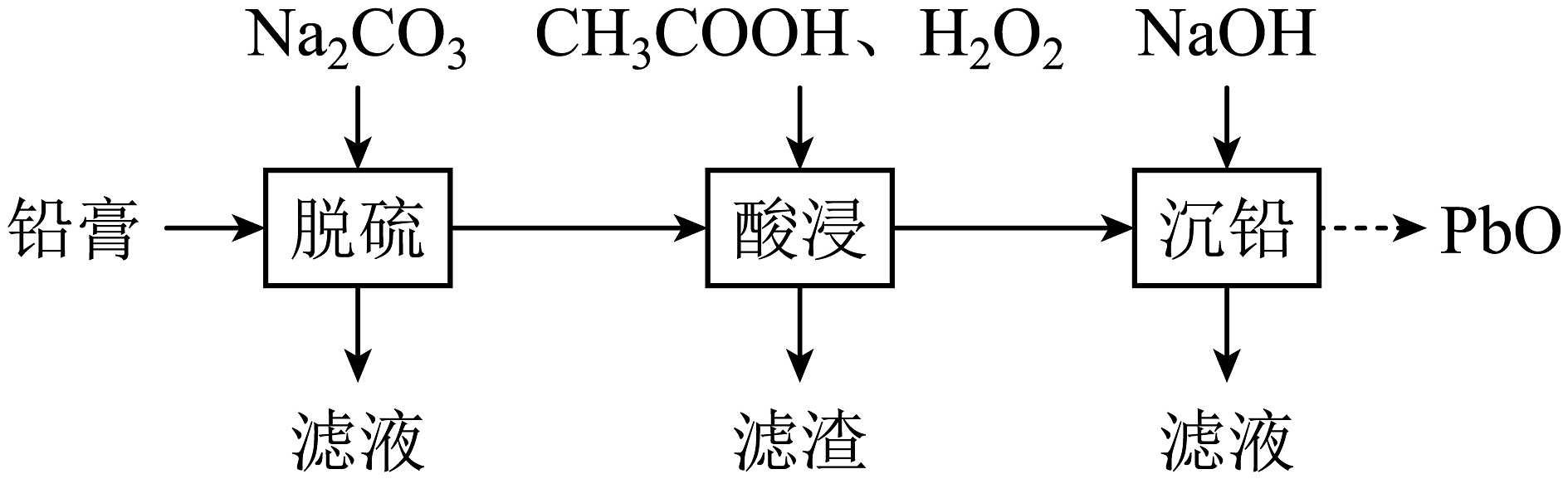
II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、、PbO和Pb,还有少量、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH
2.3
6.8
3.5
7.2
完全沉淀的pH
3.2
8.3
4.6
9.1
回答下列问题:
(2)在“脱硫”中转化反应的离子方程式为;饱和溶液中。(3)在“脱硫”中,加入不能使铅膏中完全转化,原因是。(4)在“酸浸”中,除加入醋酸(),还要加入。①能被氧化的离子是;
②促进了金属Pb在醋酸中转化为 , 其化学方程式为。
③也能使转化为 , 的作用是。
(5)“酸浸”后溶液的pH应控制在(填范围),滤渣的主要成分是(填化学式)。 -
18、
探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:
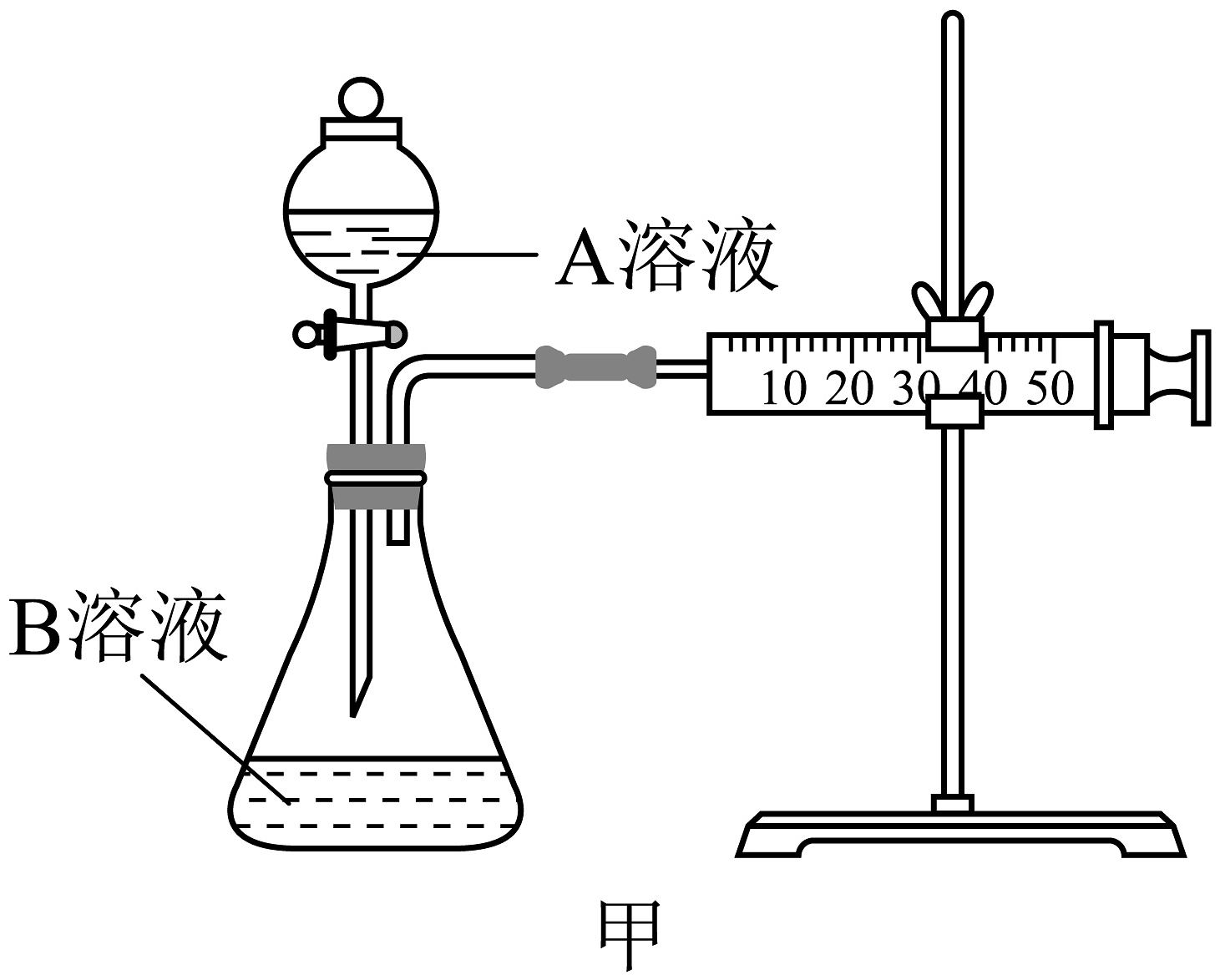
实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
(1)完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。(2)若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①该反应是放热反应:②。
Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:
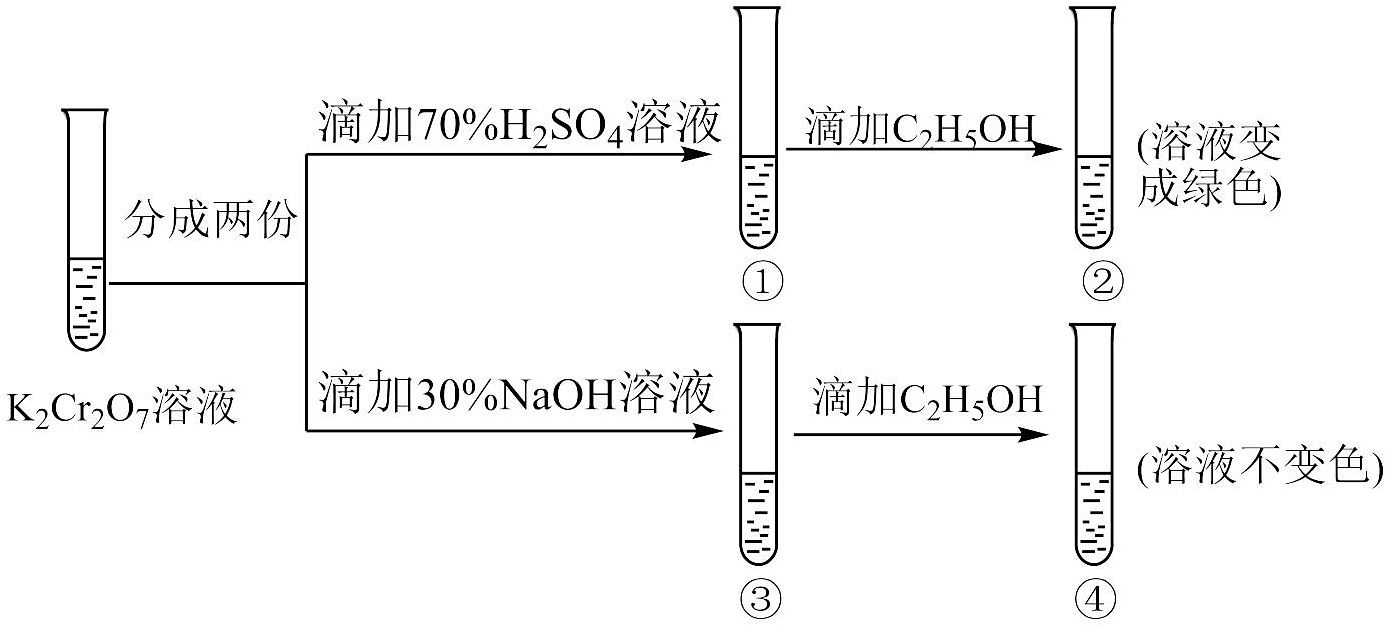 (4)向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
(4)向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。 -
19、硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中,制取的反应为 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
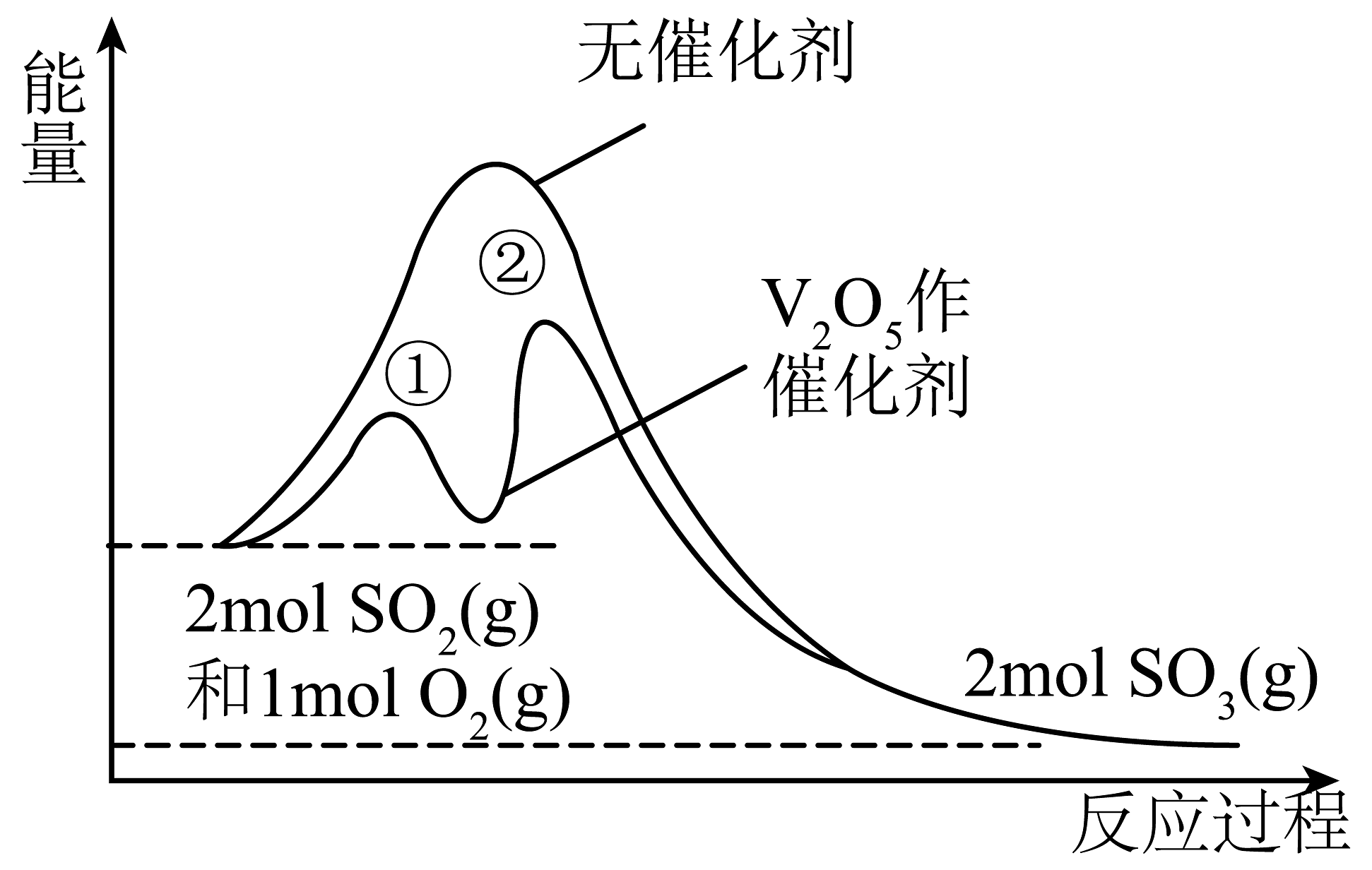 A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、
A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、 -
20、游泳池水普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示,其中钌钛用作析氯电极,不参与电解。除尿素的反应为: , 下列说法正确的是
 A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近增大 D、电解过程中每逸出 , 电路中至少通过电子
A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近增大 D、电解过程中每逸出 , 电路中至少通过电子