-
1、下列实验操作能达到实验目的是




①
②
③
④
A、在配制一定物质的量浓度的氯化钠溶液的实验步骤中,操作①是定容 B、使用操作②是测氯水的值 C、可以利用装置③做钠的燃烧实验 D、将装置④大头针抽出后,可以检验钠与水反应的产物 -
2、食品包装盒内有小袋,内装灰黑色粉末,部分变红褐色。将该粉末溶于稀盐酸,取上层清液,滴入溶液无明显现象,滴加氯水后变红。下列叙述不正确的是A、该灰黑色粉末原来可能是铁粉 B、食品包装盒内小袋的作用是抗氧化 C、在该检测中,氯水可以使用高锰酸钾溶液替代 D、滴加氯水后溶液变红,使溶液变红的物质是硫氰化铁
-
3、关于氯元素的单质及其化合物的描述,正确的是A、红热的铜丝在氯气中剧烈燃烧,生成蓝色的烟 B、纯净的在中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色的烟 C、氯水滴在有色布条上,一会儿有色布条褪色,说明有漂白性 D、氯水不稳定难以长期保存,人们将其制成更稳定的、等次氯酸盐
-
4、关于钠元素的单质及其化合物的叙述不正确的是A、钠的性质活泼,燃烧能产生白色的过氧化钠 B、与氢氧化钠水溶液反应放出氧气 C、钠长期露置在空气中最终会生成碳酸钠粉末 D、当碳酸钠与少量水混合时,有放热现象;当碳酸氢钠与少量水混合时,有吸热现象
-
5、下列颜色变化不属于化学变化的是A、黄色的铜质硬币产生绿斑 B、新切割的金属钠,其银白色的表面迅速变得灰暗 C、灼烧氯化钠固体时产生黄色火焰 D、新制的浅黄绿色氯水久置后变为无色
-
6、下列对某些概念的理解和判断正确的是A、电解质是在水溶液或者熔融条件下可以发生电离的化合物 B、能与水反应生成碱的氧化物,一定是碱性氧化物 C、胶体和其它分散系的本质区别是能发生丁达尔效应 D、单位物质的量的气体,在标准状况下所占据的体积,即为气体的摩尔体积
-
7、下列离子方程式正确的是A、与水溶液反应: B、酸性氯化亚铁溶液中加入双氧水: C、碳酸银可溶于稀硝酸: D、氢氧化钠溶液与碳酸氢钠溶液反应:
-
8、下列透明溶液中,能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
9、下列变化需要加入还原剂才能实现的是A、 B、 C、 D、
-
10、下列关于化学家及其贡献的说法不正确的是A、波义耳提出元素的概念 B、阿伦尼乌斯提出了电离模型 C、拉瓦锡提出燃烧的氧化学说 D、舍勒发现并命名了氯气
-
11、下列工业制备中,所使用的原料及其转化关系正确的是A、制漂白粉:石灰水漂白粉 B、制备金属钠:溶液 C、生产盐酸: D、印刷电路板:
-
12、化学与生活密切相关,下列应用中利用了物质氧化性的是A、氢氧化铁胶体净水 B、氧化铁作油漆、涂料等的红色颜料 C、生石灰用作雪饼的干燥剂 D、漂白液漂白织物
-
13、下列反应不属于四大基本反应类型的是A、 B、 C、 D、
-
14、下列物质在水中的电离方程式,书写正确的是A、 B、 C、 D、
-
15、下列物质属于电解质的是A、铜丝 B、熔融的 C、酒精 D、溶液
-
16、当光束通过下列物质时,不会出现丁达尔效应的分散系是A、硫酸铜溶液 B、蒸馏水 C、云、雾 D、有色玻璃
-
17、下列与实验有关的图标及其说明不正确的是




A.排风
B.腐蚀
C.热烫
D.护目镜
A、A B、B C、C D、D -
18、下列仪器名称不正确的是




A.坩埚
B.泥三角
C.封液漏斗
D.集气瓶
A、A B、B C、C D、D -
19、下列俗名对应的物质类别与其它不同的是A、小苏打 B、纯碱 C、胆矾 D、烧碱
-
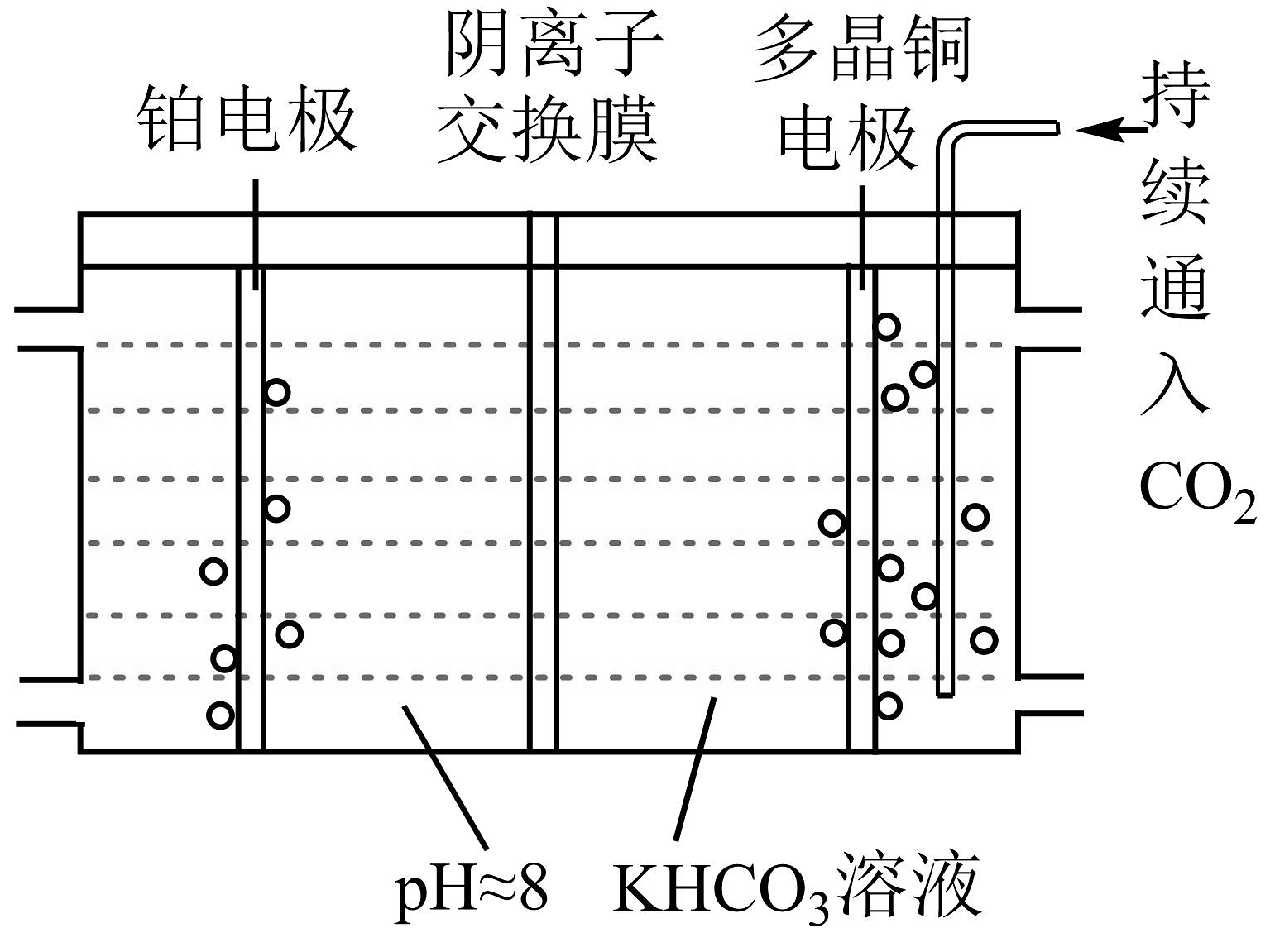
20、甲醇是重要的化工基础原料,以CO2为原料制甲醇具有重要的社会价值。(1)、电化学法制甲醇。工业上采用如图所示装置电解制备甲醇,反应前后KHCO3浓度基本保持不变,生成CH3OH的电极反应式为。
 (2)、CO2催化加氢制甲醇。CO2催化加氢制甲醇过程中的主要反应为
(2)、CO2催化加氢制甲醇。CO2催化加氢制甲醇过程中的主要反应为反应Ⅰ:CO2(g)+3H2(g)=CH3OHg)+H2O(g) △H=—49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ/mol
在恒压、n(CO2):n(H2)投料比为1:3时,CO2平衡转化率和CH3OH平衡选择性随温度的变化如题图所示。[CH3OH选择性=×100%]
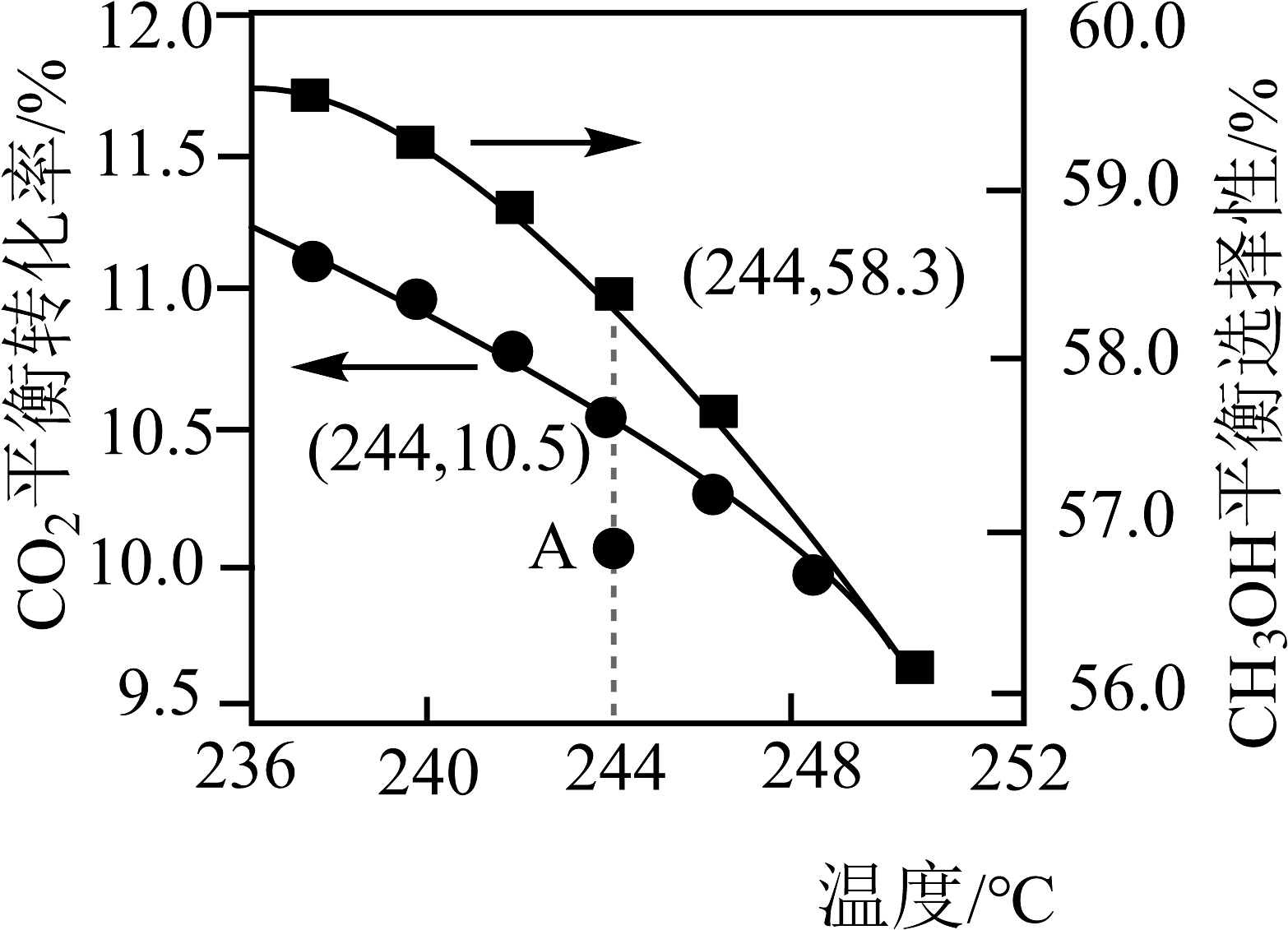
①236~250℃范围内,CO2平衡转化率随温度升高而下降的原因是。
②244℃时,反应一段时间后,测得CH3OH选择性为56.8%(图中A点),不改变反应时间和温度,一定能提高CH3OH选择性的措施有。
③244℃时,向密闭容器内投入1molCO2和3molH2充分反应,则平衡时生成CH3OH的物质的量为mol(保留小数点后4位)。
④已知反应Ⅱ的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关),若平衡后升高温度,则(填“增大”、“不变”或“减小”)。
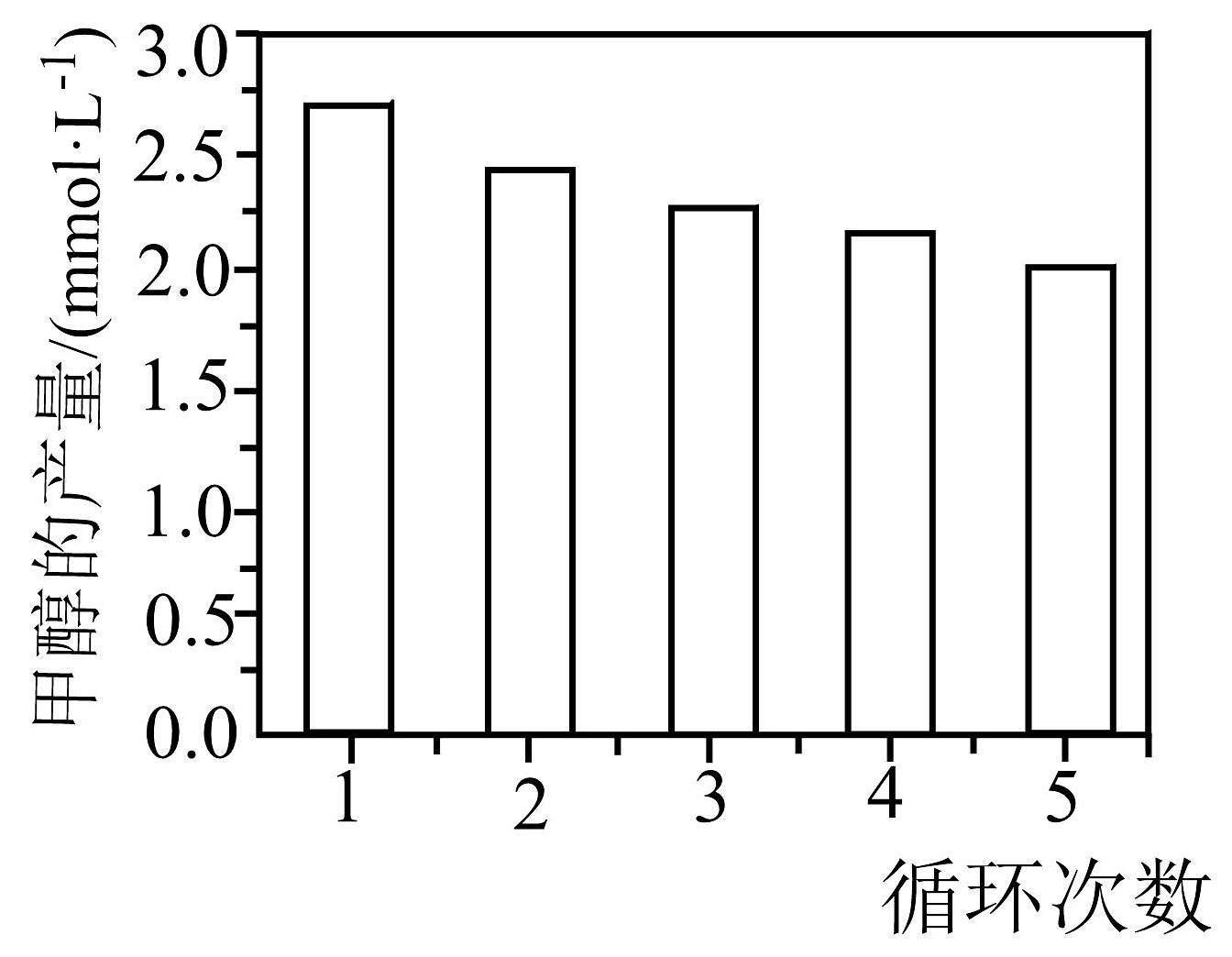
(3)、CO2加氢制甲醇催化剂的研究。用Co-C作催化剂,可得到含少量甲酸的甲醇,相同条件下,将催化剂循环使用,甲醇产量与催化剂循环次数的关系如图所示,甲醇产量随循环次数增加而减小的原因可能是。