相关试卷
-
1、金秋九月,全国多地水稻喜迎丰收,稻浪飘香。能闻到稻香是因为A、分子在不断地运动 B、分子的体积很小 C、分子之间有间隔 D、分子可以分为原子
-
2、下列有关试管的实验操作中,正确的是A、
 取用块状试剂
B、
取用块状试剂
B、 夹持试管
C、
夹持试管
C、 取用液体试剂
D、
取用液体试剂
D、 洗涤试管
洗涤试管
-
3、以氢气(H2)和氮(N2)为原料合成氨(NH3)是化学工业最伟大的发明,对人类的发展有着重要的贡献,合成氨的流程可表示如图,请结合所学知识回答有关问题:
 (1)、焦炭与水蒸气反应时要对焦炭进行粉碎,目的是 。(2)、氨气加压降温后可转化成液态,从微观粒子角度分析原因是。(3)、合成氨反应的化学方程式是 , 若要制备34t氨气,则需要多少吨氮气?(请写出计算过程)(4)、在流程图中可循环利用的物质是 。
(1)、焦炭与水蒸气反应时要对焦炭进行粉碎,目的是 。(2)、氨气加压降温后可转化成液态,从微观粒子角度分析原因是。(3)、合成氨反应的化学方程式是 , 若要制备34t氨气,则需要多少吨氮气?(请写出计算过程)(4)、在流程图中可循环利用的物质是 。 -
4、【基础实验和跨学科实践】(1)、CO2的制取及性质
ⅰ.制取CO2
实验室在常温下制备二氧化碳,反应该选择的发生和收集装置是 (填字母)。

ⅱ.性质实验
操作
现象
性质及方程式

X为澄清石灰水时,现象为
CO2能与石灰水反应化学方程式为
X为紫色石蕊溶液时,现象为
CO2能与水反应生成酸性物质

低处的蜡烛先熄灭,高处的蜡烛后熄灭
;CO2不燃烧,也不支持燃烧
(2)、低碳行动方案同学们展示如图所示的方案,并交流讨论、完善方案。

ⅰ.完善方案中的内容(各补写一条):a ;b ;c 。
ii.二氧化碳的封存方式包括生物封存、地质封存、海洋封存等,用海洋封存二氧化碳时,部分二氧化碳被海水吸收,有关反应的化学方程式为。
-
5、【科普阅读】
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥气味,不稳定,一旦受热极易转化成氧气,并放出大量的热。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。生产中大量使用的臭氧通常由以下方法制得。

臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,可杀灭一切微生物,包括细菌、病毒、芽孢等,而臭氧很快转化为氧气,无二次污染,高效环保。
依据文章内容回答下列问题。
(1)、臭氧的物理性质有(写出一条)。(2)、臭氧处理饮用水时,发生了 (填“物理”或“化学”)变化。(3)、将带火星的木条伸入到盛有臭氧的集气瓶中,可以看到的现象。(4)、臭氧转化为氧气的微观示意图如下,请在方框中补全相应微粒的图示。
在此过程中,下列不会发生变化的是(填序号)。
A.元素种类 B.分子种类 C.原子质量 D.分子数目
(5)、臭氧和氧气的组成元素相同,但化学性质差异大的原因是。(6)、下列关于臭氧的说法中,错误的是 。(填序号)A、臭氧的漂白作用比氯气强 B、由氧气制得臭氧的过程中,既有物理变化也有化学变化 C、臭氧在生产生活中有很多用途,对人类有益无害,不是空气污染物 D、臭氧稳定性差,不利于储存,其应用可能会受到限制 -
6、炉甘石始载于《外丹本草》,主要成分为碳酸锌(ZnCO3)和碱式碳酸锌,炮制后主要成分为氧化锌,可作为外用药使用。
 (1)、碳酸锌中锌的化合价为。(2)、碳酸锌中碳、氧元素的原子个数比为 , 质量比为 。(3)、氧化锌、碳酸锌、碱式碳酸锌都有一定的抑菌活性,说明起抑菌作用的有效成分可能是 (填字母,下同)。
(1)、碳酸锌中锌的化合价为。(2)、碳酸锌中碳、氧元素的原子个数比为 , 质量比为 。(3)、氧化锌、碳酸锌、碱式碳酸锌都有一定的抑菌活性,说明起抑菌作用的有效成分可能是 (填字母,下同)。a.锌分子 b.锌元素 c.锌单质
(4)、如图为锌元素的信息,下列说法错误的是。a.锌原子的质量为65.38g b.锌的原子序数为30
c.锌在元素周期表位于第四周期 d.锌原子在反应中易失去电子
(5)、药效高低与有效成分的含量相关。碳酸锌的抑菌活性低于相同质量的氧化锌,可能的原因是。 -
7、能正确反映对应变化关系的图像是




A.过氧化氢分解制备氧气
B.电解水实验
C.密闭条件下加热铜粉
D.高锰酸钾受热分解
A、A B、B C、C D、D -
8、一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是
 A、x的值是31 B、该反应为化合反应 C、丙物质可能是该反应的催化剂 D、反应中消耗甲和乙的质量比为13:16
A、x的值是31 B、该反应为化合反应 C、丙物质可能是该反应的催化剂 D、反应中消耗甲和乙的质量比为13:16 -
9、锌锰电池中用到石墨、二氧化锰、锌筒等,发生了如下的反应2MnO2+Zn+2H2O═2MnOOH+Zn(OH)2 , 下列说法正确的是A、MnO2在锌锰电池中作为催化剂 B、石墨和锌筒都是由原子构成的 C、锌锰电池体现了碳棒具有导热性 D、MnO2、Zn、MnOOH、Zn(OH)2其中属于氧化物的有3种
-
10、归纳是学习化学常用的方法,下列知识归纳完全正确的是
A、性质与用途
B、化学实验数据记录
①氧气能支持燃烧——作燃料
②氮气化学性质稳定——作保护气
①用10mL量筒量取7.2mL水
②用托盘天平称取5.65g铁粉
C、化学巨匠及贡献
D、分子、原子、离子
①门捷列夫—元素周期表
②张青莲—相对原子质量的测定做出卓越贡献
①氯化钠由离子构成的
②分子是化学变化中的最小微粒
A、A B、B C、C D、D -
11、建立模型是学习化学的重要方法,下列模型中正确的一项是A、
 物质的分类
B、
物质的分类
B、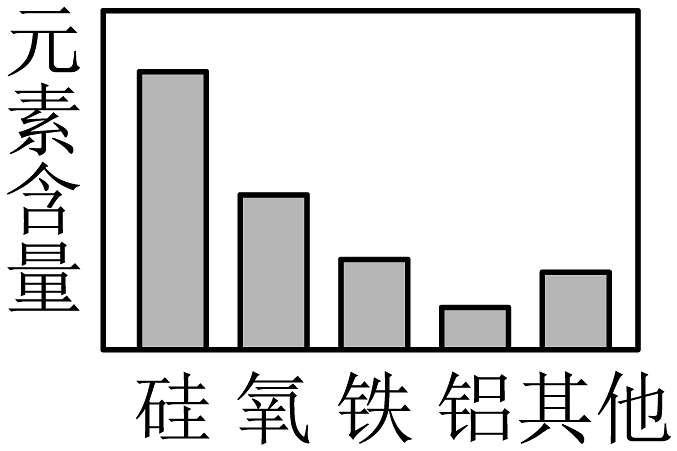 地壳中元素的含量
C、
地壳中元素的含量
C、 物质的组成和构成
D、
物质的组成和构成
D、 原子结构模型
原子结构模型
-
12、关于氧气性质的实验,下列现象与化学方程式均正确的是
选项
实验名称
实验现象
化学方程式
A
木炭在氧气中燃烧
发出红光
B
铁丝在氧气中燃烧
火星四射,生成黑色固体
C
镁带在空气中燃烧
发出耀眼的白光
D
硫磺在空气中燃烧
蓝紫色火焰,生成刺激性气味气体
A、A B、B C、C D、D -
13、科学家通过“祝融号”火星车探测器测得火星表面大气成分(体积分数)如表所示
气体
二氧化碳
氮气
氩气
体积分数
95
2.7
1.6
与地球大气相比,下列气体含量更高的是
A、二氧化碳和氩气 B、二氧化碳和氮气 C、氮气和氩气 D、氮气 -
14、下列各项中,属于我国《环境空气质量标准》基本检验项目的是A、CO2浓度 B、O2浓度 C、N2浓度 D、浓度
-
15、如图所示的化学实验操作中,正确的是A、
 制取蒸馏水
B、
制取蒸馏水
B、 检查装置气密性
C、
检查装置气密性
C、 氧气验满
D、
氧气验满
D、 过滤
过滤
-
16、化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气。称量68g该过氧化氢溶液和0.1g二氧化锰进行实验,测得液体和二氧化锰的质量随反应时间的变化关系如图所示。请分析并计算:
 (1)、该反应中二氧化锰起作用。(2)、反应制得氧气的质量是g。(3)、计算68g该过氧化氢溶液中过氧化氢的质量。
(1)、该反应中二氧化锰起作用。(2)、反应制得氧气的质量是g。(3)、计算68g该过氧化氢溶液中过氧化氢的质量。 -
17、
二氧化碳是空气的重要组成部分。下面是同学们在实验室制取二氧化碳并验证其性质的实验活动。
【制取二氧化碳】如图是实验室制取气体常用装置,请完成实验步骤、内容与分析。

(1)仪器a的名称是。
(2)在实验室可选用装置(填字母)组合制取并收集二氧化碳,连接仪器后,需。
(3)加入试剂。先往试管内加入 , 然后加入其他试剂,立即用带有导管的胶塞塞住管口。观察到试管内发生的现象为 , 反应的化学方程式为。
固定装置。连接好反应装置,将试管竖直固定在铁架台上。
(4)收集二氧化碳。用向上排空气法收集二氧化碳,将燃着的木条放在集气瓶(填“口”或“内”),火焰熄灭,说明已收集满。收集满二氧化碳的集气瓶盖好玻璃片,(填“正”或“倒”)放在实验台上备用。
【验证二氧化碳性质】
(5)
示意图
活动内容、步骤与分析

①向盛有澄清石灰水的试管中通入二氧化碳,观察到

②将二氧化碳倒入放有燃着蜡烛的烧杯中,观察到
【实验拓展】
(6)实验室里一瓶石灰水中含有氢氧化钙 , 要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,至少需要二氧化碳的质量是。
-
18、用适当的元素符号或元素符号与数字的组合填空:(1)、地壳中含量最高的元素;(2)、2个硫原子;(3)、3个钠离子。
-
19、一定质量的某化合物完全燃烧,消耗9.6g氧气,生成8.8g 二氧化碳和5.4g 水。对该化合物组成判断正确的是A、只含有C、H两种元素 B、含有C、H、О三种元素 C、一定含有C、H两种元素,可能含有氧元素 D、无法计算碳氢原子的个数比
-
20、一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
x
24
3
A、x的值等于0.5 B、甲可能是单质 C、乙可能是催化剂 D、该反应是分解反应