相关试卷
-
1、在硫酸亚铁和硫酸铁的混合物中,硫元素的质量分数为23%,则混合物中铁元素的质量分数为( )A、46% B、31% C、66% D、无法确定
-
2、下列有关说法正确的是A、原子是最小的粒子故不可再分 B、分子能保持物质的化学性质而原子不能 C、由同种元素组成的物质一定是单质 D、不同种元素的本质区别是原子核内质子数不同
-
3、推理是学习化学的一种方法,下列推理正确的是A、离子是带电的微粒,所以带电的微粒一定是离子 B、氧气和臭氧(O3)分子构成不同,所以化学性质不同 C、电解水生成氢气和氧气,所以水是由氢分子和氧分子组成的 D、铁丝在氧气中能够燃烧,空气中有氧气,所以铁丝在空气中一定能够燃烧
-
4、下列说法正确的是A、木材着火,用水扑灭,是因为降低了木材的着火点 B、启用闲置的沼气池,先用燃着的蜡烛进行灯火实验 C、煤气泄漏,应立即关闭阀门并开窗通风 D、带火星的木条一定能在含有氧气的集气瓶中复燃
-
5、分类是化学学习和研究的重要方法之一,下列分类中正确的是A、纯净物:氧气、澄清石灰水、水银 B、混合物:冰水混合物、空气、生铁 C、单质:液氮、铁粉、水 D、氧化物:氧化铁、干冰、生石灰
-
6、为相对原子质量的测定作出卓越贡献的中国科学家是A、张青莲 B、袁隆平 C、侯德榜 D、门捷列夫
-
7、下列变化与其它三种变化有本质不同的是A、酒精挥发 B、海市蜃楼 C、面包发霉 D、活性炭净水
-
8、实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。请计算:
 (1)、生成氧气的总质量为g。(2)、过氧化氢溶液中过氧化氢的质量.
(1)、生成氧气的总质量为g。(2)、过氧化氢溶液中过氧化氢的质量. -
9、同学们用高锰酸钾制氧气,制取结束清洗仪器,发现加热高锰酸钾的试管内壁有用水洗刷不掉的黑色固体。(1)、问题一:黑色固体是什么?
【交流讨论】同学们结合实验现象和对高锰酸钾及其分解产物的了解,进行分析判断。
判断
依据
不是
能溶于水形成紫红色溶液
不是(填化学式)
冲洗试管时出现深绿色溶液,说明该物质能溶于水
是
其他实验用过 , 知道它是不溶于水的黑色固体
【实验验证】向未洗净的试管中加入某种液体,产生能使带火星木条复燃的气体,证明上述判断正确,加入的液体是溶液。
(2)、问题二:用什么洗掉?【交流讨论】与Cu中的某一种物质组成最相近,理由是。这种物质能与稀盐酸反应,由此推测也能与稀盐酸反应。
【实验验证】向未洗净的试管中加入稀盐酸,黑色固体没有变化。
【交流讨论】实验说明同一类物质的化学性质不一定相同。有什么化学性质,用什么试剂清洗呢?同学们请教老师后决定用草酸溶液试一试。
【实验验证】向未洗净的试管中加入草酸溶液,黑色固体果然被除去,同时发现产生许多气泡。
(3)、问题三:生产了什么气体?【交流讨论】化学变化过程中元素种类不变,因为 , 所以产生的气体可能为等。
【反思提高】以上探究活动中,清除试管内壁附着的难溶物的思路是:先 , 再了解其化学性质,然后选择合适试剂进行清洗。
-
10、A~E是初中化学中常见的物质,在一定条件下能发生如图转化。已知A、B均为黑色固体,D为紫红色固体,C、E为气体,且E易与人体血液中血红蛋白结合,使人中毒。

请回答下列问题:
(1)、E是。(填化学式)(2)、反应②中使石蕊溶液变红的物质的化学式。(3)、写出反应①、⑤的化学方程式。(4)、反应④的基本反应类型。(5)、反应③的用途。 -
11、阅读科普短文,回答下列问题:
镁(Mg)是一种年轻的金属,1808年英国化学家戴维用电解法最早制得少量的镁。镁呈银白色,熔点为 , 质轻、密度为。镁的化学性质活泼,能与许多物质发生化学反应,镁在氧气中燃烧生成氧化镁,镁在氮气中燃烧生成氮化镁,镁在二氧化碳中燃烧生成碳和氧化镁。工业上主要利用电解熔融的氯化镁制取金属镁,同时生成氯气。
烟花和照明弹里都含有镁粉,是利用了镁在空气中燃烧能发出耀眼的白光,金属镁与战争有着密切的关系,除照明弹里有镁粉外,燃烧弹里也装有镁粉。飞机的外壳是用耗费近半吨镁的铝镁合金制成的。世界上镁产量最高的年份,往往就是发生战争的年份。因此,镁产量就成了战争的晴雨表和指示剂,人们常把镁称为“国防金属”。
(1)、镁与第17号元素形成的化合物的化学式是。(2)、写出镁在二氧化碳中燃烧的化学方程式。(3)、在测定空气中氧气含量的实验中,不能用镁代替红磷,其原因是。(4)、写出一条金属镁的用途:。 -
12、在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究。某化学兴趣小组设计如下实验装置(天平略)验证质量守恒定律。
 (1)、上述A~C实验装置中,能直接用于验证质量守恒定律的装置是。(2)、利用装置A进行实验,实验过程中气球的作用是。发生反应的化学方程式为。(3)、B装置中观察到的实验现象为。(4)、某同学按C图装置对质量守恒定律进行实验探究,反应前记录称量质量,然后将稀盐酸溶液倒入烧杯中与碳酸钠固体充分反应后,再称量,观察到天平示数(填“变小”或“变大”)。反应后天平示数变化的原因是。(5)、通过对几个实验的分析,你认为有气体参加或有气体生成的化学反应来验证质量守恒定律时,应在装置中进行。(6)、由质量守恒定律可知,化学反应前后,一定不变的是(填4号)。
(1)、上述A~C实验装置中,能直接用于验证质量守恒定律的装置是。(2)、利用装置A进行实验,实验过程中气球的作用是。发生反应的化学方程式为。(3)、B装置中观察到的实验现象为。(4)、某同学按C图装置对质量守恒定律进行实验探究,反应前记录称量质量,然后将稀盐酸溶液倒入烧杯中与碳酸钠固体充分反应后,再称量,观察到天平示数(填“变小”或“变大”)。反应后天平示数变化的原因是。(5)、通过对几个实验的分析,你认为有气体参加或有气体生成的化学反应来验证质量守恒定律时,应在装置中进行。(6)、由质量守恒定律可知,化学反应前后,一定不变的是(填4号)。①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类
-
13、根据如图所示的实验回答问题。
 (1)、甲是实验室利用高锰酸钾制取氧气的实验装置,发生装置有一处不足为。(2)、乙为“比较空气和人体呼出的气体中二氧化碳含量高低”的实验,实验得出的结论是 , 得到该结论依据的现象是。(3)、丙所示的两个实验中集气瓶和锥形瓶内都盛有沙子,两处沙子作用的相同点是。
(1)、甲是实验室利用高锰酸钾制取氧气的实验装置,发生装置有一处不足为。(2)、乙为“比较空气和人体呼出的气体中二氧化碳含量高低”的实验,实验得出的结论是 , 得到该结论依据的现象是。(3)、丙所示的两个实验中集气瓶和锥形瓶内都盛有沙子,两处沙子作用的相同点是。 -
14、以史为鉴,开创未来,沿着先人足迹,进行与水相关的探究。(1)、早期探索:古时候人们将水中的泥土砂砾等沉淀物自然沉降后撇去饮用,后来将水煮沸来净化饮用水。现在人们通常在水中加入、填物质名称)来加速悬浮杂质沉降。(2)、希波克拉底的贡献:公元前5世纪,希波克拉底提出用水通过布来帮助清除淤泥和其他沉积物的概念。这种固液分离的操作能去除水中的杂质。(3)、第一个净水器专利:18世纪中期,约瑟夫艾米获得了第一个净水器的专利,他的设计结合了羊毛、海绵和木炭层来净化饮用水,其中木炭的作用是。(4)、现代技术:基于先进膜分离技术的反渗透、超滤、纳滤,超滤过程如下图所示,通过膜表面的微孔筛选出胶体、颗粒和相对分子质量较高的物质,超滤膜的工作原理类似于实验中的(填操作名称)
 (5)、化学项目小组实践:某化学兴趣小组同学设计如图所示的电解水装置来测定水的组成。实验结束时发现注射器H中滑塞停留在10mL刻度线处,则注射器Ⅰ中活塞停留在刻度线mL处;将注射器Ⅱ接上针头,移向燃着的酒精灯旁,推动活塞,观察到的现象是。
(5)、化学项目小组实践:某化学兴趣小组同学设计如图所示的电解水装置来测定水的组成。实验结束时发现注射器H中滑塞停留在10mL刻度线处,则注射器Ⅰ中活塞停留在刻度线mL处;将注射器Ⅱ接上针头,移向燃着的酒精灯旁,推动活塞,观察到的现象是。 -
15、历史悠久,人文厚重的正定,是石家庄冉冉升起的一颗明珠。请分析图文信息,解答下列相关问题。
 (1)、隆兴寺保存了很多文物,有些文物保存在氮气中,原因是 , 构成氮气的微观粒子是(填化学名称).氮原子的质子数为7,则氮原子的核外电子数为。(2)、隆兴寺内用墨描绘的古画能够保存很长时间不变色这是由于;金刚石和石墨也是由碳原子构成的,但物理性质不同,原因是。(3)、正定城墙的夜景明亮璀璨,多彩如幻的霓虹灯能发出各种颜色的光是利用了稀有气体的性质(选填“物理”,或“化学”)。(4)、滹沱河大桥建设使用了大量钢铁,实验室进行铁在氧气中燃烧实验时,集气瓶炸裂了,原因可能是。
(1)、隆兴寺保存了很多文物,有些文物保存在氮气中,原因是 , 构成氮气的微观粒子是(填化学名称).氮原子的质子数为7,则氮原子的核外电子数为。(2)、隆兴寺内用墨描绘的古画能够保存很长时间不变色这是由于;金刚石和石墨也是由碳原子构成的,但物理性质不同,原因是。(3)、正定城墙的夜景明亮璀璨,多彩如幻的霓虹灯能发出各种颜色的光是利用了稀有气体的性质(选填“物理”,或“化学”)。(4)、滹沱河大桥建设使用了大量钢铁,实验室进行铁在氧气中燃烧实验时,集气瓶炸裂了,原因可能是。 -
16、下列图示中“错误实验操作”与图下面对应的“可能产生的后果”不一致的是A、
 腐蚀胶帽
B、
腐蚀胶帽
B、 引起失火
C、
引起失火
C、 取液偏多
D、
取液偏多
D、 试管破碎
试管破碎
-
17、下列物质中前者属于混合物,后者属于氧化物的是A、冰水混合物、冰 B、煤、氢气 C、稀盐酸、矿泉水 D、石灰水、氧化铝
-
18、回答下列问题:(1)、每千克的食盐中加入0.06~0.08g的碘酸钾(KIO3),可以有效防治碘缺乏症。加碘食盐属于(填“混合物或纯净物”),缺碘易导致疾病。(2)、尿素是一种农业上常用的高效氮肥,它的化学式为CO(NH2)2。
①尿素CO(NH2)2是由种元素组成的化合物。
②市售尿素中,CO(NH2)2含量在96%以上为达标一级品。某化工公司生产的尿素外包装标签如图所示,该尿素是否为一级品。(通过计算过程说明)

-
19、
氧气是人类无法离开的物质,氧气的获得有多种方法。
(一)自然界获得氧气
(1)如图所示,从反应条件看,光合作用是在绿色植物的叶绿体释放出O2。光合作用是大自然利用太阳能转化成化学能最成功的范例。
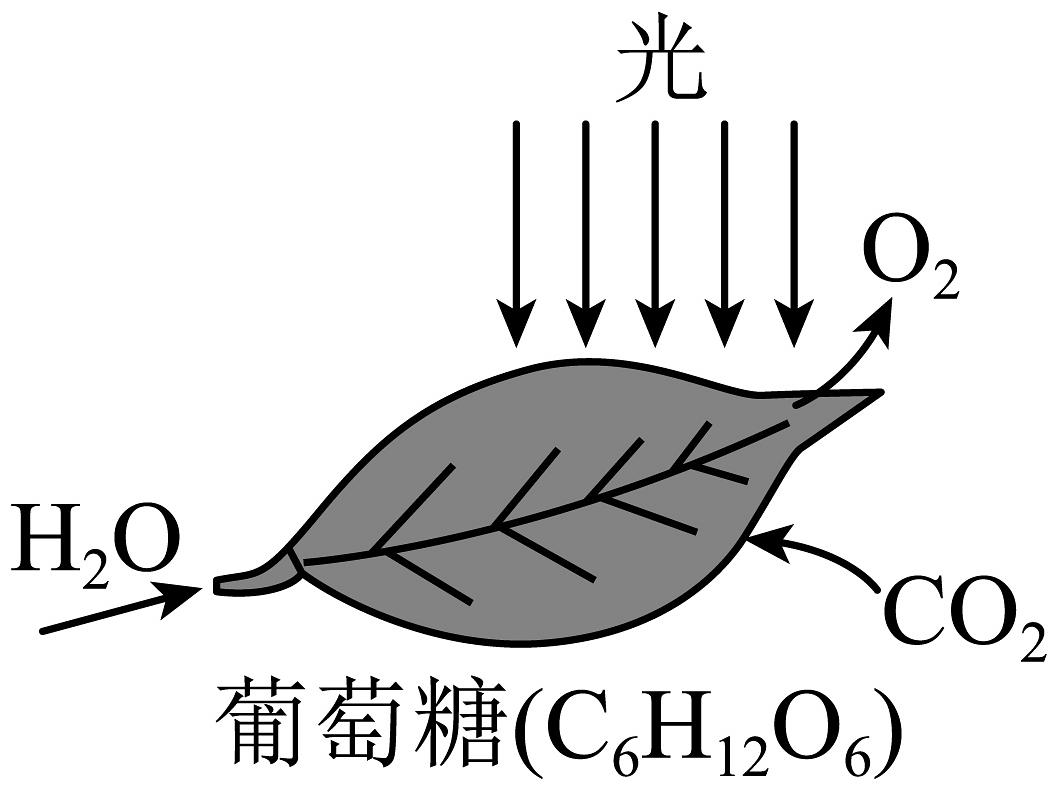
试写出绿色植物光合作用的符号表达式________。
(二)工业获得氧气
在低温条件下加压,使空气变为液态,然后升温,使氮气首先从液态空气中蒸发出来,剩下的主要是液态氧,将其贮存在钢瓶中。
(2)空气变为液态,微粒间的空隙________(填“变大”“变小”或“不变”)。
(3)液氮的沸点________液氧的沸点(填“>”“<”或“=”)。
(三)实验室获得氧气
实验室里常用加热KMnO4或MnO2催化H2O2溶液分解制取氧气。

(4)写出仪器标号的名称①________,②________。
(5)用KMnO4制取氧气时,可选择的装置是________(填字母序号),该反应的符号表达式为________。
(6)用H2O2溶液和MnO2制备氧气,该反应的符号表达式为________。选择C作为发生装置的优点是________,若利用图G所示装置收集制得的氧气,氧气应从________(填“a”或“b”)端进入。
(四)氧气的化学性质
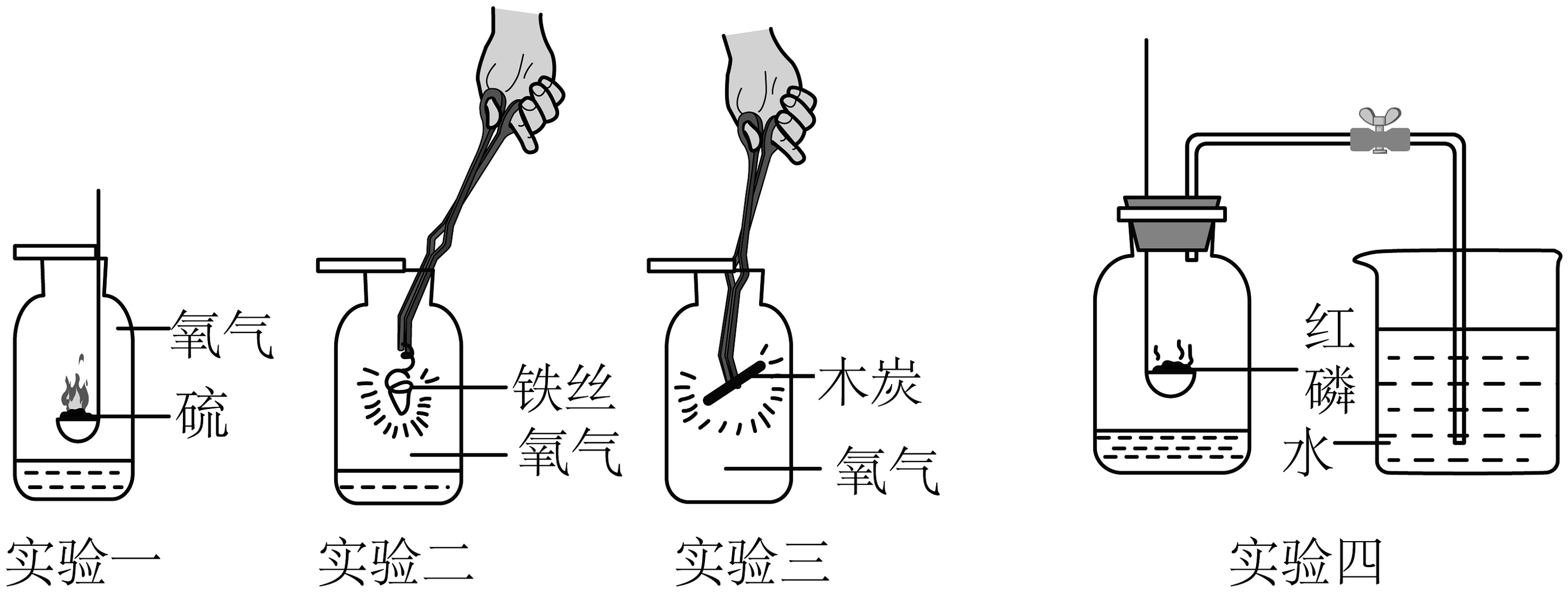
(7)实验一:硫在氧气中燃烧的化学符号表达式是________。
(8)实验二:铁丝在氧气中剧烈燃烧。实验时,铁丝下端系火柴的目的是________,该反应的符号表达式为________。
(9)实验三:实验中木炭分别在空气和氧气中燃烧现象不同。这说明了:________。
(10)实验四的反应的化学符号表达式是。得出实验的结论是。正确选择试剂是实验成功的关键,该实验中对试剂的选择合理的是______。(填字母)。
A. 可以用铁代替红磷进行实验 B. 红磷需要足量 C. 只与氧气反应 (11)实验一、二、四中都要在集气瓶中放少量的水。实验一中水的作用是吸收SO2 , 防止污染空气,由此推测二氧化硫具有的物理性质之一是________。可以把水换成细沙的实验是________。(填“实验一”“实验二”或“实验四”)
(12)根据上述实验,说明氧气的化学性质________(填“比较活泼”或“不活泼”)。
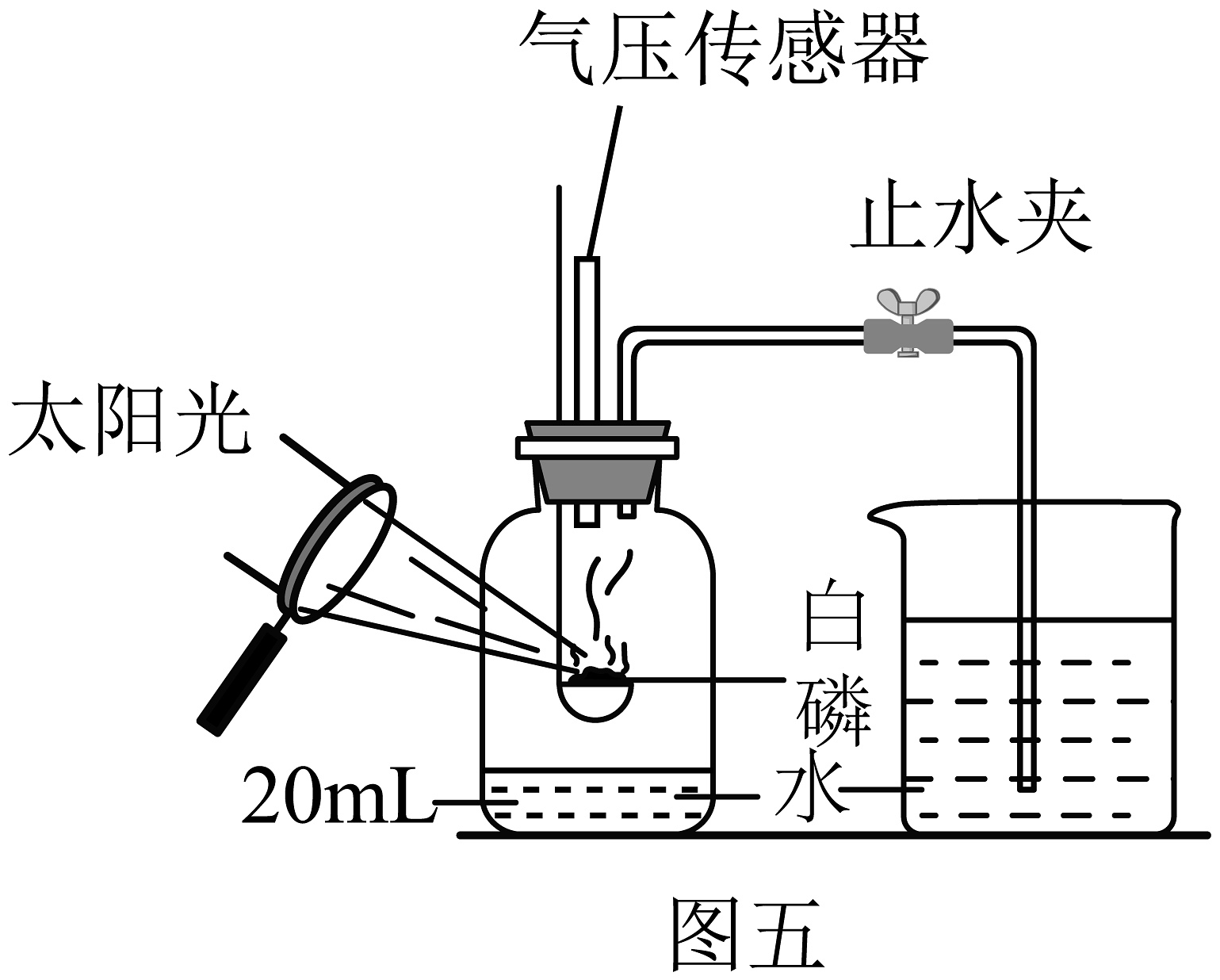
(13)图五所示实验中,已知广口瓶的容积为220mL,冷却后打开止水夹,水从烧杯流入广口瓶中的体积为39mL。则空气中氧气的体积分数约为________,此实验改进后的优点是________。
(五)家庭获得氧气
某品牌家庭制氧机是利用分子筛制氧,空气经过分子筛时氮气被吸附、氧气通过,获得高浓度的氧气。其微观示意图如图:

(14)请将如图方框补充完整。________
(15)分子筛制氧的过程属于________(填“物理”或“化学”)变化。
(16)分子筛制氧的原理类似于化学实验中的________(填操作名称)。
(六)空间站获得氧气
(17)基于如图所示原理,研制的氧气循环再尘组件成功应用于我国天宫空间站。反应I需要在催化剂和加热的条件下才能发生,写出该反应的符号表达式________。

-
20、阅读下列科普短文,回答相关问题。
我国在火箭技术上飞速进步,离不开化学研究。火箭燃料肼(N2H4)又称联氨,有类似于氨气的刺鼻气味,点燃时与助燃物质液态N2O4(四氧化二氮)发生反应,生成N2和H2O。肼燃烧放出大量的热,且燃烧产物对环境无污染,是一种高能火箭燃料。肼的熔点为14℃,沸点为113.5℃;有强烈的吸水性,能吸收空气中的二氧化碳,易溶于水,与液氧接触能自燃,长期曝露在空气中或短时间受热时易发生分解生成氨气、氮气和氢气。
(1)、肼在常温(20℃)下为(填“固态”“液态”或“气态”)。(2)、保持肼的化学性质最小的微粒是(填微粒名称);肼的物理性质有(写一条)。(3)、写出上述信息中的一个化学反应的符号表达式:。(4)、肼需要密封保存的原因是。