-
1、食品包装袋内充人某气体可以避免食物因氧化而变质,该气体可以是( )A、N2 B、O2 C、HCI D、H2O
-
2、科学发展常以如题2图所示的方式推进、循环。公元前5世纪,有哲学家猜想:万物是由极其微小的、不可分割的“原子”构成。这属于( )
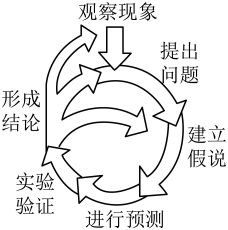 A、观察现象 B、提出问题 C、建立假说 D、实验验证
A、观察现象 B、提出问题 C、建立假说 D、实验验证 -
3、下列是我国几位科学家及其部分研究领域,其中研究领域主要涉及能量的储存与释放的是( )A、徐光宪,稀土元素分离技术研究 B、屠呦呦·抗疟药物研究 C、王泽山·火炸药等高能材料研究 D、侯德榜,制碱工艺研究
-
4、下图1是某品牌鲜牛奶包装标签上的部分信息,如图2是蛋白质中氮的转化过程。请回答下列问题。
 (1)、由1图可知,若一名中学生每天需要从牛奶中补充的钙,则理论上每天应喝盒牛奶。(2)、取鲜牛奶样品,将所含蛋白质中的氮元素全部转化为(如2图中的反应1)。用质量分数为的硫酸溶液将吸收全部转化为 , 发生的化学方程式为 , 请计算样品中蛋白质转化生成的质量。(写出计算过程)(3)、2图中反应2的化学方程式为 , 是工业上合成氨的常用方法。某工厂在合成氨过程中测得温度和压强的关系如3图所示。按图示条件进行合成氨反应,当压强为 , 温度为 , 氨的含量最高。(4)、垃圾分类从我做起,牛奶包装盒应属于下图中的。
(1)、由1图可知,若一名中学生每天需要从牛奶中补充的钙,则理论上每天应喝盒牛奶。(2)、取鲜牛奶样品,将所含蛋白质中的氮元素全部转化为(如2图中的反应1)。用质量分数为的硫酸溶液将吸收全部转化为 , 发生的化学方程式为 , 请计算样品中蛋白质转化生成的质量。(写出计算过程)(3)、2图中反应2的化学方程式为 , 是工业上合成氨的常用方法。某工厂在合成氨过程中测得温度和压强的关系如3图所示。按图示条件进行合成氨反应,当压强为 , 温度为 , 氨的含量最高。(4)、垃圾分类从我做起,牛奶包装盒应属于下图中的。
-
5、
从古至今,铁及其化合物一直被人类广泛应用。
一、铁及其化合物的应用
(1)明代科学著作《天工开物》中记载:“泥固塞其孔,然后使水转釉”是指高温下将红砖中的转化为而形成青砖,同时产生一种气体。该转化的化学方程式为。
(2)铁的化合物在现代更多领域发挥着重要作用。
I.碳酸亚铁不溶于水,可作补血剂,服用后与胃酸反应生成(填化学式)被人体吸收,促进血红蛋白的生成。
Ⅱ.火星探测器发回的信息表明,火星上存在 , 从而证明火星表面曾经存在过水,理由是。
二、的制备
用废铁屑(主要成分为 , 含少量和)制备主要流程如图:
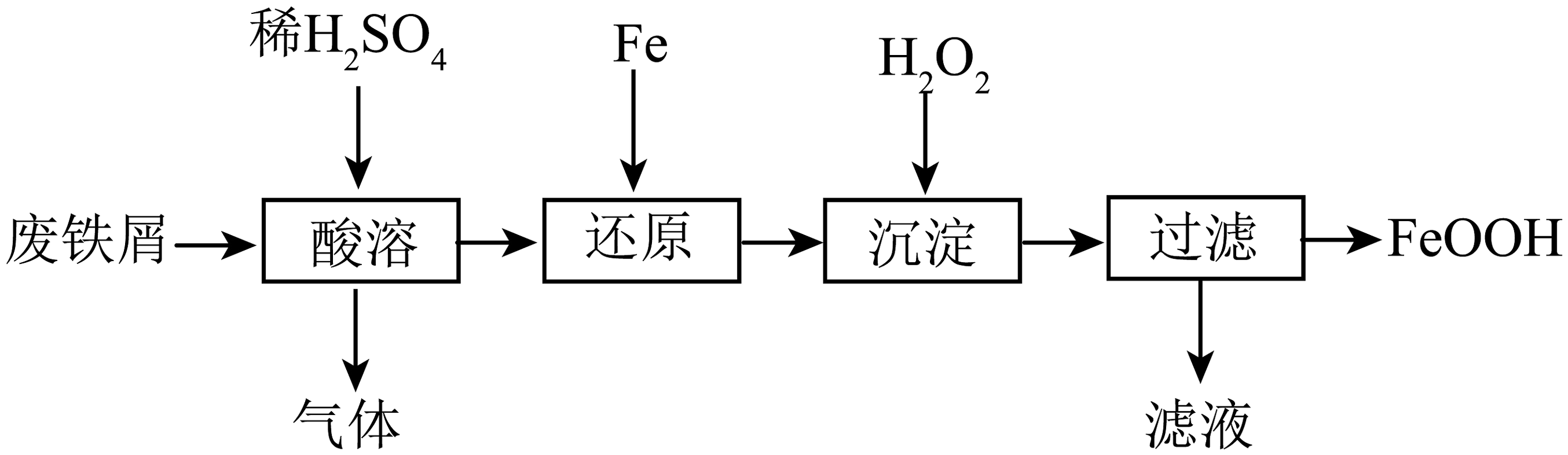
【查阅资料】:制备过程中,“还原”反应的化学方程式为;
“沉淀”反应的化学方程式为。
(3)“酸溶”时适当提高反应温度和浓度,目的是 , 该过程中产生的气体为(填化学式)。
(4)“沉淀”时温度不宜太高,原因是。
(5)过滤时需要用到的玻璃仪器有烧杯、玻璃棒、 , 玻璃棒的作用是。
-
6、
某化学兴趣小组的同学在做氢氧化钙与盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质成分大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
(1)该反应的化学方程式为________。【提出问题】反应后溶液中的溶质成分有哪些?
【查阅资料】溶液呈中性。
【猜想与假设】
(2)猜想1:溶液中的溶质只有________。猜想2:溶液中的溶质有
猜想3:溶液中的溶质有
猜想4:溶液中的溶质有
(3)经过讨论,同学们直接得出猜想________是不正确的(填数字),理由是________。为了验证余下的哪一种猜想是正确的,同学们又做了以下实验。
【进行实验】
(4)实验操作
实验现象
实验结论
①取少量反应后的溶液于试管中,滴加酚酞溶液
________
猜想3不正确
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钙
有气泡产生
猜想________正确
实验②有气泡生成的化学方程式为________。
【拓展反思】
(5)还可以单独用下列哪种物质来证明上述猜想是正确的?________(填字母)。A. B. C. D. -
7、
智慧化学兴趣小组以“气体制备”为主题开展基础实验与跨学科实践。根据下图回答问题。
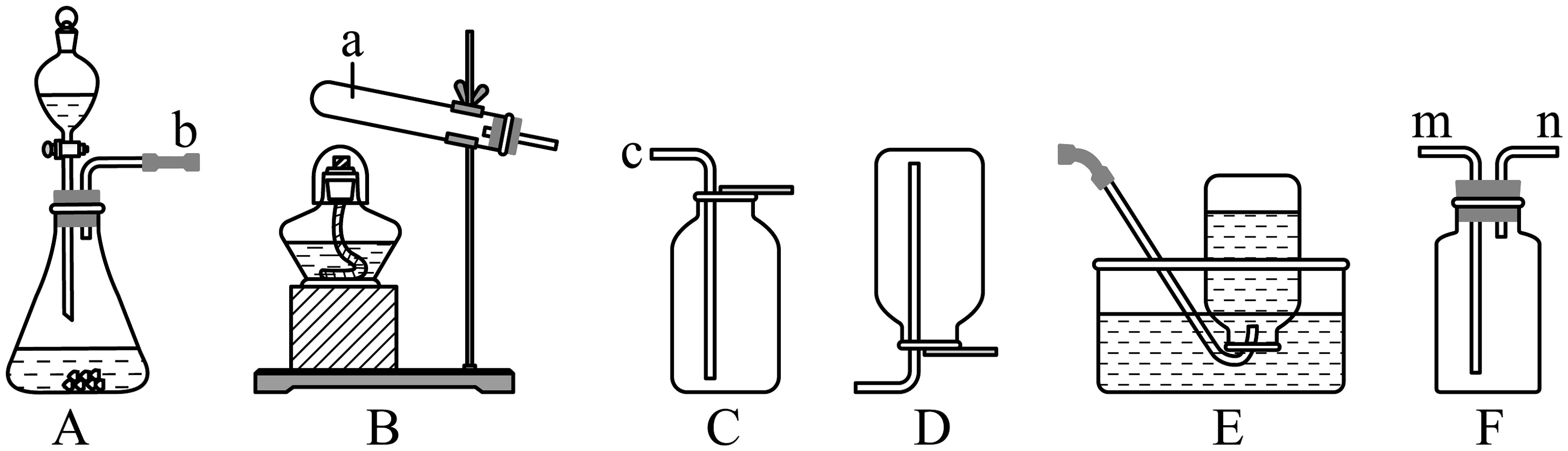
【任务一】基础实验:实验室制取气体
(1)仪器a的名称是。
(2)实验室选择装置B制取氧气的化学方程式为: , 用装置E收集氧气,当观察到时,开始收集。
(3)制备并收集一瓶气体,应选择的组合装置是(请从中选择)。若要制取一瓶干燥的气体,可先将气体通入盛有液体试剂的F装置中,该液体的名称为:。
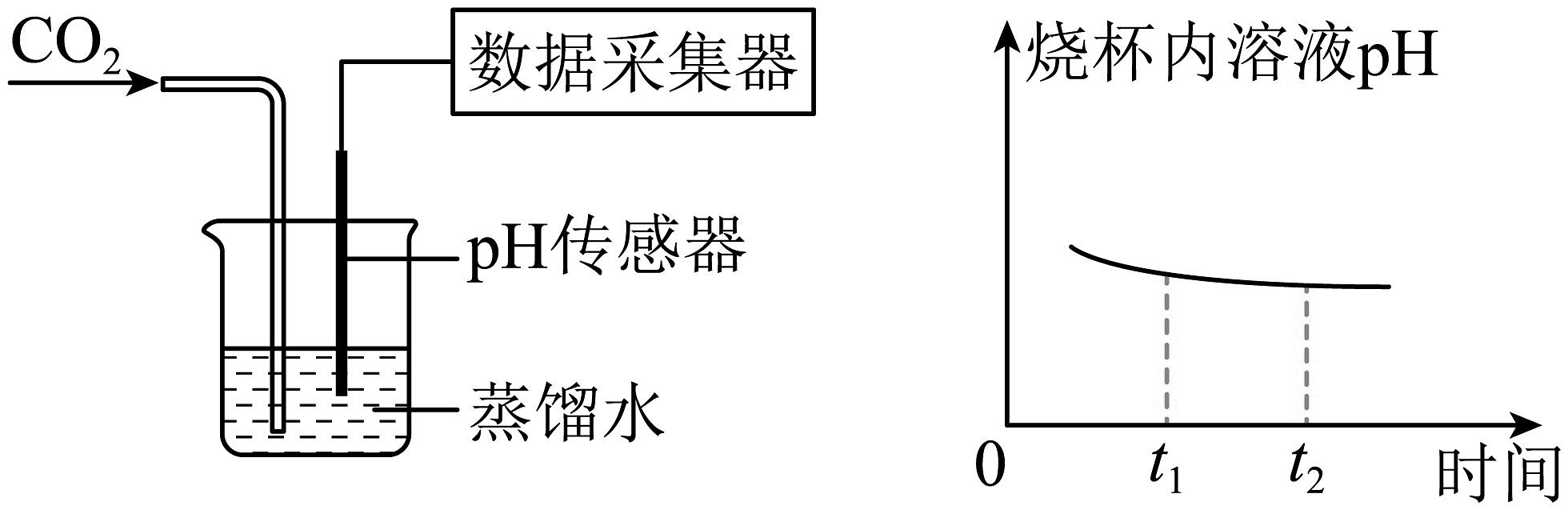
(4)将二氧化碳不断通入一定量的水中,利用传感器采集到的数据如图所示,烧杯内溶液值变小的原因是(用化学方程式解释)。
【任务二】跨学科实践活动
兴趣小组开展“自制净水器及水质检测”实践活动。
(5)自制净水器:如图,净水流程依标号顺序进行。吸附剂为活性炭,因其具有结构。
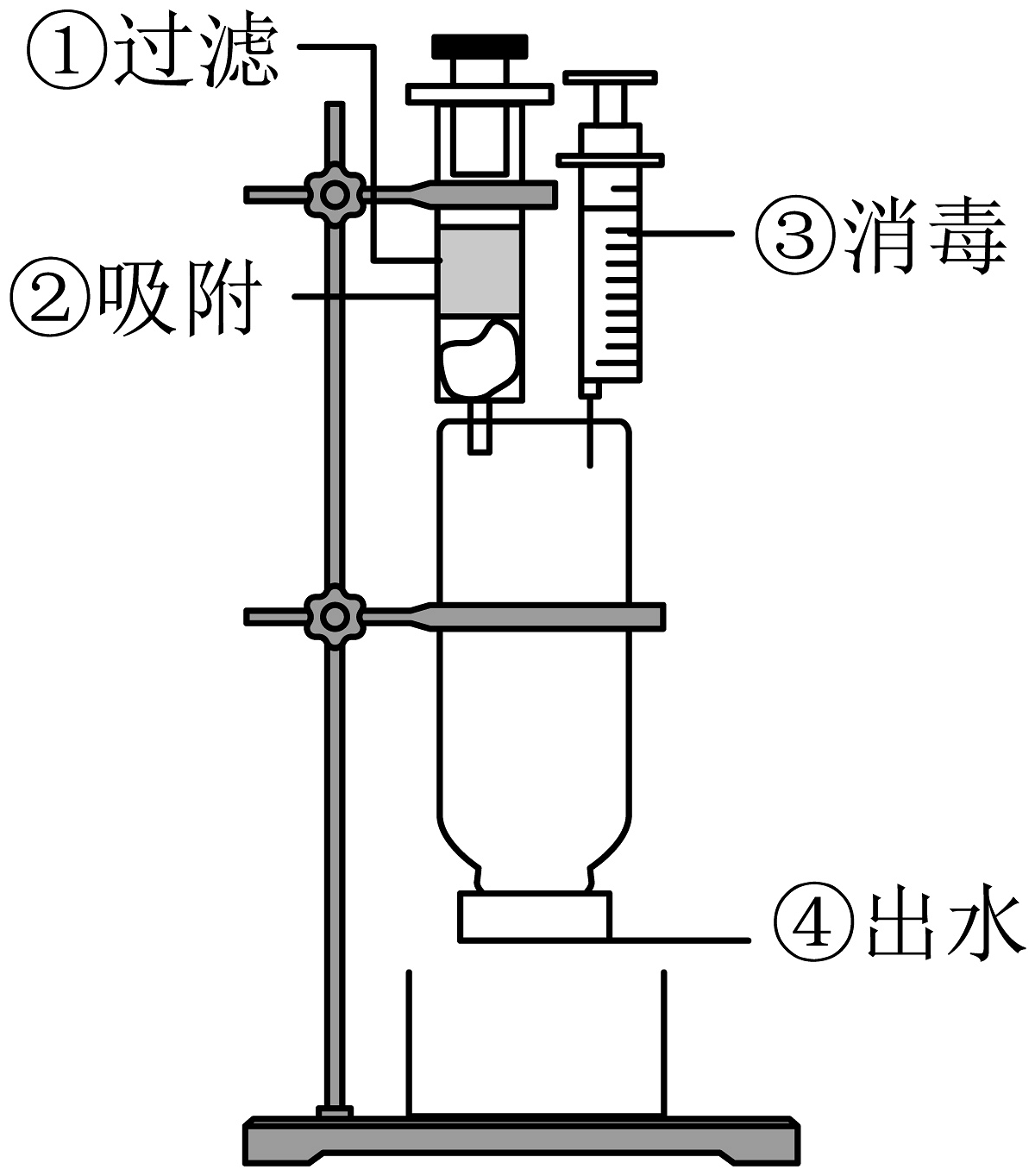
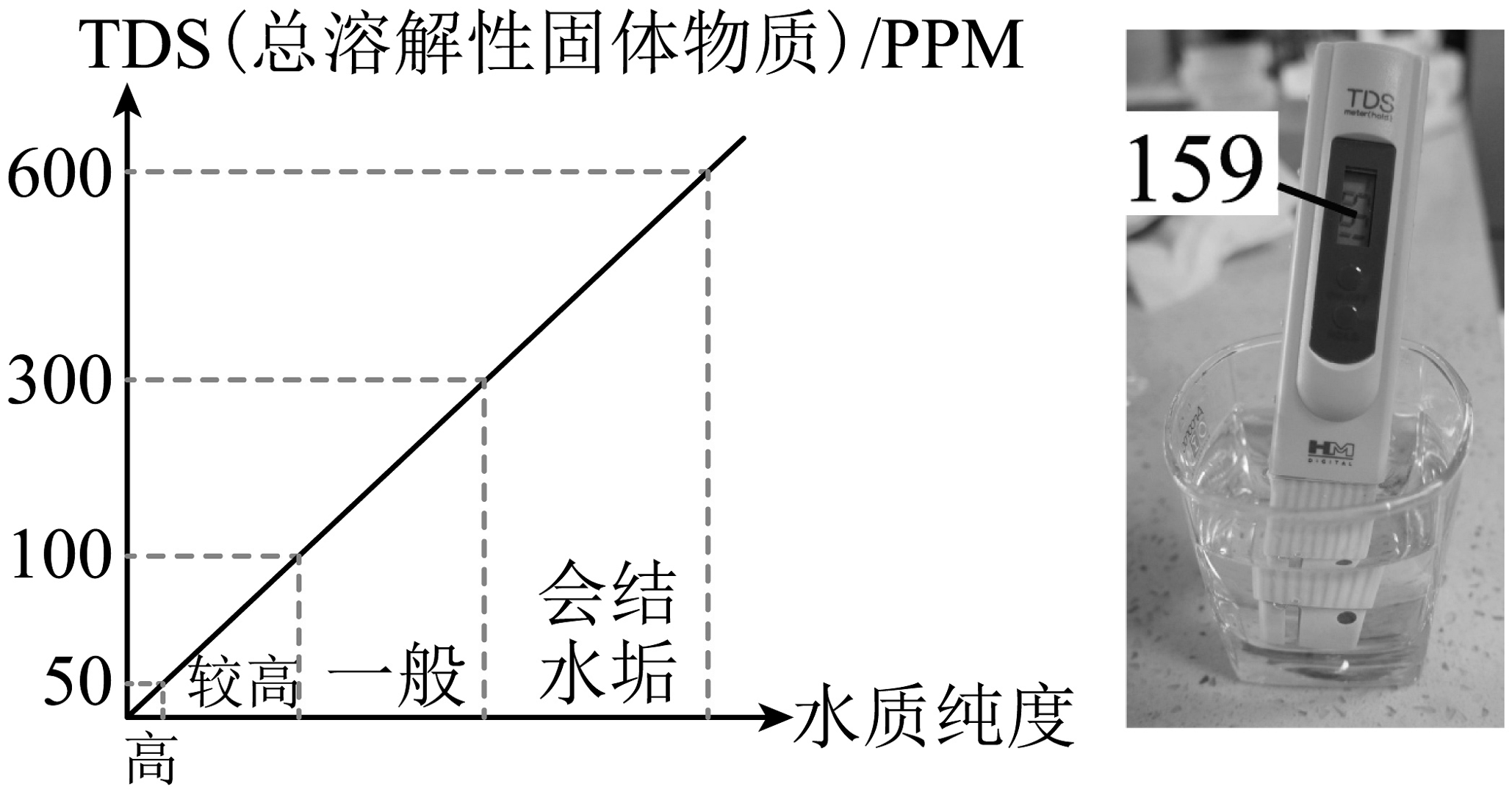
(6)水质检测:值是水质的一项重要指标,某水样经自制净水器净化后的值如图,净化后的水质纯度为。
-
8、清除是载人航天器环境控制和生命保障的重要问题,目前主要包括清除、固态胺吸附和分子筛吸附等方式。清除利用能与发生反应,得到一种能溶于水的盐。由于不可再生,该技术目前多用于短期载人航天任务。固态胺能吸附和水蒸气,且可在真空条件下再生,因此可用于中长期载人航天任务。研究发现,分压和温度对吸附量有影响,如图1所示。分子筛中的吸附剂是沸石。沸石的吸附能力强,且能在高温条件下再生,因此多应用在多人、长期航天任务中。水会影响沸石的吸附性能,通常需对沸石进行干燥处理。相同温度下,干燥时间对不同种类沸石吸附量的影响如图2所示。

科学家们会依据任务持续时间、成员人数及对应的消耗品、设备质量等因素,选择适合的清除技术,以保障宇航员的生命安全。
依据文章内容回答下列问题。
(1)、是造成加剧的主要气体。(2)、目前航天器中的清除技术有(写出一种即可)。(3)、已知具有与类似的性质,请写出溶液与反应的化学方程式 , 因此,应保存。取部分样品溶于水,加溶液(填试剂名称),若产生白色沉淀,说明已变质。(4)、分析1图,可得出结论:相同温度下,在范围内,。(5)、下列说法正确的是________(填字母)。A、由于不可再生,因此不能用于载人航天任务 B、固态胺能吸附 , 可在真空条件下再生,可用于中长期载人航天任务 C、分子筛对的吸附能力强,且可循环利用多用于长期航天任务 -
9、青铜雁鱼灯是西汉著名的环保台灯,其包含雁首颈、雁体、灯盘、灯罩4个部分,如图所示。
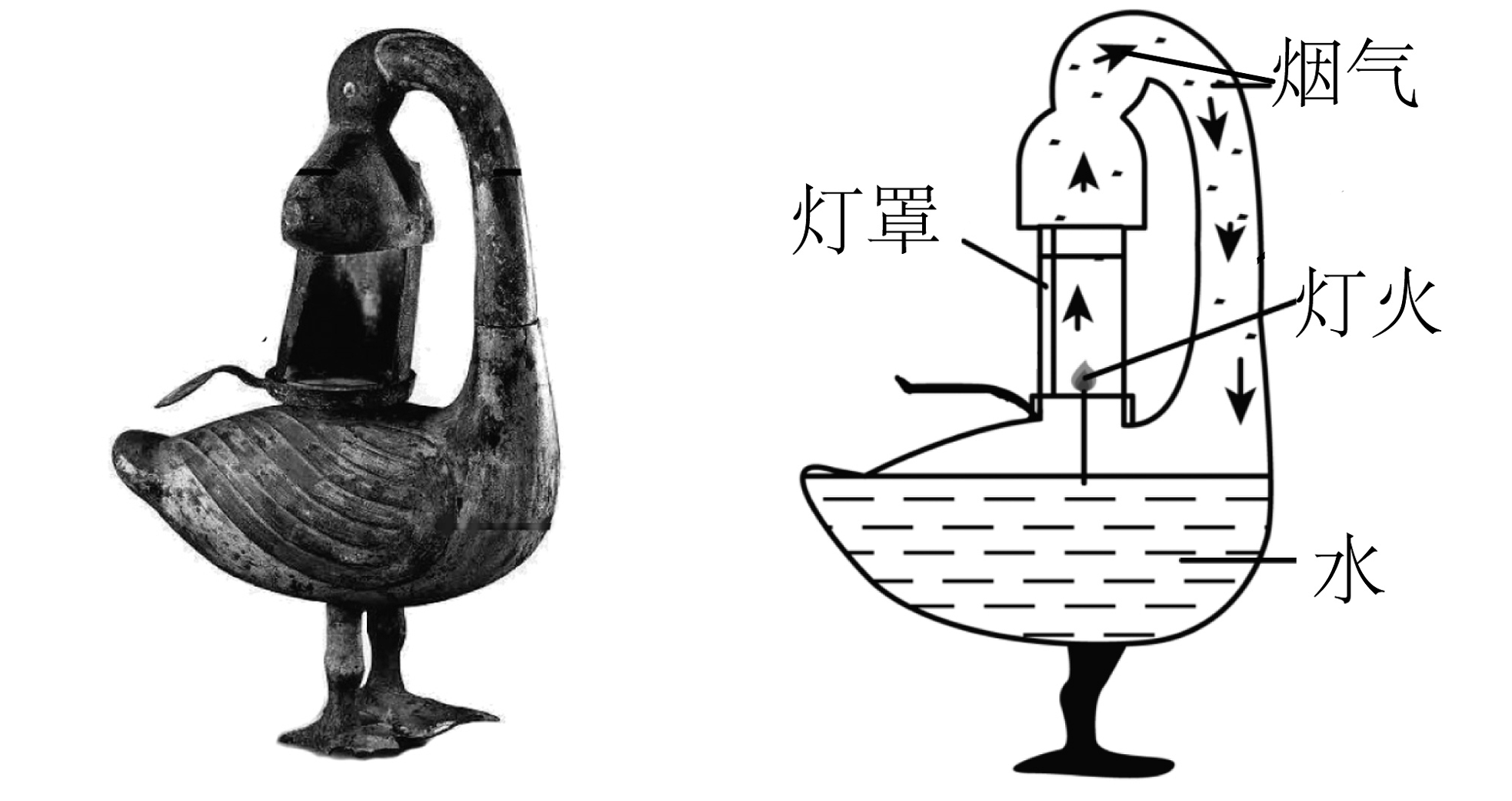 (1)、先秦《考工记》中有关青铜成分记载:“六分其金而锡居其一”(注:“金”指铜),则雁鱼灯灯体属于(填“金属”“合成”或“复合”)材料,雁鱼灯灯体的材质硬度比铜(填“大”或“小”),熔点比铜(填“高”或“低”)。(2)、雁鱼灯出土时表面存在绿色锈蚀,该绿色固体的主要成分是碱式碳酸铜[化学],可以推知,铜锈蚀与空气中的氧气、有关(填化学式)。(3)、灯罩可自由开合,以调节进风量的大小。当看到有大量黑烟产生时,应(填“调大”或“减小”)进风口。(4)、雁鱼灯中盛放的清水的作用是________(多选,填字母)。A、可将燃烧产生的废气引入水中以减少对室内环境的污染 B、减少油的挥发,以达到省油的目的 C、主要目的是用于灭火
(1)、先秦《考工记》中有关青铜成分记载:“六分其金而锡居其一”(注:“金”指铜),则雁鱼灯灯体属于(填“金属”“合成”或“复合”)材料,雁鱼灯灯体的材质硬度比铜(填“大”或“小”),熔点比铜(填“高”或“低”)。(2)、雁鱼灯出土时表面存在绿色锈蚀,该绿色固体的主要成分是碱式碳酸铜[化学],可以推知,铜锈蚀与空气中的氧气、有关(填化学式)。(3)、灯罩可自由开合,以调节进风量的大小。当看到有大量黑烟产生时,应(填“调大”或“减小”)进风口。(4)、雁鱼灯中盛放的清水的作用是________(多选,填字母)。A、可将燃烧产生的废气引入水中以减少对室内环境的污染 B、减少油的挥发,以达到省油的目的 C、主要目的是用于灭火 -
10、下列实验设计不能达到实验目的的是



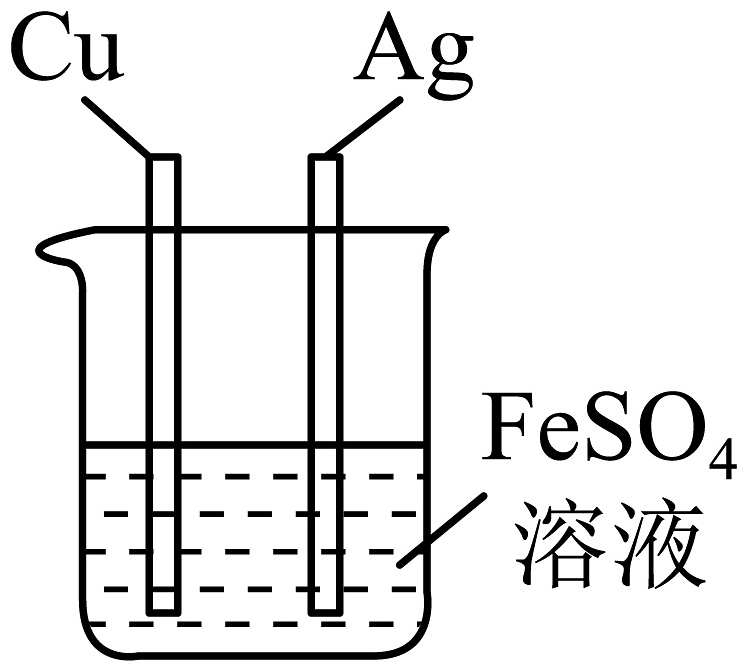
A.验证铁生锈的条件
B.验证固体溶于水时,U型管内会出现左端液面高于右端液面
C.探究碘在不同溶剂中的溶解性
D.验证的金属活动性强弱
A、A B、B C、C D、D -
11、鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是
选项
实验目的
实验设计
A
鉴别与
分别点燃,观察火焰颜色
B
检验溶液中是否含有
加入适量溶液
C
鉴别涤纶和羊毛
分别灼烧,闻气味
D
除去中的
加入过量稀盐酸,过滤
A、A B、B C、C D、D -
12、氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法不正确的是
 A、40℃时,溶液中溶解了 B、两种物质的溶解度都随温度升高而增大 C、可用降温结晶的方法除去中少量的 D、将的饱和溶液升温,溶液中溶质质量分数不变
A、40℃时,溶液中溶解了 B、两种物质的溶解度都随温度升高而增大 C、可用降温结晶的方法除去中少量的 D、将的饱和溶液升温,溶液中溶质质量分数不变 -
13、中国传统印染工艺常用靛蓝作染料。下列关于的说法正确的是A、含有30个原子 B、氢、氧元素的质量比为 C、由碳、氢、氮、氧四种元素构成 D、碳元素质量分数最大
-
14、建立宏观和微观的联系是化学学科的重要思想之一。下列分析不正确的是A、一氧化碳与二氧化碳的化学性质不同——氧原子个数不同 B、金刚石不导电而石墨导电——碳原子的排列方式不同 C、非吸烟者在公共场所吸“二手烟”——微粒在不断运动着 D、注射器中的气体通过压缩体积会变小——加压时,气体分子间隔变小
-
15、实验课上,化学老师进行浓硫酸配制成稀硫酸的演示实验,如图所示。完成下面小题。
 (1)、演示实验过程中要规范操作,注意实验安全。下列行为正确的是A、在学生桌面上演示浓硫酸稀释 B、穿上实验服和佩戴护目镜 C、将浓硫酸私自带回家中 D、不慎沾到皮肤上应立即用水冲洗,再涂上硼酸(2)、下列与配制稀硫酸有关的说法不正确的是
(1)、演示实验过程中要规范操作,注意实验安全。下列行为正确的是A、在学生桌面上演示浓硫酸稀释 B、穿上实验服和佩戴护目镜 C、将浓硫酸私自带回家中 D、不慎沾到皮肤上应立即用水冲洗,再涂上硼酸(2)、下列与配制稀硫酸有关的说法不正确的是 A、浓硫酸稀释过程会放出热量 B、储存浓硫酸的试剂瓶应该张贴如图所示标志 C、稀释浓硫酸时,将浓硫酸缓馒倒入水中并不断搅拌 D、配制上述溶液需浓硫酸的质量是
A、浓硫酸稀释过程会放出热量 B、储存浓硫酸的试剂瓶应该张贴如图所示标志 C、稀释浓硫酸时,将浓硫酸缓馒倒入水中并不断搅拌 D、配制上述溶液需浓硫酸的质量是 -
16、化学用语是学习化学的工具。下列表示两个氧原子的是A、 B、 C、 D、
-
17、稀土元素被称为“工业维生素”。我国被誉为“稀土之父”的科学家是A、张青莲 B、屠呦哟 C、徐光宪 D、侯德榜
-
18、“庄稼一枝花,全靠肥当家”。为了促进植物茎、叶生长茂盛,叶色浓绿,应施加的化学肥料是A、 B、KCl C、 D、
-
19、电影《哪吒之魔童闹海》场景中涉及化学变化的是A、挖莲藕 B、炼法宝 C、刻造型 D、冻海浪
-
20、造纸术是我国四大发明之一。北宋诗人曾对“敲冰纸”写下“寒溪浸楮春夜月,敲冰举帘匀割脂”的赞美诗句。该造纸的部分生产情景如图所示。
 (1)、“寒溪浸楮”意思为“在寒冷的(表面结冰)溪水中浸泡楮树皮”。用纯度较高的水浸泡有利于制得质量上佳的纸张,说明冬天气温低,水中可溶性杂质溶解度(选填“大”或“小”)。(2)、“楮”指树皮,树皮属于(选填“天然”或“合成”)有机高分子材料,“舂捣”的过程属于(选填“物理”或“化学”)变化。(3)、纸浆在竹帘中均匀铺开,水从竹帘缝隙流出,纸浆留在竹帘上、据此推测竹帘的缝隙应(选填“大于”或“小于”)纸浆大小。(4)、现代工业造纸会用到元明粉(主要成分为)。现获得一定量的该样品,加水使其完全溶解,利用下述反应测定的质量:。样品充分反应后得到沉淀23.3g。请计算该样品中的质量。(写出计算过程)
(1)、“寒溪浸楮”意思为“在寒冷的(表面结冰)溪水中浸泡楮树皮”。用纯度较高的水浸泡有利于制得质量上佳的纸张,说明冬天气温低,水中可溶性杂质溶解度(选填“大”或“小”)。(2)、“楮”指树皮,树皮属于(选填“天然”或“合成”)有机高分子材料,“舂捣”的过程属于(选填“物理”或“化学”)变化。(3)、纸浆在竹帘中均匀铺开,水从竹帘缝隙流出,纸浆留在竹帘上、据此推测竹帘的缝隙应(选填“大于”或“小于”)纸浆大小。(4)、现代工业造纸会用到元明粉(主要成分为)。现获得一定量的该样品,加水使其完全溶解,利用下述反应测定的质量:。样品充分反应后得到沉淀23.3g。请计算该样品中的质量。(写出计算过程)