-
1、
洁厕剂是如何清除垢状物,如何合理使用洁厕剂,从哪些方面了解它?
【查阅资料】
a.垢状物主要成分为难溶性碳酸盐及铁锈,难溶于水,能溶于酸;
b.洁厕剂中常加入无机酸。
活动1:洁厕剂的无机酸可能是盐酸、硫酸中的一种或两种,设计实验探究。
【提出问题】洁厕剂中有什么酸?
【作出猜想】
(1)猜想1:盐酸
猜想2:硫酸
猜想3:
【实验探究】
(2)取少量稀释后的洁厕剂分别加入到A、B、C试管中
编号
操作
现象
结论
1
向A中加入打磨过的铁钉
铁钉表面有气泡产生
酸为盐酸
2
向B中滴加溶液
无明显变化
3
向C中先滴加溶液,再滴加稀硝酸
活动2:可通过洁厕剂与碳酸氢钠反应生成的来测定酸的含量。装置如图所示:

(3)A中发生的化学反应方程式为:;
(4)反应前后都要通氮气,反应后通一段时间氮气的原因是:;
(5)B中浓硫酸的作用是: , 可测定(填字母)装置反应前后的质量来确定产生的质量,若无D装置可能导致测定的结果偏(填“大”或“小”)。
(6)针对该洁厕剂,你觉得下列说法中合理的是。
a.可用洁厕剂去除铁锈 b.打开后可能会闻到刺激性气味
c.有一定的腐蚀性 d.可除去衣服上的油污
-
2、实验室制氧气
 (1)、①写出仪器a的名称:。
(1)、①写出仪器a的名称:。②实验室制取O2可选择的发生装置为(填字母),该反应的化学方程式为。
③如装置C所示,点燃沾有酒精的棉条,将其缓慢放入集满CO2的烧杯中,看到棉条上的火焰熄灭,再将其提起,棉条由上到下复燃。根据实验现象,说明燃烧的条件之一是。
(2)、电解水制氧气设计并制作电解水简易装置,如装置D所示,将铅笔芯作为电极,接通电源后,水中的两支铅笔芯电极附近的现象是。该反应的化学方程式是。
(3)、光合作用制氧气向装置E的水中通入适量CO2 , 放在阳光下一段时间后,观察到水草表面有气泡产生,利用法收集到少量氧气(如装置E图所示),此时试管内的气体压强比外界大气压(填“大”、“小”或“相等”)。
-
3、2024年10月18日,青花瓷酒业在江西景德镇举办第十届封坛大典-青花瓷二十四节气封坛酒。在这片充满陶瓷文化底蕴的土地上,用瓷为器,盛酒、温酒、品酒:以瓷为卷,写酒、画酒、绘酒。图1为古法酿酒示意图,图2为用高粱酿酒的生产流程图,请据图回答问题。

 (1)、二十四节气中的雨水——好雨知时节,当春乃发生。雨水属于混合物,可通过净化后用于酿酒。常用于饮用水消毒,中氯元素化合价为。(2)、《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上……其清如水,味极浓烈,盖酒露也。”图1中古法酿酒所用原理与现代净水方法中的相似。(3)、图2中将高粱粉碎的目的是。(4)、大曲中含有生物酶,向原料中加入大曲可缩短发酵时间,大曲所起的作用是。(5)、发酵过程中的一个反应为葡萄糖在催化酶的催化作用下分解生成乙醇和二氧化碳,写出该反应的化学方程式: , 加入酒曲发酵酿酒发生的是(填“缓慢氧化”或“剧烈氧化”)
(1)、二十四节气中的雨水——好雨知时节,当春乃发生。雨水属于混合物,可通过净化后用于酿酒。常用于饮用水消毒,中氯元素化合价为。(2)、《本草纲目》记载:“其法用浓酒和糟入瓶,蒸令气上……其清如水,味极浓烈,盖酒露也。”图1中古法酿酒所用原理与现代净水方法中的相似。(3)、图2中将高粱粉碎的目的是。(4)、大曲中含有生物酶,向原料中加入大曲可缩短发酵时间,大曲所起的作用是。(5)、发酵过程中的一个反应为葡萄糖在催化酶的催化作用下分解生成乙醇和二氧化碳,写出该反应的化学方程式: , 加入酒曲发酵酿酒发生的是(填“缓慢氧化”或“剧烈氧化”) -
4、下列实验操作能达到实验目的的是
选项
物质
目的
主要实验操作
A
蔗糖、食盐
鉴别
取样,滴加浓硫酸,观察现象
B
Fe粉和粉末
分离
溶解、过滤、洗涤、烘干、蒸发结晶
C
与NaOH中和后,盐酸是否有剩余
检验
取样,滴加溶液,观察有无沉淀
D
溶液中混有
除杂
加入过量的溶液,搅拌、过滤、洗涤,将所得固体溶于适量稀硝酸
A、A B、B C、C D、D -
5、甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是
 A、时,等质量的甲、乙、丙的溶液降温到时,析出晶体最多的是甲的溶液 B、时,将25g乙加入到50g水中,再降温到 , 所得溶液的溶质质量分数约为33.3% C、时,将甲、乙、丙三种物质的饱和溶液升温到 , 所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙 D、时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙
A、时,等质量的甲、乙、丙的溶液降温到时,析出晶体最多的是甲的溶液 B、时,将25g乙加入到50g水中,再降温到 , 所得溶液的溶质质量分数约为33.3% C、时,将甲、乙、丙三种物质的饱和溶液升温到 , 所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙 D、时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙 -
6、实验室制取CO2 , 下列试剂、装置、检验和验满错误的是A、
 选择试剂
B、
选择试剂
B、 发生装置
C、
发生装置
C、 检验CO2
D、
检验CO2
D、 CO2验满
CO2验满
-
7、下列归类正确的是
选项
归类
内容
A
同一种物质
烧碱、纯碱、火碱
B
挥发性的酸
浓盐酸、浓硫酸、浓硝酸
C
化石燃料
煤气、石油、天然气
D
常见合金
青铜、铝合金、不锈钢
A、A B、B C、C D、D -
8、如图是元素周期表的一部分。下列说法正确的是( )
 A、三种原子中质量最大的是硅原子 B、三种元素均为非金属元素 C、铝是地壳中含量最高的元素 D、碳的相对原子质量约为12.01g
A、三种原子中质量最大的是硅原子 B、三种元素均为非金属元素 C、铝是地壳中含量最高的元素 D、碳的相对原子质量约为12.01g -
9、下列物质中,富含蛋白质的是A、土豆 B、鸡蛋 C、奶油 D、西红柿
-
10、电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO4+2H2O2Cu↓+O2↑+2H2SO4。取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出12.8g Cu时,得到384g硫酸铜质量分数为5%的溶液。(注:本题不考虑气体在溶液中的溶解)回答下列问题:
(1)反应后所得溶液中的溶质为 (填化学式)。
(2)向电解后得到的溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的 (填选项编号)。
A. Cu B. CuO C. Cu(OH)2
(3)求原硫酸铜溶液中溶质的质量分数(结果精确至0.1%)。
-
11、
盐湖蕴藏着丰富的资源。兴趣小组围绕盐湖展开相关的探究活动。
探源盐文化
(1)《说文解字)云:“盐,卤也”。甲骨文中的“卤”(如图1)蕴含的获取盐的方法是________。夏天晒“盐”,冬天捞“碱”得到的Na2CO3的俗称是________。我国制碱工业的先驱________发明了联合制碱法。

探秘冬天捞“碱”
(2)据图分析,冬天适合捞“碱”的原因是________。将含Na2CO3和NaCl的模拟盐湖水降温结晶,检验得到的晶体中是否含有NaCl。

【查阅资料】AgCl为白色固体,不溶于水和稀硝酸;Ag2SO4为白色固体,微溶于水。
【方案研讨】
(3)
方案
方案设计
评价交流
1
取样,溶解,滴加少量AgNO3溶液,若产生白色沉淀,则含有NaCl
教师指出该方案不严谨。原因是Ag2CO3也为白色沉淀
2
取样,溶解,先滴加过量稀盐酸,再滴加少量AgNO3溶液,若产生白色沉淀,则含有NaCl
滴加稀盐酸发生反应的化学方程式为________;有同学提出该方案也不严谨,原因是________。
【方案优化】
(4)将方案2中的稀盐酸换成___________ (填字母序号)。
A. CaCl2溶液 B. 稀硝酸 C. 稀硫酸 【实验及结果】实施优化后的方案,结果表明含有NaCl。
【废液处理】
(5)提出合理处理实验废液的措施:________(写一条)。
-
12、如图为实验室常用装置示意图,请根据题意回答问题。
 (1)、实验室选择装置A制取CO2的依据是 , 该反应的化学方程式为。(2)、实验室用装置A制取氧气,反应的化学方程式为;实验室若用装置B收集O2 , 气体应从 (填“a”或“b” )端通入。(3)、硫化亚铁(FeS)固体和稀硫酸常温下可发生复分解反应,该反应常用于实验室制取H2S气体。H2S气体有毒,能溶于水,其水溶液为氢硫酸。制取H2S气体的化学方程式为。某同学用C、D、E装置组合收集H2S气体,装置D的作用是防倒吸。则虚线框内最合适的装置是F中的(填“甲”或“乙”);装置E中发生的反应(填“属于”或“不属于”)中和反应。
(1)、实验室选择装置A制取CO2的依据是 , 该反应的化学方程式为。(2)、实验室用装置A制取氧气,反应的化学方程式为;实验室若用装置B收集O2 , 气体应从 (填“a”或“b” )端通入。(3)、硫化亚铁(FeS)固体和稀硫酸常温下可发生复分解反应,该反应常用于实验室制取H2S气体。H2S气体有毒,能溶于水,其水溶液为氢硫酸。制取H2S气体的化学方程式为。某同学用C、D、E装置组合收集H2S气体,装置D的作用是防倒吸。则虚线框内最合适的装置是F中的(填“甲”或“乙”);装置E中发生的反应(填“属于”或“不属于”)中和反应。 -
13、工业上炼铁、炼钢和轧制钢材的主要流程如图1所示。
 (1)、反应:①2Fe2O3+3C4Fe+3CO2↑;②Fe2O3+3CO2Fe+3CO2 , 用于高炉炼铁的原理是(填序号)。(2)、炉渣中含有硅酸钙(CaSiO3),其中阴离子符号为。(3)、图2为硅在元素周期表中的部分信息,硅在地壳中含量排第位。
(1)、反应:①2Fe2O3+3C4Fe+3CO2↑;②Fe2O3+3CO2Fe+3CO2 , 用于高炉炼铁的原理是(填序号)。(2)、炉渣中含有硅酸钙(CaSiO3),其中阴离子符号为。(3)、图2为硅在元素周期表中的部分信息,硅在地壳中含量排第位。 (4)、元素周期表的前20号元素中。与硅化学性质相似的元素的原子序数为。(5)、在高炉中加入石灰石的目的是。(6)、取钢板样品5.65 g。加入足量稀硫酸,完全反应后产生气体0.20 g。则该钢样含碳量为(结果保留1位小数)。
(4)、元素周期表的前20号元素中。与硅化学性质相似的元素的原子序数为。(5)、在高炉中加入石灰石的目的是。(6)、取钢板样品5.65 g。加入足量稀硫酸,完全反应后产生气体0.20 g。则该钢样含碳量为(结果保留1位小数)。 -
14、2024年7月至8月巴黎奥运会召开。(1)、奥运村实现了5G网络的全覆盖。制造5G芯片的氮化镓(GaN)材料可由氯化镓(GaCl3)制取,两种物质中Ga的化合价相同,则其中N的化合价为。(2)、在乒乓球男单夺冠后,樊振东笑得十分开心,露出一口白牙。小苏打牙膏中含有单氟磷酸钠(Na3PO3F),单氟磷酸钠在口腔唾液的作用下产生氟离子,从而对牙齿起防龋作用,氟是人体所需的(填“常量”“微量”或“非必需")元素。(3)、奥运会对水能源。材料需求量很大,下列有关说法正确的是___________ (填字母序号)。A、硬水含较多可溶性钙、镁化合物,易导致锅炉管道变形或损坏 B、含碳燃料不完全燃烧会产生有毒的CO,CO转化为CO2只能通过和氧气反应 C、建设场馆用到的水泥,属于无机非金属材料(4)、场馆的建设使用了大量的铝、铁铜等金属材料,铝作为生活中使用量较多的金属,除建筑中用到铝外。铝还可能的用途有。将过量Fe粉加Al(NO3)3和Cu(NO3)2的混合溶液中。充分反应后溶液颜色变化情况为反应结束后过滤。滤渣中一定有。
-
15、钻(Co)的金属活动性与铁相似,钴的化合物相关性质如下表。下列预测合理的是
物质
CoO
Co(OH)2
CoCl2
CoCO3
溶解性
难溶,灰绿色固体
难溶,粉红色固体
易溶,溶液呈粉红色
难溶,粉红色固体
A、Co能从AgCl中置换出Ag B、CoO能与盐酸发生复分解反应得到浅绿色溶液 C、Co(OH)2能使酚酞试液变红 D、CoCO3与盐酸混合产生气泡,溶液变为粉红色 -
16、过氧乙酸(CH3COOOH)可以用于杀灭病毒。下列关于过氧乙酸的说法,正确的是A、过氧乙酸由三个元素组成 B、过氧乙酸中碳、氢、氧元素的质量比为2:4:3 C、过氧乙酸相对分子质量为76 D、过氧乙酸属于无机化合物
-
17、一种纳米纤维催化剂可将CO2转化成液体燃料甲醇(CH3OH),有利于实现政府工作报告中提出的“碳达峰”“碳中和”。其微观示意图如下(图中微粒恰好完全反应)。下列说法错误的是
 A、丙、丁的分子个数比1:2 B、丁的化学式为H2O C、反应中每消耗22 g二氧化碳,同时生成16g甲醇 D、反应的实质是分子分解为原子,原子重新组合为新分子
A、丙、丁的分子个数比1:2 B、丁的化学式为H2O C、反应中每消耗22 g二氧化碳,同时生成16g甲醇 D、反应的实质是分子分解为原子,原子重新组合为新分子 -
18、为助力实现“碳达峰”碳中和"。工业生产中可用NaOH吸收CO2生成Na2CO3.NaOH和Na2CO3的溶解度如下表:
温度/℃
0
20
40
60
80
100
溶解度/g
NaOH
40
109
129
174
314
347
Na2CO3
7
21.5
49
46
43.5
45.5
根据表中数据判断,下列说法正确的是
A、Na2CO3溶解度随温度升高而增大 B、40时,向100 g水中加入135 g NaOH可能全部溶解 C、NaOH和Na2CO3溶解度曲线在0~100℃范围内没有交点 D、0℃时,向140 g NaOH饱和溶液中通入CO2使其全部转化为Na2CO3 , 析出固体为46 g -
19、生活中处处有化学。下列说法错误的是A、为节约粮食,发霉的大米经过浸泡、淘洗后可以食用 B、为使发面食品松软可口,制作时可添加适量的小苏打 C、锌是人体中必需的微量元素,缺锌会食欲不振 D、用灼烧法可以区分棉纤维与羊毛纤维
-
20、碳酸锶(SrCO3)可用于制造红色焰火、荧屏玻璃等,其化学性质与CaCO3相似。化学兴趣小组为测定某SrCO3固体样品中SrCO3的质量分数,先将10g样品放入质量为50g的锥形瓶中,再逐滴加入稀盐酸充分反应(如图所示)。反应过程中测得滴加稀盐酸的总质量与充分反应后锥形瓶及瓶内剩余物质总质量的数据如下表所示(该样品中杂质不溶于水,也不与酸反应)。回答下列问题。
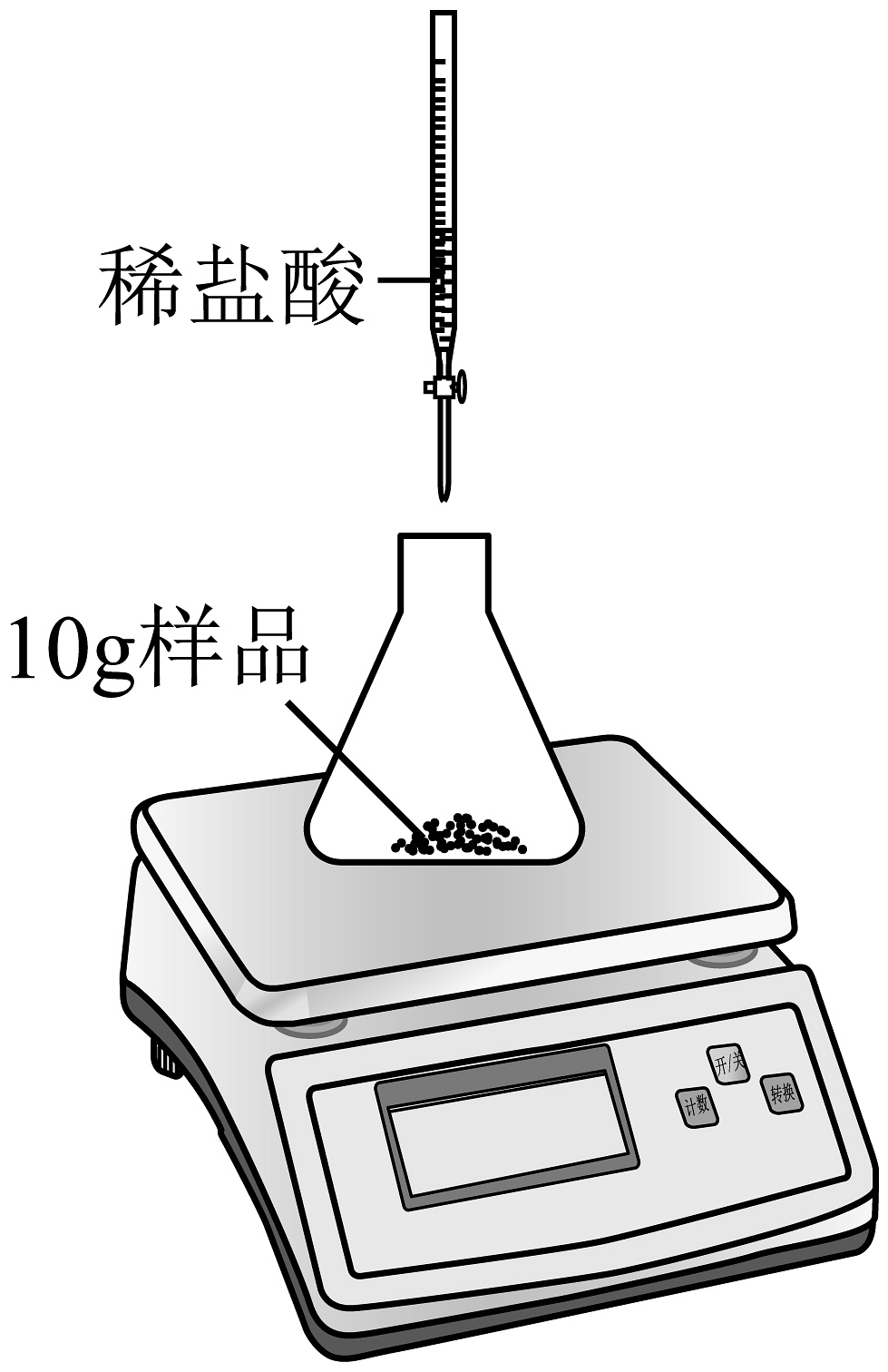
加入稀盐酸的总质量/g
0
10
25
35
锥形瓶及瓶内剩余物质总质量/g
60.00
69.12
82.80
92.36
(1)、10g该SrCO3样品与稀盐酸恰好完全反应时,消耗的稀盐酸的总质量是产生二氧化碳的总质量是。(2)、该样品中碳酸锶的质量分数为多少(写出具体计算过程)?(3)、这种测定方法产生误差的原因可能是(任写1条)。