相关试卷
-
1、下图为工业制取小苏打时涉及三种溶质的溶解度曲线。有关说法正确的是
 A、NH4Cl的溶解度比NaCl的溶解度大 B、60℃时,在100g水中加入55.2gNaCl,形成155.2g溶液 C、t℃时,NH4Cl和NaCl溶液的溶质质量分数相等 D、从NaCl和NaHCO3混合溶液中得到NaHCO3固体,可用降温结晶
A、NH4Cl的溶解度比NaCl的溶解度大 B、60℃时,在100g水中加入55.2gNaCl,形成155.2g溶液 C、t℃时,NH4Cl和NaCl溶液的溶质质量分数相等 D、从NaCl和NaHCO3混合溶液中得到NaHCO3固体,可用降温结晶 -
2、鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是
选项
实验目的
实验设计
A
鉴别MnO2和Fe3O4
观察颜色
B
除去CO气体中混有的CO2
依次通过足量的氢氧化钠溶液和浓硫酸
C
鉴别N2和CO2
分别向集气瓶中伸入燃着的木条
D
除去FeCl2溶液中混有的少量稀盐酸
加入适量的氧化铁粉末,充分反应后过滤
A、A B、B C、C D、D -
3、闵恩泽推动中国石油化工技术自主创新,被誉为“中国催化剂之父”。某催化剂使甲烷(CH4)和水在常温下产生H2的微观示意图如下,下列说法正确的是
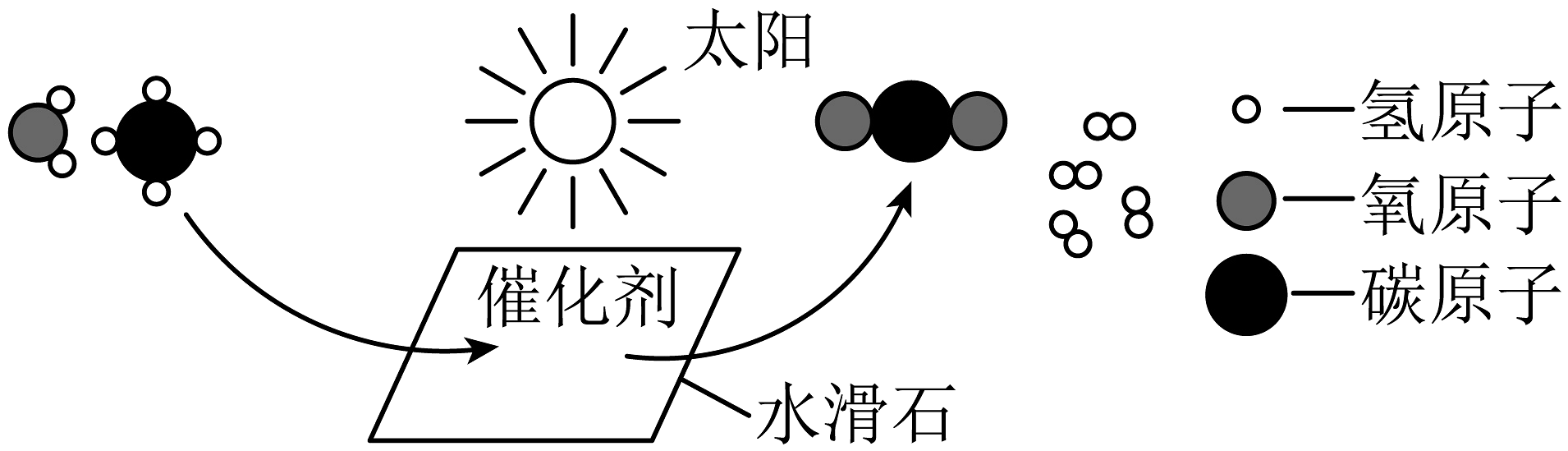 A、该反应生成的两种分子的个数比为1:4 B、反应前后元素的化合价均不变 C、反应后氢原子的个数减少 D、反应前后催化剂的性质不变
A、该反应生成的两种分子的个数比为1:4 B、反应前后元素的化合价均不变 C、反应后氢原子的个数减少 D、反应前后催化剂的性质不变 -
4、屠呦呦团队从青蒿中提取青蒿素(C15H22O5),挽救了上亿人的生命。下列有关青蒿素的说法正确的是A、属于氧化物 B、碳、氢元素质量比为15:22 C、含有42个原子 D、青蒿素中氢元素质量分数最小
-
5、侯德榜发明联合制碱法,打破了国外对制碱技术的封锁。二氧化碳和氨气是两种重要的制碱原料。下列关于这两种气体相关实验的说法正确的是
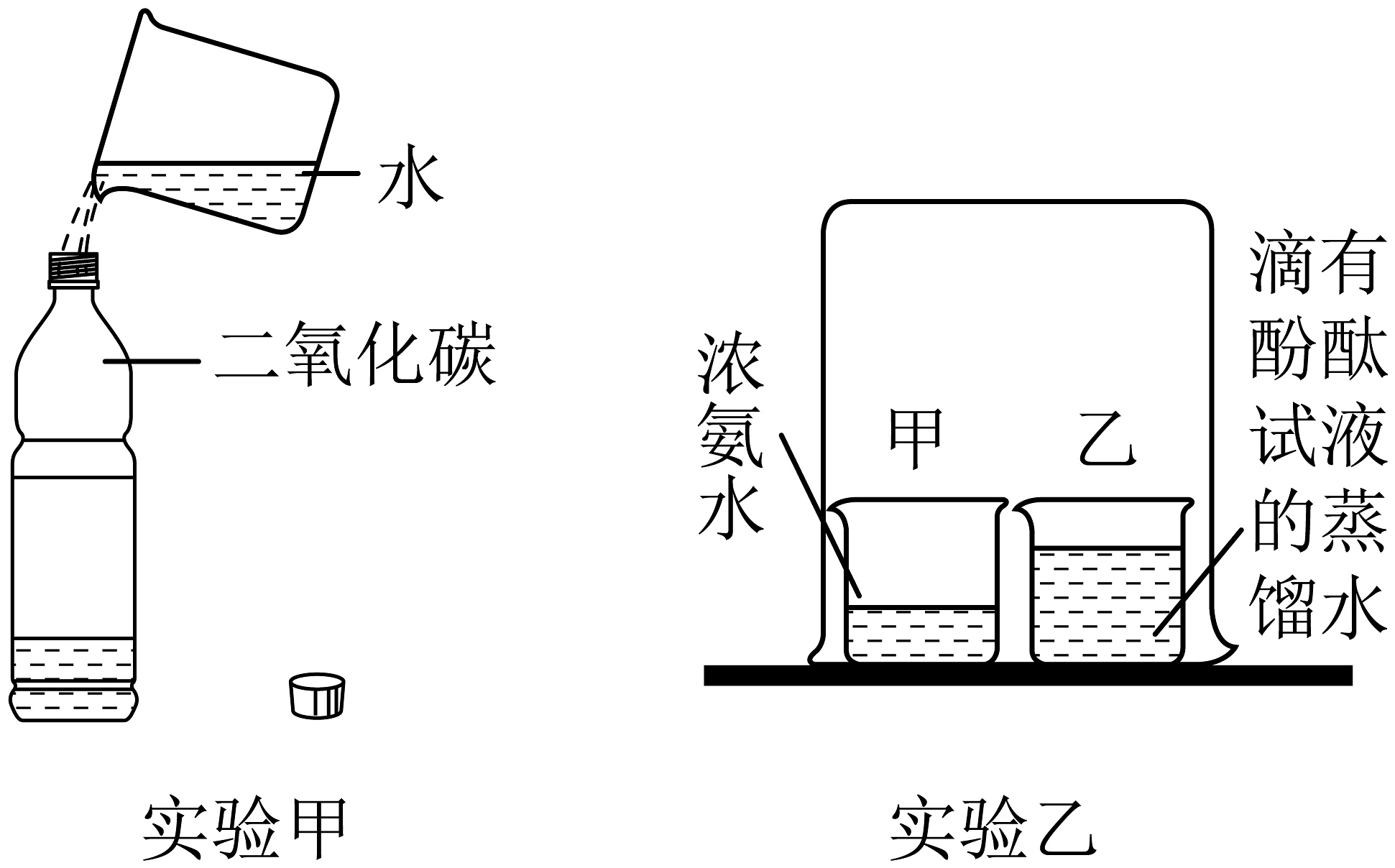 A、实验甲中只发生了物理变化 B、实验甲证明二氧化碳能溶于水 C、实验乙中可以观察到烧杯甲变为红色 D、实验乙中酚酞分子没有运动
A、实验甲中只发生了物理变化 B、实验甲证明二氧化碳能溶于水 C、实验乙中可以观察到烧杯甲变为红色 D、实验乙中酚酞分子没有运动 -
6、张青莲院士精确测定了铟、锌等9种化学元素的相对原子质量。下图1为元素周期表中铟元素的信息,图2为实验室制取氢气的装置。下列说法正确的是
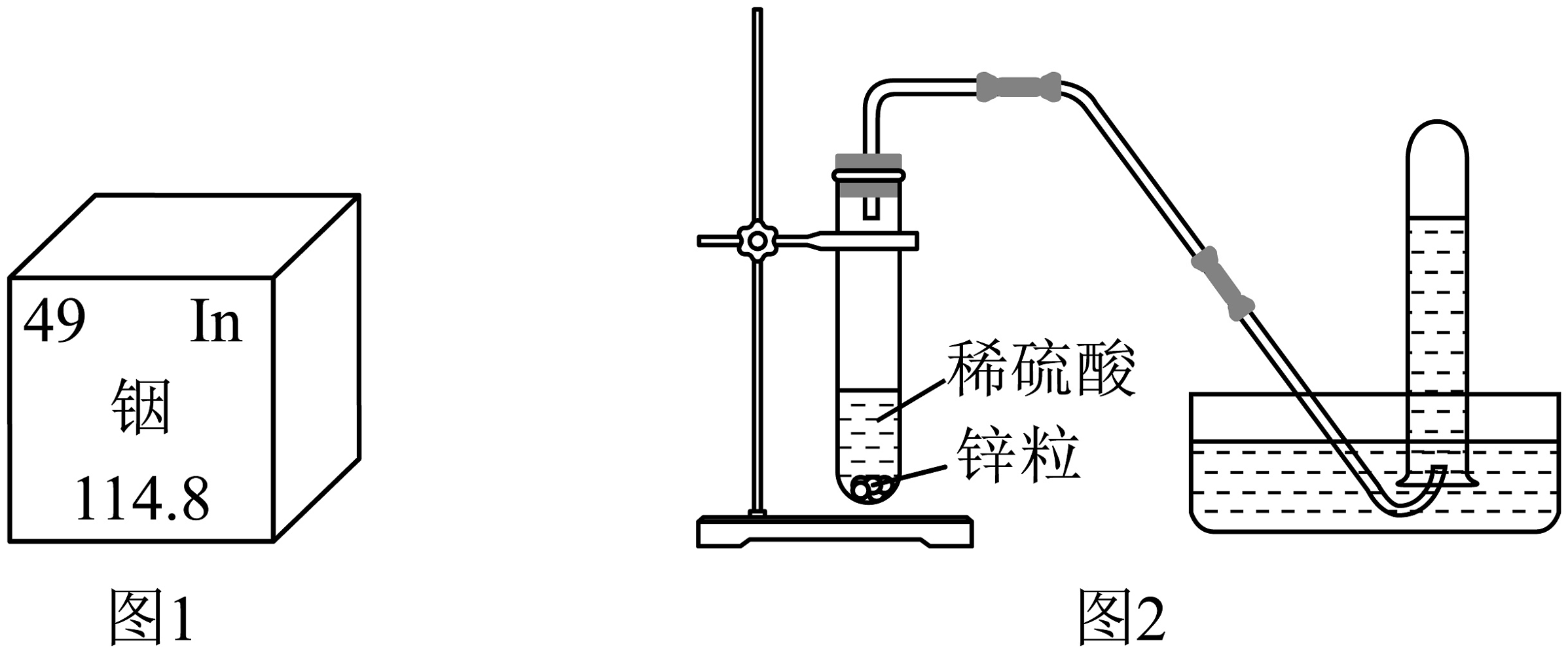 A、铟元素是金属元素 B、铟的相对原子质量为114.8g C、铟原子的中子数为49 D、用排水法收集氢气,点燃前不用验纯
A、铟元素是金属元素 B、铟的相对原子质量为114.8g C、铟原子的中子数为49 D、用排水法收集氢气,点燃前不用验纯 -
7、中国近代化学先驱徐寿翻译西方化学著作、规范化学用语,下列书写正确的是A、NaCO3:碳酸钠 B、N2:2个氮原子 C、二氧化硫中硫元素的化合价: D、3H:3个氢元素
-
8、推动绿色发展,促进人与自然和谐共生,下列做法与该理念不相符的是A、分类回收生活垃圾 B、推广使用煤炭燃料 C、工业废水处理后排放 D、使用新型可降解塑料
-
9、智能机器人在生活中发挥着重要作用,以下应用过程中涉及化学变化的是A、导览讲解
 B、送餐服务
B、送餐服务 C、消防灭火
C、消防灭火 D、清扫灰尘
D、清扫灰尘
-
10、近年来,我国科技发展日新月异,科技成果层出不穷。下列科技成果中,主要属于化学研究范畴的是A、神舟十七号飞船发射轨道的设定 B、利用二氧化碳人工合成淀粉 C、研究北斗卫星的运动情况 D、人工智能软件的研发
-
11、 生活污水任意排放会导致环境污染,需经过处理,符合我国相应的国家标准后才可以排放或者循环使用,思考乐佳佳调查后发现某污水厂处理污水流程如下。
 (1)、格栅分离的原理类似于思考乐苏苏同学在实验室中操作。(2)、思考乐宽宽同学发现上述处理过程中,有化学反应的是池(任写一个)(3)、思考乐锐锐发现二级处理前一般不加消毒剂,原因是?(4)、思考乐亚亚和嘉贤用三级处理之后的“中水”(里面含有少量氯气)养鱼,他们为了养观赏鱼,亚亚和嘉贤会使用鱼乐宝净化水,鱼乐宝主要成分 , 用消除氯气,假设每片药丸含有 , 请问平均每片鱼乐宝能消除多少氯气?(相对分子质量为158)(5)、为什么鱼乐宝使用中有安全隐患?请帮助思考乐桐斌和强飞根据反应原理说明理由。
(1)、格栅分离的原理类似于思考乐苏苏同学在实验室中操作。(2)、思考乐宽宽同学发现上述处理过程中,有化学反应的是池(任写一个)(3)、思考乐锐锐发现二级处理前一般不加消毒剂,原因是?(4)、思考乐亚亚和嘉贤用三级处理之后的“中水”(里面含有少量氯气)养鱼,他们为了养观赏鱼,亚亚和嘉贤会使用鱼乐宝净化水,鱼乐宝主要成分 , 用消除氯气,假设每片药丸含有 , 请问平均每片鱼乐宝能消除多少氯气?(相对分子质量为158)(5)、为什么鱼乐宝使用中有安全隐患?请帮助思考乐桐斌和强飞根据反应原理说明理由。 -
12、 铜具有重要战略价值。古代以黄铜矿(其主要成分为)为原料,运用火法炼铜工艺得到铜。现代在火法炼铜工艺的基础上发展出闪速炼铜工艺。思考乐永浩同学对比二者原理如图:
 (1)、“闪速炼铜”速率远快于“火法炼铜”,思考乐科科同学由此可知,炼铜需要将黄铜矿颗粒粉末研磨得更细。(2)、火法炼铜中,思考乐林达同学发现持续向中鼓入空气并维持高温状态,这说明反应是(吸收/放出)热量,反应的化学方程式。(3)、反应生成的可用于工业制造一种酸,请帮助思考乐嘉煜同学写出这种酸(化学式);可被石灰乳吸收,请说明其吸收效果优于石灰水的原因:。(4)、火法炼铜中,炉渣是由2种物质化合生成的,请帮助俊基同学写出沙子提供的物质(填化学式)。(5)、对比火法炼铜,思考乐怡妍同学发现闪速炼铜的优势有(填序号)。
(1)、“闪速炼铜”速率远快于“火法炼铜”,思考乐科科同学由此可知,炼铜需要将黄铜矿颗粒粉末研磨得更细。(2)、火法炼铜中,思考乐林达同学发现持续向中鼓入空气并维持高温状态,这说明反应是(吸收/放出)热量,反应的化学方程式。(3)、反应生成的可用于工业制造一种酸,请帮助思考乐嘉煜同学写出这种酸(化学式);可被石灰乳吸收,请说明其吸收效果优于石灰水的原因:。(4)、火法炼铜中,炉渣是由2种物质化合生成的,请帮助俊基同学写出沙子提供的物质(填化学式)。(5)、对比火法炼铜,思考乐怡妍同学发现闪速炼铜的优势有(填序号)。a.高温更少,节约能源 b.原料更少,节省成本 c.无污染
-
13、 回答下列问题。
室温加水
加热
生成溶液
无明显现象
生成溶液
生成二氧化碳
生成溶液和氧气
迅速生成氧气,爆炸
(1)、思考乐世伟同学不慎将洗鼻盐撒到稀盐酸中,有气泡产生,小组成员利梅同学决定探究洗鼻盐的成分,经萧扬同学实验证明,产生的气体无色无味,能使澄清石灰水变浑浊。澄清石灰水变浑浊的化学方程式是。(2)、再良同学认为可以先对洗鼻水进行加热,然后再进行其余检验,浩浩同学认为不对。请你写出浩浩认为不对的理由。洗鼻盐中另有一类含钠元素的盐类是什么?
(3)、猜想一:;猜想二:;猜想三:。家乐同学将洗鼻盐加入蒸馏水中,实验现象为大试管中出现水雾,(填写现象),雯俊同学得出结论,猜想三是错误的。
(4)、碳酸氢钠加热后能生成二氧化碳,曼妮同学已经把这个洗鼻水放到了大试管中,塞入带导管的橡胶塞,(写实验操作步骤),证明猜想二是对的。(5)、碳酸氢钠受热分解产生二氧化碳,请帮助苑婷同学写出化学方程式:。(6)、用相同浓度的浓盐水配制等质量的0.9%的盐水A和2.6%的盐水B,请问配制成A溶液加的蒸馏水多,还是配制成B溶液加的蒸馏水多?(7)、洗鼻盐在下保存。 -
14、 【科普阅读】
阅读短文,回答问题:
探月工程发现月球上有一定量的钛酸亚铁矿,钛酸亚铁矿的主要成分为 , 思考乐芳芳同学通过研究嫦娥五号月壤不同矿物中的氢含量,提出一种全新的基于高温氧化还原反应生产水的方法。科研人员文丽同学发现,月壤矿物由于太阳风亿万年的辐照,储存了大量氢。氢元素以氢原子的形式嵌在中,氢原子在月壤中可以稳定存在。思考乐玲玲同学听说我国科学家利用氢和氧化亚铁,在高温条件下制得了水和铁。当温度升高至以上时,月壤将会熔化,反应生成的水将以水蒸气的方式释放出来。
 (1)、中Ti元素化合价为+4价,中Fe化合价为:;图中铁原子的质子数是:。(2)、 , 请帮助思考乐建豪同学写出电解水的化学方程式: , “人造空气”中除有大量少量之外,还有(3)、思考乐赵林同学说为了使(2)中制得的铁硬度更大,耐腐蚀性更强,可以将铁制成。
(1)、中Ti元素化合价为+4价,中Fe化合价为:;图中铁原子的质子数是:。(2)、 , 请帮助思考乐建豪同学写出电解水的化学方程式: , “人造空气”中除有大量少量之外,还有(3)、思考乐赵林同学说为了使(2)中制得的铁硬度更大,耐腐蚀性更强,可以将铁制成。 -
15、 思考乐伟杰同学如图1通过针筒改变试管内压强,图2为少闯同学发现的pH值随气压变化的关系,下列说法错误的是( )
 A、pH随气压增大而减小 B、当活塞吸气时,pH值变大,发生了反应② C、当气压小到一定程度时,瓶内pH值会大于7 D、将剩余的水换成NaOH时,质量会减少
A、pH随气压增大而减小 B、当活塞吸气时,pH值变大,发生了反应② C、当气压小到一定程度时,瓶内pH值会大于7 D、将剩余的水换成NaOH时,质量会减少 -
16、 下列思考乐佳乐同学和娥冰同学实验中能达到相应实验目的的是( )
实验
方法
A.除去铁钉表面的铁锈
加入过量稀硫酸
B.除去中少量的
用燃着的木条
C.鉴别碳粉和
加水观察是否溶解
D.检验NaOH溶液是否变质
加入过量HCl
A、A B、B C、C D、D -
17、 下图为探究燃烧条件的微型实验装置示意图,思考乐傲傲同学实验前先通入至充满装置再往烧杯中加热水。下列傲傲同学的说法正确的是( )
 A、加入热水后,白磷未燃烧,是因为温度未达到白磷着火点 B、推动注射器活塞,白磷燃烧,红磷仍不燃烧,说明燃烧需要可燃物 C、白磷燃烧时再通入 , 白磷停止燃烧,说明隔绝可灭火 D、思考乐傲傲同学指出本实验制备需要的反应物有2种
A、加入热水后,白磷未燃烧,是因为温度未达到白磷着火点 B、推动注射器活塞,白磷燃烧,红磷仍不燃烧,说明燃烧需要可燃物 C、白磷燃烧时再通入 , 白磷停止燃烧,说明隔绝可灭火 D、思考乐傲傲同学指出本实验制备需要的反应物有2种 -
18、 和是两种常见的氮肥,二者溶解度曲线如图所示,下列思考乐骥翔同学和思考乐帆帆同学说法正确的是( )
 A、的溶解度比的溶解度小 B、将的饱和溶液升温至80℃,溶质质量分数会增大 C、时饱和溶液质量分数为45.8% D、80℃时将加入200g水中,会形成不饱和溶液
A、的溶解度比的溶解度小 B、将的饱和溶液升温至80℃,溶质质量分数会增大 C、时饱和溶液质量分数为45.8% D、80℃时将加入200g水中,会形成不饱和溶液 -
19、 海洋资源是我国珍贵的自然资源,如图是思考乐丁丁同学发现的海水的主要成分,箭头表示不同物质间能转换,下列关于海水资源利用过程错误的是( )
 A、思考乐志雄同学提出步骤①可以通过蒸发实现 B、②所需的设备需要抗腐蚀性能强 C、③中低钠食盐含有的KCl可以补充人体中的K元素 D、若④的产物只有两种单质,则另一种生成物为
A、思考乐志雄同学提出步骤①可以通过蒸发实现 B、②所需的设备需要抗腐蚀性能强 C、③中低钠食盐含有的KCl可以补充人体中的K元素 D、若④的产物只有两种单质,则另一种生成物为 -
20、 下表中,思考乐钊钊同学的陈述1和思考乐召程同学陈述2完全正确且相关联的是( )
陈述1
陈述2
A
潜水时需要携带氧气瓶
氧气具有助燃性
B
铜和硝酸银反应生成银
铜的金属活动性比银强
C
稀硫酸洒到大理石地面生成气体
实验室用稀硫酸和大理石制取二氧化碳
D
水结成冰后停止流动
结冰后,水分子停止运动
A、A B、B C、C D、D