相关试卷
-
1、上述过程中,I可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O ⅱ.I2+2H2O+SO2=SO42-+4H++2I-
某同学为探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号
1
2
3
4
试剂组成
0.4mol/LKI
amol/LKI
0.2mol/LH2SO4
0.2mol/LH2SO4
0.2mol/LKI
0.0002mol I2
实验现象
溶液变黄,一段时间后出现浑浊
溶液变黄,出现浑浊较组1块
无明显现象
溶液由棕褐色很快褪色,变成黄色,出现浑浊较组1块
(1)、第2组是第1组实验的对比组,则a= 。(2)、通过比较第1、2、3组实验,可得出的结论是 。(3)、该同学还模拟了实验室用海带制备I2的实验,以下操作错误的是( )。 A、过滤海带浸泡液 B、向浸泡液中通入Cl2氧化 C、含I2的CCl4溶液从下口放出 D、提取I2的同时回收溶剂
A、过滤海带浸泡液 B、向浸泡液中通入Cl2氧化 C、含I2的CCl4溶液从下口放出 D、提取I2的同时回收溶剂 -
2、近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
 (1)、已知反应I:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g) ΔH1=551kJ/mol
(1)、已知反应I:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g) ΔH1=551kJ/mol反应III:S(s)+O2(g) SO2(g) ΔH3=—297kJ/mol
所以反应II的热化学方程式为。
(2)、试从绿色化学的角度列举该过程的优势与不足:。 -
3、不管是与蛋白质合成密切相关的氨基酸,还是维生素中能找到S元素的身影。有一瓶Na2SO3溶液,它可能部分被氧化。某同学取少量该溶液,滴加BaCl2溶液,产生白色沉淀;再加入足量稀硫酸,充分振荡后仍有白色沉淀。下述结论中,正确的是( )。A、亚硫酸钠已部分被氧化 B、加入BaCl2溶液后,沉淀中一定含有BaSO4 C、加稀硫酸后,不溶的沉淀一定是BaSO4 D、此实验能确定Na2SO3是否部分被氧化
-
4、【不定项】已知水合肼(N2H4•H2O)具有较强还原性,通常可被氧化为N2。现用如图流程可制得较纯的单质Pt,下列有关说法不正确的是( )。
 A、王水(由浓盐酸与浓硝酸组成)与粗Pt反应时仅体现氧化作用 B、NO3-中N原子的杂化轨道类型为sp2 , 空间结构为平面三角形 C、脱硝除去残余的HNO3和氮氧化物,主要目的是防止其污染环境 D、由PtO2制得1mol纯Pt,除脱销过程外理论上只需要1molN2H4•H2O作还原剂
A、王水(由浓盐酸与浓硝酸组成)与粗Pt反应时仅体现氧化作用 B、NO3-中N原子的杂化轨道类型为sp2 , 空间结构为平面三角形 C、脱硝除去残余的HNO3和氮氧化物,主要目的是防止其污染环境 D、由PtO2制得1mol纯Pt,除脱销过程外理论上只需要1molN2H4•H2O作还原剂 -
5、联氨(N2H4)可用于处理锅炉水中的溶解氧,一种反应机理如下图所示。
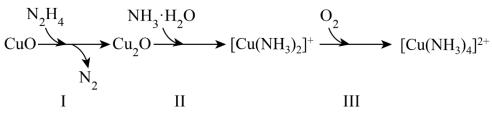 (1)、NH3的电子式为。(2)、[Cu(NH3)4]2+中,中心离子是 ,配位数是。(3)、写出反应I的化学方程式,并用单线桥法表示电子转移的方向和数目: 。
(1)、NH3的电子式为。(2)、[Cu(NH3)4]2+中,中心离子是 ,配位数是。(3)、写出反应I的化学方程式,并用单线桥法表示电子转移的方向和数目: 。 -
6、部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是( )。
 A、液态a可用作制冷剂,g是农业上常用的化肥 B、b→a、b→c的转化都属于氮的固定 C、工业上由b出发制备e的路线:
A、液态a可用作制冷剂,g是农业上常用的化肥 B、b→a、b→c的转化都属于氮的固定 C、工业上由b出发制备e的路线: D、足量e的稀溶液与6.4g铜粉反应时,可以生成4.48L气体d
D、足量e的稀溶液与6.4g铜粉反应时,可以生成4.48L气体d
-
7、过去,联氨和四氧化二氮的组合是航天领域液体火箭发动机的重要燃料之一,但是不可忽略的一点却是,联氨极不稳定、易挥发,且对人体有毒有害。根据下列实验操作及现象,得出结论正确的是( )
选项
操作及现象
结论
A
蘸有浓氨水的玻璃棒靠近浓硝酸,产生“白烟”
浓硝酸易分解
B
向紫色石蕊溶液中通入足量的SO2 , 溶液只变红,不褪色
SO2没有漂白性
C
向NaHCO3溶液中滴加盐酸,产生了CO2
非金属性:Cl>C
D
向含淀粉的KI溶液中滴加少量氯水,溶液变蓝色
氧化性:Cl2>I2
A、A B、B C、C D、D -
8、【不定项】下列关于二氧化碳的说法正确的是( )。A、电子式为
 B、空间填充模型为
B、空间填充模型为 C、CO2是极性分子,能溶于水
D、CO2的水溶液能够导电,但CO2是非电解质
C、CO2是极性分子,能溶于水
D、CO2的水溶液能够导电,但CO2是非电解质
-
9、“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域,主要是二氧化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了!
已知25℃时,H2CO3的Ka1=4.2×10-7 Ka2=4.8×10-11 , HCN的Ka=4.0×10-10 , 若向NaCN溶液中通入少量CO2 , 发生反应的离子方程式为。
-
10、某实验小组为探究Fe与Fe3+能否发生氧化还原反应,试设计对应的双液原电池。
-
11、已知铁是第26号元素,铁在元素周期表中的位置是 ,基态铁原子价电子轨道表示式为 ,其核外有 种不同运动状态的电子。
-
12、詹姆斯·韦伯太空望远镜捕捉到第一批火星图像。火星本身不发光,其红色的外观源于表层土壤中丰富的铁元素及反射的太阳光。火星反射的光线通过气态原子后经过棱镜色散分光后得到了一系列不连续的暗线,该光谱属于 (填“吸收”或“发射”)光谱。
-
13、月球表面的铁元素以铁单质和亚铁离子形式存在 , 但是在嫦娥五号取回的微陨石撞击处的月壤样品中存在大量的Fe3+ , 推测在含该样品产生Fe3+的原因可能是( )(铁元素以单质或氧化物表示)。A、3FeO=Fe+Fe2O3 B、Fe3O4=FeO+Fe2O3 C、Fe+FeO+O2= Fe2O3 D、FeO+ Fe2O3= Fe3O4
-
14、人类对星辰大海的向往从未停止,探索浩瀚宇宙的步伐永无尽头。“祝融号”在火星上探测发现了大量矿物,含有原子序数依次增大的4种短周期元素X、Y、Z、W——X的氢化物水溶液呈碱性,Y元素原子最外层电子数是Z的3倍,Z元素原子M层电子数等于K层电子数,W元素最高价和最低价代数和为零。下列叙述正确的是( )。A、原子半径:W>Z>X>Y B、ZY和WY2都是离子化合物 C、X的最高价氧化物对应水化物是强酸 D、最简单氢化物的沸点:X>Y
-
15、作为化石燃料燃烧产生的废气,是主要的温室气体之一。使用电化学方法能够对(进行吸收。利用活泼金属与二氧化碳的反应,能够构建金属电池。其中一种电池的模型如下图所示:(图中是固体)。
 (1)、下列有关该原电池的说法中,正确的是( )(单选)A、该原电池工作时,电子由正极向负极移动 B、在该原电池中,石墨作为负极 C、原电池工作时,正离子一定向正极方向移动 D、原电池工作时,b电极发生氧化反应(2)、给出该原电池的正极反应以及总反应。
(1)、下列有关该原电池的说法中,正确的是( )(单选)A、该原电池工作时,电子由正极向负极移动 B、在该原电池中,石墨作为负极 C、原电池工作时,正离子一定向正极方向移动 D、原电池工作时,b电极发生氧化反应(2)、给出该原电池的正极反应以及总反应。正极:
总反应:
(3)、原电池中每转移1mol电子,能够吸收molCO₂。(4)、若二氧化碳中混有氧气,那么在a电极上会出现可能会出现的杂质是。(5)、利用电解池,通过电化学还原,CO₂能够被还原为低价碳化合物。一种电化学还原二氧化碳的装置能够将二氧化碳还原为甲酸(HCOOH),该装置中,石墨作为阳极,单质银作为阴极,电解质溶液是硫酸溶液。
在该装置中,应该向极(填“阴”或“阳”)附近通入CO₂气体。(6)、写出CO₂在该电极上反应的电极反应式:。(7)、下列做法中,能够加速CO₂吸收速率的是( )(双选)。A、适当增大电源电压 B、适当降低电解液温度 C、适当缩小两电极间距 D、适当降低通入CO₂的速度(8)、当电极上生成5.6L(标准状况)的氧气时,生成甲酸的质量为g。 -
16、以下是有关铝的实验探究,请回答相关问题:(1)、用铝粉和Fe₂O₃做铝热反应实验,需要的试剂还有( )(双选)。A、KCl B、KClO₃ C、MnO₂ D、Mg(2)、镁能发生和铝类似的“镁热反应”,写出镁在高温下和反应的化学方程式。(3)、向集满CO₂的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:。(4)、向铝粉中添加少量NH₄Cl固体并充分混合,将其加热到1000℃时可与N₂反应制备AlN,下列说法正确的是( )(单选)。A、AIN是一种金属材料 B、AIN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 C、少量NH₄Cl能够破坏Al表面的Al₂O₃薄膜 D、AIN与足量盐酸反应的离子方程式为(5)、用打磨过的铝片进行如下实验,下列分析不合理的是( )(单选)。
 A、①中铝片发生了钝化 B、②中产生的气泡是氮氧化合物,不是氢气 C、③中沉淀溶解的离子方程式是Al(OH)₃+OH⁻=[Al(OH)₄]⁻ D、②中加水稀释过程中,仅发生了氧化还原反应(6)、为探究铝片(未打磨)与Na₂CO₃溶液的反应,实验如下:
A、①中铝片发生了钝化 B、②中产生的气泡是氮氧化合物,不是氢气 C、③中沉淀溶解的离子方程式是Al(OH)₃+OH⁻=[Al(OH)₄]⁻ D、②中加水稀释过程中,仅发生了氧化还原反应(6)、为探究铝片(未打磨)与Na₂CO₃溶液的反应,实验如下:

无明显现象
铝片表面产生细小气泡
出现白色沉淀,产生大量气泡(经检验为H₂和CO₂)
下列说法不正确的是( )(单选)。
A、溶液中存在水解平衡: B、对比Ⅰ、Ⅲ,推测Na₂CO₃溶液能破坏铝表面的氧化膜 C、Ⅳ溶液中可能存在大量Al³⁺ D、推测出现白色浑浊的可能原因:(7)、某铝土矿的主要成分为 , 还含有Fe₂O₃和SiO₂杂质。称取17.50g铝土矿样品,加入 200mL1.65mol/L的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的NaOH溶液,得到沉淀2.14g。①该试样中Fe₂O₃的物质的量为mol。
②样品中的=。
-
17、以硫酸厂矿渣(含Fe₂O₃、α-Al₂O₃、SiO₂等)为原料制备铁黄[FeO(OH)]的一种工艺流程如图所示:

资料:i. α-Al₂O₃化学性质极不活泼,不溶于水也不溶于酸或碱, γ-Al₂O₃不溶于水,可溶于强酸或强碱
ii.KₛₚCaCO₃=2.8×10⁻⁹;KₛₚFeCO₃=2×10⁻¹¹。(1)、将mg含Fe₂O₃·nH₂O的溶于200mLpH=1的硫酸溶液中,然后加入100mL氨水,使溶液中的Fe³⁺和Al³⁺恰好完全沉淀,则所加氨水的浓度为( )(单选)。A、0.2mol/L B、0.1mol/L C、0.05mol/L D、0.02mol/L(2)、向“酸浸”后的溶液中加入KSCN,溶液会变红,变红过程发生的离子方程式是。(3)、“滤渣”中主要成分为(填化学式)。(4)、“沉铁”过程中铁元素大部分转化为 FeCO₃,但往往有副产物Fe(OH)₂生成,分析原因是。(5)、若用CaCO₃“沉铁”, 则无副产物Fe(OH)₂产生,当反应完成时,溶液中 。(6)、下列物质中可以通过化合反应制备得到的是( )(双选)。A、FeCl₂ B、Fe(OH)₂ C、Fe(OH)₃ D、Fe₂O₃(7)、写出氧化过程生成铁黄的化学方程式。为确定“滤液”中Fe²⁺的物质的量浓度,选用K₂Cr₂O₇标准溶液滴定溶液中的Fe²⁺,离子方程式为(未配平)。
(8)、向滴定管中注入K₂Cr₂O₇标准溶液前,滴定管需要检漏、用蒸馏水洗涤和。(9)、若滴定xmL“滤液”中的Fe²⁺,消耗amol·L⁻K₂Cr₂O₇标准溶液bmL,则滤液中 -
18、某实验小组把CO₂通入饱和溶液制取装置如下图所示(气密性已检验,部分夹持装置略):
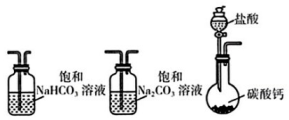 (1)、选取必要的实验装置,正确的连接顺序为(填序号)。
(1)、选取必要的实验装置,正确的连接顺序为(填序号)。为确定制得的固体样品是纯净的小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl₂溶液反应,观察现象
乙方案:测定pH法
(2)、为判定甲方案的可行性,某同学用)分析纯配制的溶液,与溶液等体积混合进行实验,结果如下:溶液 溶液
0.1mol⋅L⁻¹ 0.1mol⋅L⁻¹ 0.02mol⋅L⁻¹
0.2mol⋅L⁻¹浑浊
浑浊
少许浑浊
0.1mol⋅L⁻¹浑浊
少许浑浊
无现象
0.02mol⋅L⁻¹少许浑浊
无现象
无现象
此实验说明甲方案(填“可行”或“不可行”)。
(3)、产生浑浊(伴有气体产生)的离子方程式:。(4)、乙方案是:取等质量的固体样品和分析纯加等质量的水配制的溶液,分别与pH计测定pH,pH值更大的是(填化学式)。 -
19、汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法。”通过这种方法,他制备得到了金属钾和钠。(1)、戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:。(2)、关于金属钠,下列叙述正确的是( )(单选)。A、钠可保存在煤油或CCl₄等液态有机物中 B、氯化钠在电流作用下电离出的钠离子和氯离子 C、钠与硫在常温下化合就能剧烈反应,甚至发生爆炸 D、若金属钠着火,可采用干粉灭火器灭火(3)、钠在空气中燃烧产物的颜色是 , 电子式为。(4)、ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是。
-
20、在地壳里硅的含量在所有元素中居第二位,仅次于氧。接下来我们尝试利用元素周期表,通过与其相邻元素类比来了解硅的一些特点。(1)、硅在元素周期表中位于第周期族。(2)、晶体硅的结构和金刚石结构相似,碳化硅(SiC)也是一种具有类似于金刚石结构的晶体,其中碳原子核硅原子的位置是交替的。在①金刚石,②晶体硅,③碳化硅这三种晶体中,它们的熔点从高到低的顺序是( )(单选)。A、①③② B、③②① C、③①② D、②①③(3)、与铝类似,硅也能溶于强碱溶液并生成硅酸根(SiO₃²⁻)。写出硅与氢氧化钠反应的离子方程式:。(4)、比较元素非金属性:SiP(选填“<”或“>”),给出 个可以用来说明该结论的化学事实是:。(5)、二氧化硅一般不能与酸反应,但可以与氢氟酸发生如下反应:
二氧化硅属于(选填“酸性”、“碱性”或“两性”)氧化物。该反应涉及的所有元素中原子半径最小的是(填元素符号),生成物中属于极性分子的是(填化学式)。