相关试卷
-
1、酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面,其结构如图所示(Co参与形成的均为单键,部分化学键未画明) 下列说法正确的
 A、酞菁钴中三种非金属元素的电负性大小顺序为N>H>C B、酞菁钴中碳原子的杂化方式有sp2杂化和sp3杂化两种 C、与Co(Ⅱ)通过配位键结合的是2号和4号N原子 D、1号和3号N原子分别与周围3个原子形成的空间结构为平面三角形
A、酞菁钴中三种非金属元素的电负性大小顺序为N>H>C B、酞菁钴中碳原子的杂化方式有sp2杂化和sp3杂化两种 C、与Co(Ⅱ)通过配位键结合的是2号和4号N原子 D、1号和3号N原子分别与周围3个原子形成的空间结构为平面三角形 -
2、下列实验不能达到目的的是
A
B
C
D

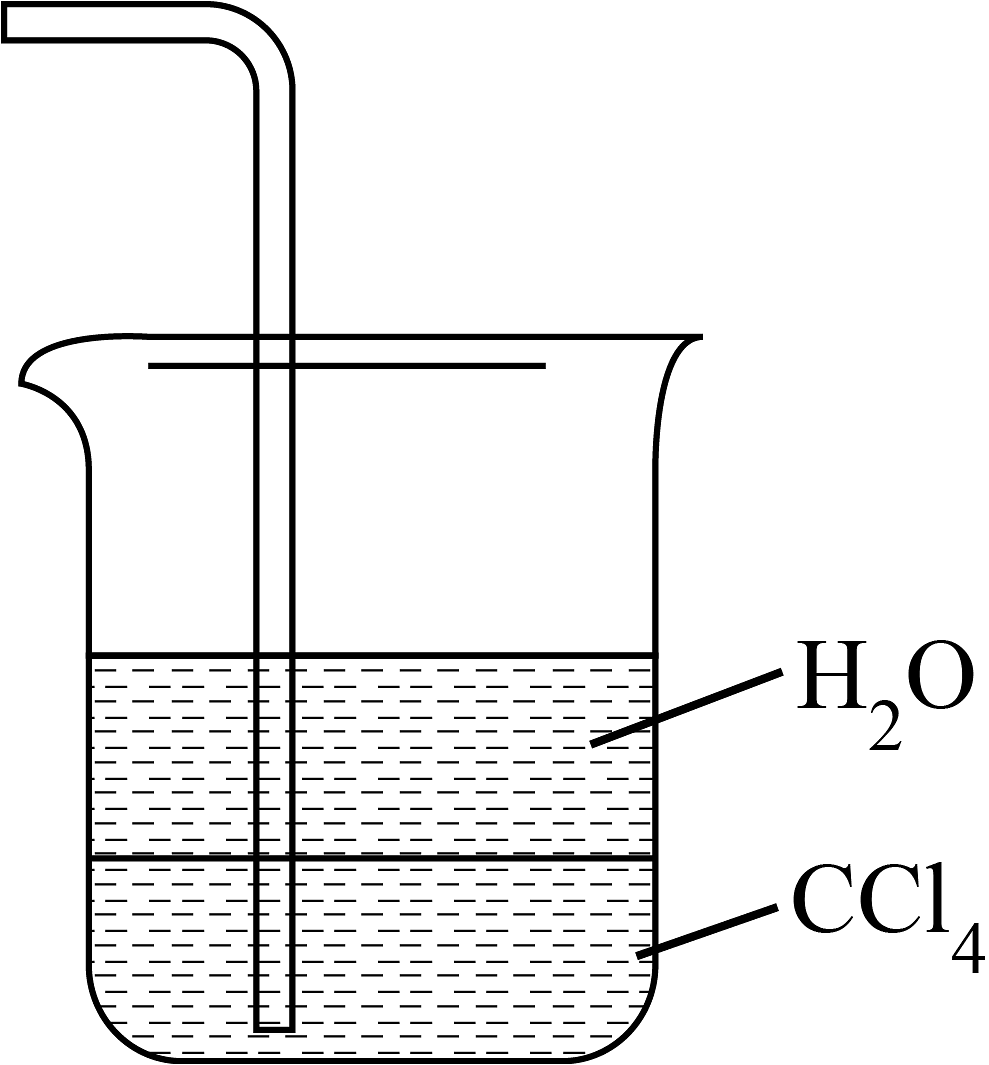

实验室制氨气
实验室氨气尾气吸收
用氯化氢气体和饱和食盐水作喷泉实验
验证浓的脱水性、强氧化性
A、A B、B C、C D、D -
3、下列装置不能达到实验目的的是
 A、图①可用于实验室制 B、图②可用于除去中少量的 C、图③可用于分离和 D、图④可用于制备明矾晶体
A、图①可用于实验室制 B、图②可用于除去中少量的 C、图③可用于分离和 D、图④可用于制备明矾晶体 -
4、聚乙烯醇()可用于制备滴服液,以乙烯为主要原料制备的一种路线如下图所示。

回答下列问题:
(1)、反应①、②的反应类型分别是、。(2)、也可以以乙烯为原料合成,写出工业上以乙烯为原料合成的化学方程式:。(3)、乙酸乙烯酯中所含的官能团名称为。(4)、反应⑤为加聚反应,写出该反应的化学方程式:。(5)、下列关于乙酸乙烯酯和的说法正确的有(填标号)。a.等质量的乙酸乙烯酯和完全燃烧消耗氧气的质量相等
b.乙酸乙烯酯和互为同系物
c.乙酸乙烯酯和都能使溴的溶液褪色
d.乙酸乙烯酯和都可以发生取代反应
(6)、写出3种与乙酸乙烯酯含有相同官能团的同分异构体:。 -
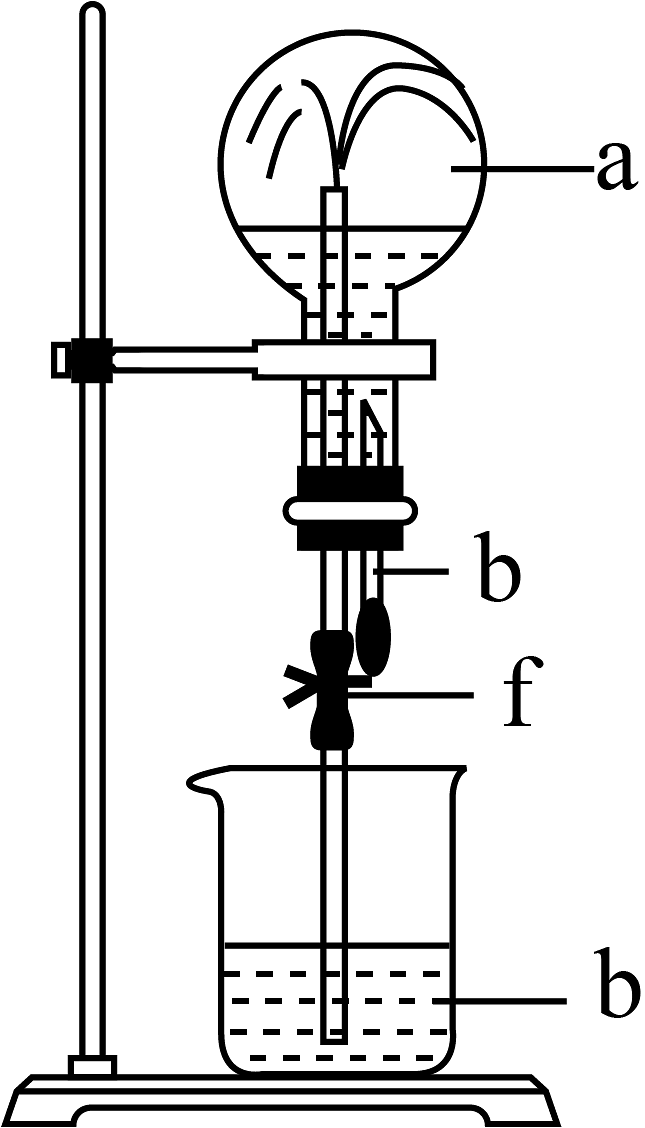
5、某小组同学欲探究的催化氧化反应,用下图所示装置进行实验。A、B装置可选用的药品有:浓氨水、溶液、蒸馏水、固体、。C、D装置为气体干燥装置。(部分夹持装置已略去)

回答下列问题:
(1)、催化氧化的化学方程式是。(2)、装置D的仪器名称为 , 盛放的试剂应为(填“无水”“碱石灰”或“无水”)。(3)、反应进行一段时间后,装置G中的溶液变成蓝色。请用离子方程式解释装置G中溶液变成蓝色的原因:。(4)、甲同学进行实验后观察到装置F中有红棕色气体生成,乙同学进行实验后观察到装置F中无红棕色气体生成,而有白烟生成,白烟的成分是(填化学式)。(5)、为帮助乙在装置F中也观察到红棕色气体,可在原实验的基础上进行改进,可以调节 , (填“增大”或“减小”)装置B中的产气量。(6)、为实现该反应,用图所示装置替换题目中所给装置的虚线框部分也可以达到实验目的,化合物X由两种短周期元素组成,且阴阳离子个数之比为 , 则X为(填化学式)。
-
6、黄铁矿高温煅烧除硫后的烧渣主要含有 , 某研究小组尝试用烧渣制取绿矾(),流程图如下。

已知:完全沉淀时的小于开始沉淀时的。
回答下列问题:
(1)、为提高烧渣的浸取速率,可采用的措施有(填标号)。a升高温度 b.将烧渣粉碎 c.增大烧渣用量 d.适当增大硫酸浓度 e.增大反应容器气压
(2)、滤渣I的主要成分是(填化学式)。(3)、试剂X可以选用多种物质,若X是一种非金属氧化物,写出还原过程中发生反应的离子方程式:。(4)、滤渣II的主要成分是(填化学式)。(5)、过滤II后的滤液为溶液,从溶液得到的一系列操作中应将溶液放置于(填仪器名称)中加热。(6)、绿矾容易被氧化变质,写出实验室中检验绿矾是否被氧化变质的操作和现象:。(7)、该研究小组取烧渣进行实验,最后得到绿矾的质量为 , 若从烧渣制取绿矾的流程中没有使用含铁的试剂,则烧渣中的质量百分数为。(假设流程中的铁元素全部转化到绿矾中) -
7、下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语回答下列问题:
族
周期
IA
0
1
IIA
IIIA
IVA
VA
VIA
VIIA
2
①
②
③
3
④
⑤
⑥
⑦是短周期元素中原子半径最大的元素(稀有气体元素除外)。
(1)、⑦在元素周期表中的位置是。(2)、画出⑥的简单离子结构示意图:。(3)、①、③、⑤的原子半径由小到大的顺序为(用原子符号表示)。(4)、④和⑥组成的化合物中化学键类型是。(5)、化合物X由③和⑦组成且两种元素物质的量之比为 , X的电子式是。(6)、④的单质和⑦的最高价氧化物对应水化物反应的离子方程式是。(7)、下列化合物中属于强酸的有(填标号)。a.⑥的简单氢化物 b.②的简单氢化物
c.①的最高价氧化物对应水化物 d.②的最高价氧化物对应水化物
-
8、柠檬酸加热时可发生如下的转化:

下列说法正确的是
A、柠檬酸、顺乌头酸、异柠檬酸互为同分异构体 B、柠檬酸可以在Cu作催化剂、加热的条件下与O2发生催化氧化反应 C、1mol柠檬酸与足量NaOH溶液反应,最多可以消耗4molNaOH D、顺乌头酸转化为异柠檬酸的反应属于加成反应 -
9、工业上用某种氧化铝矿石(含Fe2O3杂质)为原料冶炼铝的工艺流程如下图所示:

对上述流程的判断正确的是
A、试剂X可以为NaOH溶液,“沉淀”中含有铁的化合物 B、CO2可以用稀硫酸或稀盐酸代替 C、Y为Na2CO3溶液 D、工业上还可采用Fe高温还原Al2O3的方法制Al -
10、工业上从含硒的废液中提取硒的方法之一是用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸 , 再与盐酸共热,硒酸转化为亚硒酸,反应方程式为。在亚硒酸溶液中通入 , 有单质硒析出。下列说法错误的是A、氧化性: B、亚硒酸与生成单质硒的反应可能生成 C、析出硒需要消耗标准状况下 D、亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸
-
11、W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体:Y是短周期主族元素中金属性最强的元素;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是A、X与W元素、X与Y元素都可形成不止一种二元化合物 B、W的氧化物对应的水化物是氧化性强酸 C、最简单氢化物的稳定性: D、最简单氢化物的沸点:
-
12、下图是实验室进行制备与性质实验的组合装置,部分固定装置和装置B前后的干燥装置未画出。下列有关说法确的是
 A、为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 B、关闭 , 打开 , 滴加硫酸,则装置B中每消耗 , 转移电子 C、关闭 , 打开 , 试剂X是酸性溶液或溶液,均可证明有还原性 D、实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
A、为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 B、关闭 , 打开 , 滴加硫酸,则装置B中每消耗 , 转移电子 C、关闭 , 打开 , 试剂X是酸性溶液或溶液,均可证明有还原性 D、实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 -
13、某温度下,化学反应的能量变化如下图所示,分子内原子均以单键结合。则下列说法正确的是
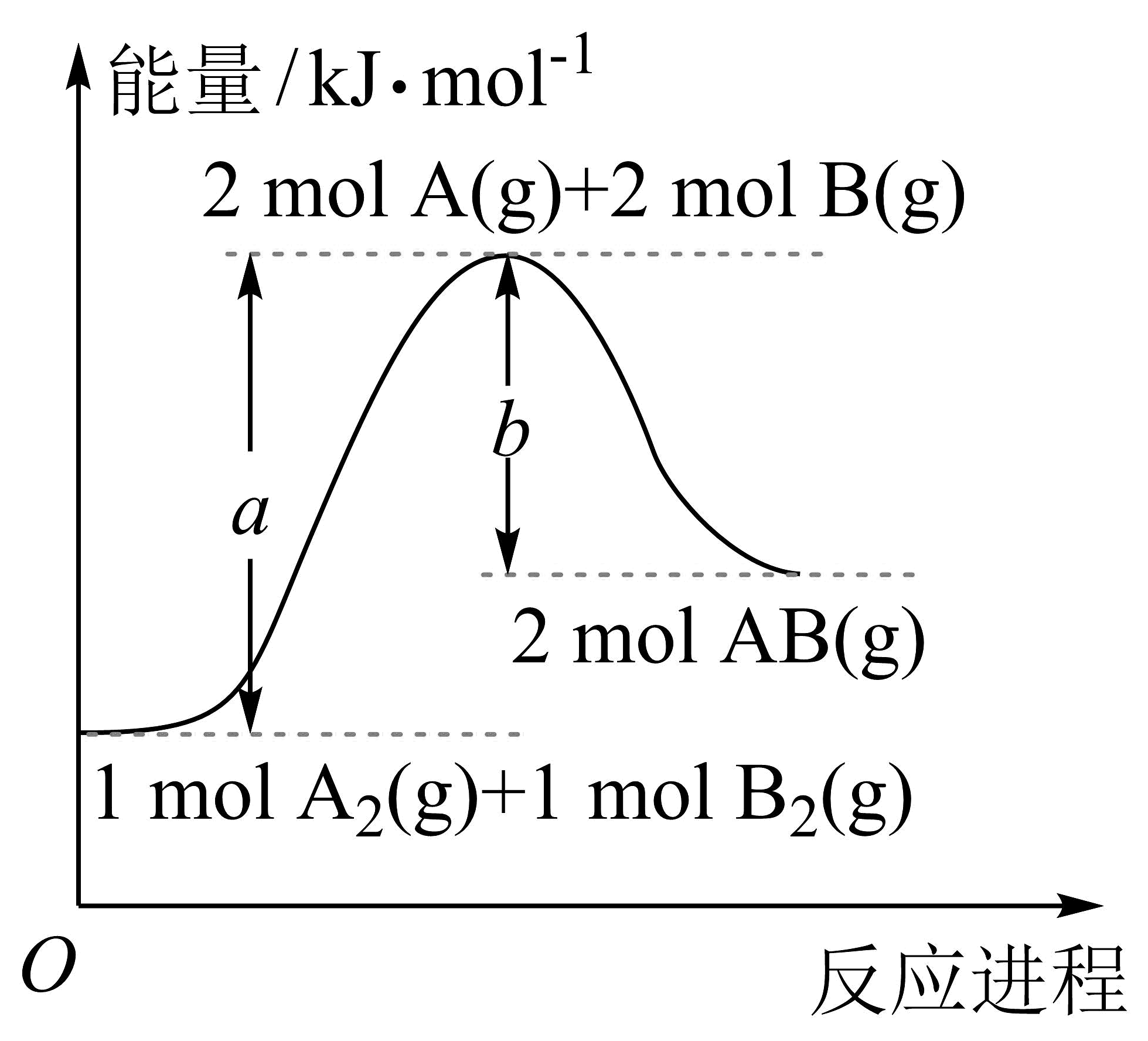 A、该反应是放热反应 B、加入催化剂可以改变反应的热效应 C、断裂需要吸收的能量 D、和具有的能量为
A、该反应是放热反应 B、加入催化剂可以改变反应的热效应 C、断裂需要吸收的能量 D、和具有的能量为 -
14、一种锌-溴电池原理示意图如下图所示,隔膜为阳离子交换膜(只允许阳离子通过)。下列说法错误的是
 A、电子从电极a经导线流向电极b B、在电池内部,阳离子由电极a往电极b方向移动 C、电极b为负极,发生的电极反应为 D、每消耗 , 理论上转移电子
A、电子从电极a经导线流向电极b B、在电池内部,阳离子由电极a往电极b方向移动 C、电极b为负极,发生的电极反应为 D、每消耗 , 理论上转移电子 -
15、反应在一可变容积的容器中进行反应,下列条件的改变对其反应速率几乎无影响的是A、将容器的体积缩小一半 B、保持体积不变,充入N2 C、保持体积不变,升高温度 D、压强不变,充入N2使体积增大
-
16、下列离子能大量共存的是A、 B、 C、 D、
-
17、下列有关电极方程式或离子方程式书写正确的是A、过量NaHSO3溶液与澄清石灰水混合: B、氯气与水反应: C、锌、铜和稀硫酸组成的原电池正极发生的反应: D、硝酸亚铁稀溶液中加入稀硫酸:
-
18、下列实验装置或操作正确且能达到实验目的的是(部分夹持装置已略去)


A.制取并收集NH3
B.除去Cl2气体中混有的少量HCl气体


C.分离粗盐中的不溶物
D.灼烧碎海带
A、A B、B C、C D、D -
19、下列说法不正确的是A、食用油在空气中放置过久产生“哈喇”味,是因为其中的某些有机物发生了氧化反应 B、糖类都能在加热条件下与新制氢氧化铜反应生成砖红色沉淀 C、聚乙烯不能使酸性高锰酸钾溶液褪色 D、医用酒精消毒的原理是使蛋白质变性
-
20、下列化学用语表达错误的是A、HClO的电子式:
 B、质量数为195、中子数为117的铂原子:
C、乙醇的球棍模型:
B、质量数为195、中子数为117的铂原子:
C、乙醇的球棍模型: D、乙醛的结构简式:CH3COH
D、乙醛的结构简式:CH3COH